Diferencia entre revisiones de «Cianuro de potasio»
m (Texto reemplazado: «<div align="justify">» por «») |
|||
| (No se muestran 6 ediciones intermedias de 2 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | {{ | + | {{Ficha de compuesto químico |
| − | |nombre= Cianuro de potasio | + | |nombre = Cianuro de potasio |
| − | |imagen= cianurodep.jpg | + | |imagen = cianurodep.jpg |
| − | | | + | |tamaño de imagen = |
| − | | | + | |pie de imagen = |
| − | | | + | |imagen2 = |
| − | | | + | |tamaño de imagen2 = |
| − | | | + | |pie de imagen2 = |
| − | | | + | |IUPAC = |
| − | | | + | <!-- General --> |
| − | | | + | |otros nombres = Cianuro potásico |
| − | | | + | |símbolo = |
| − | | | + | |fórmula1 = KCN |
| − | | | + | |fórmula2 = |
| − | | | + | |fórmula3 = |
| − | | | + | <!-- Identificadores --> |
| − | | | + | |ATC = |
| − | | | + | |ATC0 = |
| − | | | + | |ATC1 = |
| − | | | + | |CAS = |
| − | | | + | |RTECS = |
| − | | | + | |ChEBI = |
| − | | | + | |ChemSpiderID = |
| − | | | + | |DrugBank = |
| − | + | |PubChem = | |
| − | '''Cianuro de potasio'''. El [[cianuro]] de [[potasio]] o KCN es una sal inorgánica denominada sal de potasio del cianuro de hidrógeno o ácido hidrociánico. | + | |UNII = |
| + | <!-- Propiedades físicas --> | ||
| + | |estado = | ||
| + | |apariencia = | ||
| + | |dens1 = 1520 | ||
| + | |dens2 = | ||
| + | |masa = | ||
| + | |PFK = 907 | ||
| + | |PFC = 634 | ||
| + | |PEK = 1898 | ||
| + | |PEC = 1625 | ||
| + | |PDK = | ||
| + | |PDC = | ||
| + | |TCK = | ||
| + | |TCC = | ||
| + | |PC = | ||
| + | |presión vapor = | ||
| + | |cristal = | ||
| + | |visco = | ||
| + | |índice refracción = | ||
| + | |dieléctrica = | ||
| + | |conductividad eléctrica = | ||
| + | |conductividad térmica = | ||
| + | |banda prohibida = | ||
| + | <!-- Propiedades químicas --> | ||
| + | |pKa = | ||
| + | |pKb = | ||
| + | |sol = 71,6 | ||
| + | |sol otro = | ||
| + | |KPS = | ||
| + | |mdipolar = | ||
| + | <!-- Propiedades farmacológicas --> | ||
| + | |Biodisp = | ||
| + | |Metabolismo = | ||
| + | |Exc = | ||
| + | |ExcR = | ||
| + | |ExcI = | ||
| + | |Semivida = | ||
| + | |Embarazo = | ||
| + | <!-- Bioquímica --> | ||
| + | |familia = | ||
| + | |esencial = | ||
| + | |codón = | ||
| + | |isoelect = | ||
| + | <!-- Termoquímica --> | ||
| + | |DfH0G = | ||
| + | |DfH0L = | ||
| + | |DfH0S = | ||
| + | |S0G = | ||
| + | |S0L = | ||
| + | |S0S = | ||
| + | |E0 = | ||
| + | |caloresp = | ||
| + | <!-- Peligrosidad --> | ||
| + | |PInflam = | ||
| + | |NFPA704 = | ||
| + | |TAutoig = | ||
| + | |FrasesR = | ||
| + | |FrasesS = | ||
| + | |FrasesH = | ||
| + | |FrasesP = | ||
| + | |LExplos = | ||
| + | <!-- Riesgos --> | ||
| + | |riesgo1 = | ||
| + | |ingestión = | ||
| + | |inhalación = | ||
| + | |piel = | ||
| + | |ojos = | ||
| + | |LD50 = | ||
| + | |más info = | ||
| + | <!-- Compuestos relacionados --> | ||
| + | |relac1n = | ||
| + | |relac1d = | ||
| + | |relac2n = | ||
| + | |relac2d = | ||
| + | |relac3n = | ||
| + | |relac3d = | ||
| + | }} | ||
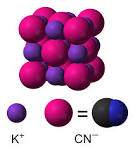
| + | '''Cianuro de potasio'''. El [[cianuro]] de [[potasio]] o KCN es una sal inorgánica denominada sal de potasio del cianuro de [[hidrógeno]] o ácido hidrociánico. | ||
==Características== | ==Características== | ||
| Línea 30: | Línea 108: | ||
El Cianuro de potasio es un compuesto inorgánico con la fórmula KCN. Este compuesto cristalino incoloro, de aspecto similar al azúcar, es altamente soluble en agua. La mayoría de KCN se utiliza en la extracción de oro, la síntesis orgánica y galvanoplastia. Aplicaciones más pequeñas incluyen la joyería para el dorado químico y pulido. | El Cianuro de potasio es un compuesto inorgánico con la fórmula KCN. Este compuesto cristalino incoloro, de aspecto similar al azúcar, es altamente soluble en agua. La mayoría de KCN se utiliza en la extracción de oro, la síntesis orgánica y galvanoplastia. Aplicaciones más pequeñas incluyen la joyería para el dorado químico y pulido. | ||
| − | Dicho compuesto es cristalino incoloro, similar en apariencia al azúcar, y altamente soluble en agua, en ácidos y bases, es insoluble en etanol o metanol. | + | Dicho compuesto es cristalino incoloro, similar en apariencia al azúcar, y altamente soluble en [[agua]], en ácidos y bases, es insoluble en [[etanol]] o [[metanol]]. |
Fatalmente tóxico por ingestión, el KCN tiene un olor como el de las almendras amargas, pero no todos pueden percibirlo porque la capacidad para ello se debe a un rasgo genético. Es una de las pocas sustancias que forman compuestos solubles con el oro formando un complejo cianurado, y por esto se usa en joyería para el dorado químico y para dar brillo a este metal. | Fatalmente tóxico por ingestión, el KCN tiene un olor como el de las almendras amargas, pero no todos pueden percibirlo porque la capacidad para ello se debe a un rasgo genético. Es una de las pocas sustancias que forman compuestos solubles con el oro formando un complejo cianurado, y por esto se usa en joyería para el dorado químico y para dar brillo a este metal. | ||
== Principales propiedades físicas y químicas== | == Principales propiedades físicas y químicas== | ||
| − | [[Image:CianuroP.jpg|thumb|right|'''''''''']] | + | [[Image:CianuroP.jpg|thumb|right|'''''Enlace del Cianuro de potasio''''']] |
* ''' Fórmula química:''' KCN | * ''' Fórmula química:''' KCN | ||
| Línea 42: | Línea 120: | ||
* ''' Olor ''' Característico. | * ''' Olor ''' Característico. | ||
* '''Peso molecular:''' 65.1 | * '''Peso molecular:''' 65.1 | ||
| − | * '''Punto de ebullición:''' 1625 | + | * '''Punto de ebullición:''' 1625 <sup>o</sup>C |
| − | * '''Punto de fusión:''' 634 | + | * '''Punto de fusión:''' 634 <sup>o</sup>C |
* '''Peso molecular:''' 65.1 | * '''Peso molecular:''' 65.1 | ||
* ''' Densidad relativa (agua = 1):''' 1.52 | * ''' Densidad relativa (agua = 1):''' 1.52 | ||
| − | * ''' Solubilidad en agua:''' 71,60 g/100 ml a 25 | + | * ''' Solubilidad en agua:''' 71,60 g/100 ml a 25 <sup>o</sup>C |
== Método de Obtención == | == Método de Obtención == | ||
| − | KCN se produce mediante el tratamiento de cianuro de hidrógeno con una solución acuosa al 50% de hidróxido de potasio, seguido por evaporación de la solución en el vacío: | + | KCN se produce mediante el tratamiento de cianuro de hidrógeno con una solución acuosa al 50% de [[hidróxido de potasio]], seguido por evaporación de la solución en el vacío: |
HCN + KOH? KCN + H2O o mediante el tratamiento de formamida con hidróxido de potasio: | HCN + KOH? KCN + H2O o mediante el tratamiento de formamida con hidróxido de potasio: | ||
| Línea 56: | Línea 134: | ||
HCONH2 + KOH? KCN + 2H2O | HCONH2 + KOH? KCN + 2H2O | ||
| − | Alrededor de 50 | + | Alrededor de 50 000 toneladas de cianuro de potasio se producen anualmente. |
==Aplicaciones== | ==Aplicaciones== | ||
| − | KCN y su estrecha relación cianuro de sodio son ampliamente utilizados en síntesis orgánica para la preparación de nitrilos y [[ácidos carboxílicos]], particularmente en la reacción de von Richter. | + | KCN y su estrecha relación [[cianuro de sodio]] son ampliamente utilizados en síntesis orgánica para la preparación de nitrilos y [[ácidos carboxílicos]], particularmente en la reacción de von Richter. |
| − | Es empleado a menudo por entomólogos como agente para matar insectos en los tarros de conservación, ya que la mayoría de los insectos sucumben en segundos, minimizando el daño incluso en las clases más frágiles. | + | Es empleado a menudo por entomólogos como agente para matar [[insectos]] en los tarros de conservación, ya que la mayoría de los insectos sucumben en segundos, minimizando el daño incluso en las clases más frágiles. |
| − | Puede usarse en la minería de [[oro]] para extraer el metal de los minerales, aunque más comúnmente se usa cianuro de sodio. También se utiliza en la Galvanoplastia como agente acomplejante de iones metálicos tales como el [[cinc]], el [[níquel]], el oro y la [[plata]]. | + | Puede usarse en la minería de [[oro]] para extraer el metal de los minerales, aunque más comúnmente se usa cianuro de [[sodio]]. También se utiliza en la Galvanoplastia como agente acomplejante de iones metálicos tales como el [[cinc]], el [[níquel]], el oro y la [[plata]]. |
== Medidas a Medidas a tomar en caso de derrames y/o fugas== | == Medidas a Medidas a tomar en caso de derrames y/o fugas== | ||
| Línea 76: | Línea 154: | ||
== Riesgos para la salud== | == Riesgos para la salud== | ||
| − | * El contacto puede producir graves irritaciones y quemaduras en la piel y los ojos con la posibilidad de daño ocular. | + | * El contacto puede producir graves irritaciones y quemaduras en la [[piel]] y los [[ojos]] con la posibilidad de daño ocular. |
| − | * Respirar cianuro de potasio puede irritar la nariz, la garganta y los pulmones, causando estornudo y tos. | + | * Respirar cianuro de potasio puede irritar la [[nariz]], la [[garganta]] y los [[pulmones]], causando estornudo y tos. |
* La alta exposición puede causar dolor de cabeza, confusión, mareo, ansiedad, latidos cardiacos fuertes e incluso pérdida del conocimiento y muerte. | * La alta exposición puede causar dolor de cabeza, confusión, mareo, ansiedad, latidos cardiacos fuertes e incluso pérdida del conocimiento y muerte. | ||
| Línea 84: | Línea 162: | ||
* La exposición al cianuro de potasio puede causar hemorragia nasal, lesiones nasales y cambios en el hemograma. | * La exposición al cianuro de potasio puede causar hemorragia nasal, lesiones nasales y cambios en el hemograma. | ||
| − | * El cianuro de potasio puede causar agrandamiento de la tiroides e interferir en la función tiroidea normal. | + | * El cianuro de potasio puede causar agrandamiento de la [[tiroides]] e interferir en la función tiroidea normal. |
| − | * La exposición repetida podría causar daño al sistema nervioso. | + | * La exposición repetida podría causar daño al [[sistema nervioso]]. |
== Fuente== | == Fuente== | ||
| − | + | ||
| − | * [http://www.ecosur.net/Sustancias%20Peligrosas/cianuro_de_potasio.html] | + | *Artículo:[http://es.wikipedia.org/wiki/Cianuro_de_potasio Cianuro de Potasio]. Disponible en:"es.wikipedia.org". Consultado: 3 de diciembre de 2013. |
| − | * [http://www.estis.net/sites/cien-bo/default.asp?site=cien-bo&page_id=E48DDCBD-6988-461E-9B3F-0C44E57713E6] | + | *Artículo:[http://www.ecosur.net/Sustancias%20Peligrosas/cianuro_de_potasio.html Cianuro de Potasio]. Disponible en:"www.ecosur.net". Consultado: 3 de diciembre de 2013. |
| − | + | *Artículo: [http://www.estis.net/sites/cien-bo/default.asp?site=cien-bo&page_id=E48DDCBD-6988-461E-9B3F-0C44E57713E6 Sustancias peligrosas. Cianuro de potasio]. Disponible en:"www.estis.net". Consultado: 3 de diciembre de 2013. | |
| − | * [http://nj.gov/health/eoh/rtkweb/documents/fs/1562sp.pdf] | + | *Documento: [http://nj.gov/health/eoh/rtkweb/documents/fs/1562sp.pdf Cianuro de Potasio].Disponible en:"nj.gov". Consultado: 3 de diciembre de 2013. |
| − | + | ||
| + | [[Category:Química]][[Categoría:Compuestos de sodio]] | ||
última versión al 15:53 31 jul 2019
| ||||||||||||||||||||||||||
Cianuro de potasio. El cianuro de potasio o KCN es una sal inorgánica denominada sal de potasio del cianuro de hidrógeno o ácido hidrociánico.
Sumario
Características
El Cianuro de potasio es un compuesto inorgánico con la fórmula KCN. Este compuesto cristalino incoloro, de aspecto similar al azúcar, es altamente soluble en agua. La mayoría de KCN se utiliza en la extracción de oro, la síntesis orgánica y galvanoplastia. Aplicaciones más pequeñas incluyen la joyería para el dorado químico y pulido.
Dicho compuesto es cristalino incoloro, similar en apariencia al azúcar, y altamente soluble en agua, en ácidos y bases, es insoluble en etanol o metanol.
Fatalmente tóxico por ingestión, el KCN tiene un olor como el de las almendras amargas, pero no todos pueden percibirlo porque la capacidad para ello se debe a un rasgo genético. Es una de las pocas sustancias que forman compuestos solubles con el oro formando un complejo cianurado, y por esto se usa en joyería para el dorado químico y para dar brillo a este metal.
Principales propiedades físicas y químicas
- Fórmula química: KCN
- Nombre químico: Cianuro de potasio
- Aspecto y color: Cristales sólidos o en diversas formas.
- Olor Característico.
- Peso molecular: 65.1
- Punto de ebullición: 1625 oC
- Punto de fusión: 634 oC
- Peso molecular: 65.1
- Densidad relativa (agua = 1): 1.52
- Solubilidad en agua: 71,60 g/100 ml a 25 oC
Método de Obtención
KCN se produce mediante el tratamiento de cianuro de hidrógeno con una solución acuosa al 50% de hidróxido de potasio, seguido por evaporación de la solución en el vacío:
HCN + KOH? KCN + H2O o mediante el tratamiento de formamida con hidróxido de potasio:
HCONH2 + KOH? KCN + 2H2O
Alrededor de 50 000 toneladas de cianuro de potasio se producen anualmente.
Aplicaciones
KCN y su estrecha relación cianuro de sodio son ampliamente utilizados en síntesis orgánica para la preparación de nitrilos y ácidos carboxílicos, particularmente en la reacción de von Richter.
Es empleado a menudo por entomólogos como agente para matar insectos en los tarros de conservación, ya que la mayoría de los insectos sucumben en segundos, minimizando el daño incluso en las clases más frágiles.
Puede usarse en la minería de oro para extraer el metal de los minerales, aunque más comúnmente se usa cianuro de sodio. También se utiliza en la Galvanoplastia como agente acomplejante de iones metálicos tales como el cinc, el níquel, el oro y la plata.
Medidas a Medidas a tomar en caso de derrames y/o fugas
- Precauciones personales: Traje de protección completo incluyendo equipo autónomo de respiración.
- Precauciones ambientales: No verter al alcantarillado. Esta sustancia puede ser peligriosa para el ambiente, debería prestarse atención especial al agua.
- Métodos de limpieza: Evacuar la zona de peligro. Consultar a un experto, ventilación. Barrer la sustancia derramada e introducirla en un recipiente hermético, trasladar a continuación a un lugar seguro. NUNCA poner en contacto directo con el agua.
Riesgos para la salud
- El contacto puede producir graves irritaciones y quemaduras en la piel y los ojos con la posibilidad de daño ocular.
- Respirar cianuro de potasio puede irritar la nariz, la garganta y los pulmones, causando estornudo y tos.
- La alta exposición puede causar dolor de cabeza, confusión, mareo, ansiedad, latidos cardiacos fuertes e incluso pérdida del conocimiento y muerte.
- La exposición al cianuro de potasio puede causar hemorragia nasal, lesiones nasales y cambios en el hemograma.
- El cianuro de potasio puede causar agrandamiento de la tiroides e interferir en la función tiroidea normal.
- La exposición repetida podría causar daño al sistema nervioso.
Fuente
- Artículo:Cianuro de Potasio. Disponible en:"es.wikipedia.org". Consultado: 3 de diciembre de 2013.
- Artículo:Cianuro de Potasio. Disponible en:"www.ecosur.net". Consultado: 3 de diciembre de 2013.
- Artículo: Sustancias peligrosas. Cianuro de potasio. Disponible en:"www.estis.net". Consultado: 3 de diciembre de 2013.
- Documento: Cianuro de Potasio.Disponible en:"nj.gov". Consultado: 3 de diciembre de 2013.