Electrólisis del agua
| ||||
Electrólisis del agua. La electrólisis es un proceso electroquímico de oxidación-reducción que ocurre al pasar la energía eléctrica a través de un electrólito fundido o disolución acuosa.
En el caso del agua para que este proceso ocurra se deben cumplir las siguientes condiciones:
- El agua no puede estar en estado puro, o sea debe tener pequeñas concentraciones de sales u otros minerales.
- Se debe usar corriente directa en este proceso.
Procedimiento
En este proceso se le llama cátodo al electrodo que aporta la carga negativa a la disolución acuosa o electrólito fundido, mientras al otro electrodo que es el responsable de la carga negativa se le llama ánodo.
La electrólisis del agua permite que se obtenga los elementos químicos que la componen de forma pura o sea el hidrógeno(H) a través del cátodo y el oxígeno(O) a través del ánodo, ambos en estado gaseoso.
Este proceso se le puede aplicar al agua dulce y a la salada obteniéndose resultados diferentes teniendo en cuenta las sustancias producto. En el caso del agua salada las sustancias que se obtienen a través del ánodo y el cátodo son el cloro (Cl) y el hidrógeno (H) respectivamente ambos en estado gaseoso, quedando al final del proceso una disolución de hidróxido de sodio (NaOH).
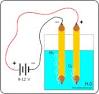
Con Voltámetro de Hoffman
Materiales:
- ácido sulfúrico 14,99 E/litros
- voltámetro de Hoffman con electrodos de platino 267,89 E
- tubos de ensayo
- palillo plano de madera
- mechero
- agua
- fuente de alimentación 30,95 E
- cable con bananas rojo y negro 8.98
La utilización del voltámetro de Hoffman permite realizar la electrólisis del agua de una forma muy cómoda recogiendo los gases hidrógeno y oxígeno en cada uno de los tubos. De esta forma el visitante observa que el volumen de hidrógeno que se produce es el doble que el de oxígeno; demostrando así cual es la composición química del agua. La energía necesaria para separar a los iones de la molécula del agua es aportada por la fuente de alimentación eléctrica. Esta es por tanto una reacción endotérmica.
El agua debe contener una pequeña cantidad de ácido sulfúrico para mejorar su conductividad. En el tubo conectado en el electrodo del polo positivo (cátodo) se recoge oxígeno. Para comprobarlo se puede acercar el ascua de un palillo plano. Se mostrará como el oxígeno aviva la llama e incluso a veces se vuelve a encender.
En el tubo conectado en el electrodo del polo negativo (ánodo) se recoge hidrógeno. Para comprobarlo se puede hacer la reacción inversa a la electrólisis del agua: la síntesis del agua. Se abre la llave del tubo que contiene el hidrogeno y se recoge con un tubo de ensayo invertido. Se acerca una chispa de un mechero de mano (energía de activación) y el hidrógeno reacciona con el oxígeno del aire produciendo un estallido peculiar.
Aplicaciones
La electrólisis tanto del agua dulce como la salada puede tener diversas aplicaciones, entre ellas se pueden mencionar:
- Obtención de hidrógeno (H) en estado gaseoso.
- Obtención de oxigeno (O) en estado gaseoso.
- Obtención de cloro (Cl) en estado gaseoso.
- Obtención de hidróxido de sodio(NaOH) en estado acuoso.
Fuente
- Taller: La electroliosis del agua (formato pdf). Año internacional de la química 2011. Ministerio de Ciencias e Innovación. España. Disponible en: www.quimica2011.es. Consultado: 31 de octubre de 2012.