Diferencia entre revisiones de «Enlace covalente»
m (Protegió «Enlace covalente» ([Editar=Sólo moderadores] (indefinido) [Trasladar=Sólo moderadores] (indefinido))) |
|||
| (No se muestran 32 ediciones intermedias de 11 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | {{ | + | {{Sistema:Artículo certificado |
| + | |contenido=el '''Dr.C [[Elio Lázaro Amador Lorenzo]]''', perteneciente a la '''[[Universidad Agraria de La Habana]]''' (UNAH). | ||
| + | }} | ||
| + | |||
{{Definición | {{Definición | ||
| − | |nombre= | + | |nombre= Enlace covalente |
| − | |imagen= | + | |imagen= Enlace covalente.jpg |
| − | |tamaño= | + | |tamaño= |
| − | |concepto= | + | |concepto= Se produce por la compartición de electrones, entre los átomos que se enlazan, y como consecuencia de esto, disminuye la energía del sistema atómico. |
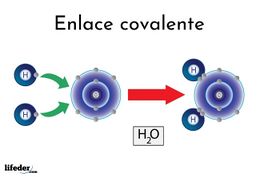
| − | }} | + | }}'''Enlace covalente'''. Es aquel que se produce cuando dos átomos se unen, para alcanzar el octeto estable, compartiendo electrones del último nivel (excepto el [[hidrógeno]] que alcanza la estabilidad cuando tiene 2 electrones). |
| − | '''Enlace covalente''', | + | |
| − | == | + | == Historia == |
| − | El | + | |
| − | + | El término "covalencia" en relación a la unión fue utilizada por primera vez en [[1919]] por Irving Langmuir en artículo del Journal of the American Chemical Society titulado «The Arrangement of Electrons in Atoms and Molecules» (La distribución de electrones en átomos y moléculas). En este, Langmuir escribió: | |
| − | + | ||
| − | + | {{Sistema:Cita|"«designaremos con el término covalencia al número de pares de electrones que un determinado átomo comparte con sus vecinos»."}} | |
| − | ==== | + | |
| − | + | La idea de la unión covalente se puede remontar varios años antes hasta Gilbert N. Lewis, quien en [[1916]] describió el intercambio de pares de electrones entre los átomos. Introdujo la notación de Lewis o notación de puntos de electrones o estructura de puntos de Lewis, en el que la valencia de los electrones (los de la capa exterior) se representa en forma de puntos en torno a los símbolos atómicos. Los pares de electrones localizados entre átomos representan enlaces covalentes. Múltiples parejas representan enlaces múltiples, tales como enlaces dobles y enlaces triples. Una forma alternativa de representación, que no se muestra aquí, tiene los pares de electrones de formación de enlaces representados como líneas sólidas. | |
| − | * Temperaturas de fusión bajas. | + | |
| − | * | + | Lewis propuso que un átomo forma suficientes enlaces covalentes para formar una capa electrónica exterior completa (o cerrada). En el diagrama del metano que se muestra aquí, el átomo de carbono tiene una valencia de cuatro y está, por lo tanto, rodeado por ocho electrones (la regla del octeto), cuatro del carbono mismo y cuatro de los hidrógenos unidos a él. Cada [[hidrógeno]] tiene una valencia de uno y está rodeado por dos electrones (una regla del dueto), su propio electrón más uno del carbono. El número de electrones corresponden a capas completas en la teoría cuántica del [[átomo]]; la capa exterior de un átomo de carbono es la capa n = 2, con capacidad para ocho electrones, mientras que la capa exterior (y única) de un átomo de hidrógeno es la capa n = 1, con capacidad para solo dos. |
| − | * | + | |
| − | * Son muy | + | Si bien la idea de los pares de electrones compartidos proporciona una imagen cualitativa efectiva de la unión covalente, es necesaria la mecánica cuántica para entender la naturaleza de estas uniones y predecir las estructuras y propiedades de las moléculas simples. Walter Heitler y Fritz London dieron la primera explicación con éxito de un enlace químico aplicando la mecánica cuántica, en concreto del hidrógeno molecular, en [[1927]]. Su trabajo se basó en el modelo de enlace de valencia, que asume que un enlace químico se forma cuando hay una buena coincidencia entre los orbitales atómicos de los átomos participantes. |
| − | * La | + | |
| − | == | + | Se sabe que estos orbitales atómicos tienen relaciones angulares específicas entre ellos, y por lo tanto el modelo de enlace de valencia puede predecir con éxito los ángulos de enlace observados en moléculas simples. Sin embargo la teoría del enlace covalente o también conocido como la idea de la compartición de electrones, el cual está basado en el átomo cúbico, se enfrentó a varias dificultades conceptuales, ya que esta teoría tuvo como competencia al modelo del enlace iónico. A pesar de esta rivalidad de estas dos Teorías, la teoría del enlace covalente fue aceptada hasta [[1920]]. M.Niaz y M.A.Rodríguez mencionan en su texto Historia y filosofía de las ciencias: necesidad de su incorporación en los textos universitarios de ciencias que Lewis reconoce que la estructura cúbica no puede representar el triple enlace y sugiere reemplazarlo por el átomo tetraédrico. Lewis asumió por muchos años que, si los electrones están pareados en el átomo magnéticamente, es fácil entender cómo dos electrones no pareados en átomos diferentes pueden acoplarse magnéticamente y formar el enlace no polar. |
| − | [[ | + | |
| + | == Tipos de enlaces covalentes == | ||
| + | |||
| + | Entre los distintos tipos de enlaces covalentes se encuentran: | ||
| + | |||
| + | *''' Enlace simple '''. Es un par electrónico compartido formado por un electrón perteneciente al último nivel de energía de cada átomo y se representa con una línea. Ejemplos: H-H, Cl-Cl | ||
| + | *''' Enlace doble '''. Formado por dos pares electrónicos compartidos, es decir por dos electrones pertenecientes al último nivel de energía de cada átomo y se representa con dos líneas paralelas. Ejemplo: O=O | ||
| + | *''' Enlace triple '''. Formado por tres pares electrónicos compartidos, es decir por tres electrones pertenecientes al último nivel de energía de cada átomo y se representa con tres líneas paralelas. Ejemplo: N≡N | ||
| + | *''' Enlace covalente dativo o de coordinación '''. Es un par electrónico compartido por dos átomos pero ambos electrones son aportados por el mismo átomo. Se suele representar con una flecha (→). | ||
| + | |||
| + | Un ejemplo de una especie química que posee un enlace coordinado, el cual es el ion amonio (NH41+). El Ion amonio está constituido por un protón y [[amoníaco]]. Los compuestos en los que se encuentra un enlace coordinado se conocen con el nombre de compuestos de coordinación. Los compuestos de coordinación o también denominados complejos, los cuales en su mayoría de los casos están unidos a varios aniones circundantes conocidos como ligandos. | ||
| + | |||
| + | == Enlace covalente polar == | ||
| + | |||
| + | Consiste en la formación de un enlace entre átomos de diferentes elementos, y la diferencia de la electronegatividad debe ser mayor de 0,5. En este enlace, los electrones son atraídos fundamentalmente por el núcleo del átomo más electronegativo, generando moléculas cuya nube electrónica presentará una zona con mayor densidad de carga negativa y otra con mayor densidad de carga positiva (dipolo). | ||
| + | |||
| + | == Enlace covalente apolar == | ||
| + | |||
| + | Se forma entre átomos iguales y la diferencia de electronegatividad debe ser cero o muy disminuida (menor que 0,4). En este enlace, los electrones son atraídos por ambos núcleos con la misma intensidad, generando moléculas cuya nube electrónica es uniforme. | ||
| + | |||
| + | == Tipos de sustancias covalentes == | ||
| + | |||
| + | Existen dos tipos de sustancias covalentes: | ||
| + | |||
| + | ''' Sustancias covalentes moleculares '''. Los enlaces covalentes forman moléculas que tienen las siguientes propiedades: | ||
| + | |||
| + | *Temperaturas de fusión y ebullición bajas. | ||
| + | *En condiciones normales de presión y temperatura (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos. | ||
| + | *Son blandos en estado sólido. | ||
| + | *Son aislantes de la corriente eléctrica y el calor. | ||
| + | *Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (lo semejante disuelve a lo semejante). | ||
| + | *Ejemplos: [[dióxido de carbono]], [[benceno]], [[oxígeno]], [[nitrógeno]]. | ||
| + | |||
| + | ''' Redes o sustancias covalentes reticulares '''. Además, las sustancias covalentes forman redes cristalinas de un número indefinido de átomos, semejantes a los compuestos iónicos, que tienen estas propiedades: | ||
| + | |||
| + | *Elevadas temperaturas de fusión y ebullición. | ||
| + | *Son sólidos en condiciones normales. | ||
| + | *Son sustancias muy duras. | ||
| + | *Son aislantes (excepto el grafito). | ||
| + | *Son insolubles. | ||
| + | *Ejemplos: [[cuarzo]], [[diamante]]. | ||
| + | |||
| + | == Bibliografías == | ||
| + | |||
| + | *Química. Ediciones Umbral. ISBN 9789685607209. | ||
| + | *Picazo, Susana María López (2009). Química. Pruebas de acceso a la universidad para mayores de 25 años. Cultivalibros. ISBN 9788499231099. | ||
| + | *Química II Segundo Semestre Tacaná. IGER. ISBN 9789929804623. | ||
| + | *La Química en Tus Manos. UNAM. 2004. ISBN 9789703212231. | ||
| + | *Lewis, Gilbert N. (1 de abril de 1916). «The atom and the molecule». Journal of the American Chemical Society 38 (4): 762-785. | ||
| + | *W. Heitler and F. London, Zeitschrift für Physik, vol. 44, p. 455 (1927). English translation in Hettema, H. (2000). Quantum chemistry: classic scientific papers. World Scientific. pp. 140-. ISBN 978-981-02-2771-5. | ||
| + | *Antón, Juan Luis; Andrés, Dulce María (2015-06). Física y Química 3º ESO (LOMCE). Editex. ISBN 9788490785270. | ||
| + | *Franchini, William S. Seese, G. William Daub; traducción, Ma. Cristina Arroyo Espinosa; revisión técnica, Ma. Cristina Sanginés (1989). Química (1a ed. en español. edición). México: Prentice-Hall Hispanoamericana. ISBN 968-880-167-4. | ||
| + | *Gasque Silvia, Dr. Laura. Introducción al enlace químico. pp. 2-27. | ||
| + | *Escudero P., Lauzurica M., Pascual R., Pastor J.M. (1999). «10». Físico- Química. Estomba 44, Buenos Aires, Argentina: Santillana. pp. 133, 138. ISBN 950-46-0181-2. | ||
| + | |||
| + | == Fuentes == | ||
| + | |||
| + | *[https://concepto.de/enlace-covalente/ Diccionario de conceptos online con miles de definiciones] | ||
| + | *[https://www.significados.com/enlace-covalente/ Significados, Conceptos y Definiciones] | ||
| + | *[https://journalusco.edu.co/index.php/entornos/article/download/1790/3276?inline=1/ Revistas Científicas – Universidad Surcolombiana] | ||
| + | *[https://www.upo.es/depa/webdex/quimfis/docencia/quimbiotec/FQ_Tema6.pdf/ Universidad Pablo de Olavide de Sevilla – España] | ||
| + | *[https://www.uaeh.edu.mx/docencia/P_Presentaciones/prepa1/2020/enlace-quimico.pdf/ Universidad Autónoma del Estado de Hidalgo – México] | ||
| + | *[https://www.todamateria.com/enlace-covalente/ TodaMateria – Contenidos escolares de investigación para tareas] | ||
| + | |||
| − | + | [[Category:Química]] | |
| − | + | [[Category:Estructura de las moléculas orgánicas]] | |
| − | + | [[Category: Estructura de los compuestos inorgánicos]] | |
| − | + | [[Categoría:Artículos certificados]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | [[ | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | [[ | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
última versión al 14:08 5 ago 2021
| ||||||
Enlace covalente. Es aquel que se produce cuando dos átomos se unen, para alcanzar el octeto estable, compartiendo electrones del último nivel (excepto el hidrógeno que alcanza la estabilidad cuando tiene 2 electrones).
Sumario
Historia
El término "covalencia" en relación a la unión fue utilizada por primera vez en 1919 por Irving Langmuir en artículo del Journal of the American Chemical Society titulado «The Arrangement of Electrons in Atoms and Molecules» (La distribución de electrones en átomos y moléculas). En este, Langmuir escribió:
La idea de la unión covalente se puede remontar varios años antes hasta Gilbert N. Lewis, quien en 1916 describió el intercambio de pares de electrones entre los átomos. Introdujo la notación de Lewis o notación de puntos de electrones o estructura de puntos de Lewis, en el que la valencia de los electrones (los de la capa exterior) se representa en forma de puntos en torno a los símbolos atómicos. Los pares de electrones localizados entre átomos representan enlaces covalentes. Múltiples parejas representan enlaces múltiples, tales como enlaces dobles y enlaces triples. Una forma alternativa de representación, que no se muestra aquí, tiene los pares de electrones de formación de enlaces representados como líneas sólidas.
Lewis propuso que un átomo forma suficientes enlaces covalentes para formar una capa electrónica exterior completa (o cerrada). En el diagrama del metano que se muestra aquí, el átomo de carbono tiene una valencia de cuatro y está, por lo tanto, rodeado por ocho electrones (la regla del octeto), cuatro del carbono mismo y cuatro de los hidrógenos unidos a él. Cada hidrógeno tiene una valencia de uno y está rodeado por dos electrones (una regla del dueto), su propio electrón más uno del carbono. El número de electrones corresponden a capas completas en la teoría cuántica del átomo; la capa exterior de un átomo de carbono es la capa n = 2, con capacidad para ocho electrones, mientras que la capa exterior (y única) de un átomo de hidrógeno es la capa n = 1, con capacidad para solo dos.
Si bien la idea de los pares de electrones compartidos proporciona una imagen cualitativa efectiva de la unión covalente, es necesaria la mecánica cuántica para entender la naturaleza de estas uniones y predecir las estructuras y propiedades de las moléculas simples. Walter Heitler y Fritz London dieron la primera explicación con éxito de un enlace químico aplicando la mecánica cuántica, en concreto del hidrógeno molecular, en 1927. Su trabajo se basó en el modelo de enlace de valencia, que asume que un enlace químico se forma cuando hay una buena coincidencia entre los orbitales atómicos de los átomos participantes.
Se sabe que estos orbitales atómicos tienen relaciones angulares específicas entre ellos, y por lo tanto el modelo de enlace de valencia puede predecir con éxito los ángulos de enlace observados en moléculas simples. Sin embargo la teoría del enlace covalente o también conocido como la idea de la compartición de electrones, el cual está basado en el átomo cúbico, se enfrentó a varias dificultades conceptuales, ya que esta teoría tuvo como competencia al modelo del enlace iónico. A pesar de esta rivalidad de estas dos Teorías, la teoría del enlace covalente fue aceptada hasta 1920. M.Niaz y M.A.Rodríguez mencionan en su texto Historia y filosofía de las ciencias: necesidad de su incorporación en los textos universitarios de ciencias que Lewis reconoce que la estructura cúbica no puede representar el triple enlace y sugiere reemplazarlo por el átomo tetraédrico. Lewis asumió por muchos años que, si los electrones están pareados en el átomo magnéticamente, es fácil entender cómo dos electrones no pareados en átomos diferentes pueden acoplarse magnéticamente y formar el enlace no polar.
Tipos de enlaces covalentes
Entre los distintos tipos de enlaces covalentes se encuentran:
- Enlace simple . Es un par electrónico compartido formado por un electrón perteneciente al último nivel de energía de cada átomo y se representa con una línea. Ejemplos: H-H, Cl-Cl
- Enlace doble . Formado por dos pares electrónicos compartidos, es decir por dos electrones pertenecientes al último nivel de energía de cada átomo y se representa con dos líneas paralelas. Ejemplo: O=O
- Enlace triple . Formado por tres pares electrónicos compartidos, es decir por tres electrones pertenecientes al último nivel de energía de cada átomo y se representa con tres líneas paralelas. Ejemplo: N≡N
- Enlace covalente dativo o de coordinación . Es un par electrónico compartido por dos átomos pero ambos electrones son aportados por el mismo átomo. Se suele representar con una flecha (→).
Un ejemplo de una especie química que posee un enlace coordinado, el cual es el ion amonio (NH41+). El Ion amonio está constituido por un protón y amoníaco. Los compuestos en los que se encuentra un enlace coordinado se conocen con el nombre de compuestos de coordinación. Los compuestos de coordinación o también denominados complejos, los cuales en su mayoría de los casos están unidos a varios aniones circundantes conocidos como ligandos.
Enlace covalente polar
Consiste en la formación de un enlace entre átomos de diferentes elementos, y la diferencia de la electronegatividad debe ser mayor de 0,5. En este enlace, los electrones son atraídos fundamentalmente por el núcleo del átomo más electronegativo, generando moléculas cuya nube electrónica presentará una zona con mayor densidad de carga negativa y otra con mayor densidad de carga positiva (dipolo).
Enlace covalente apolar
Se forma entre átomos iguales y la diferencia de electronegatividad debe ser cero o muy disminuida (menor que 0,4). En este enlace, los electrones son atraídos por ambos núcleos con la misma intensidad, generando moléculas cuya nube electrónica es uniforme.
Tipos de sustancias covalentes
Existen dos tipos de sustancias covalentes:
Sustancias covalentes moleculares . Los enlaces covalentes forman moléculas que tienen las siguientes propiedades:
- Temperaturas de fusión y ebullición bajas.
- En condiciones normales de presión y temperatura (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos.
- Son blandos en estado sólido.
- Son aislantes de la corriente eléctrica y el calor.
- Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (lo semejante disuelve a lo semejante).
- Ejemplos: dióxido de carbono, benceno, oxígeno, nitrógeno.
Redes o sustancias covalentes reticulares . Además, las sustancias covalentes forman redes cristalinas de un número indefinido de átomos, semejantes a los compuestos iónicos, que tienen estas propiedades:
- Elevadas temperaturas de fusión y ebullición.
- Son sólidos en condiciones normales.
- Son sustancias muy duras.
- Son aislantes (excepto el grafito).
- Son insolubles.
- Ejemplos: cuarzo, diamante.
Bibliografías
- Química. Ediciones Umbral. ISBN 9789685607209.
- Picazo, Susana María López (2009). Química. Pruebas de acceso a la universidad para mayores de 25 años. Cultivalibros. ISBN 9788499231099.
- Química II Segundo Semestre Tacaná. IGER. ISBN 9789929804623.
- La Química en Tus Manos. UNAM. 2004. ISBN 9789703212231.
- Lewis, Gilbert N. (1 de abril de 1916). «The atom and the molecule». Journal of the American Chemical Society 38 (4): 762-785.
- W. Heitler and F. London, Zeitschrift für Physik, vol. 44, p. 455 (1927). English translation in Hettema, H. (2000). Quantum chemistry: classic scientific papers. World Scientific. pp. 140-. ISBN 978-981-02-2771-5.
- Antón, Juan Luis; Andrés, Dulce María (2015-06). Física y Química 3º ESO (LOMCE). Editex. ISBN 9788490785270.
- Franchini, William S. Seese, G. William Daub; traducción, Ma. Cristina Arroyo Espinosa; revisión técnica, Ma. Cristina Sanginés (1989). Química (1a ed. en español. edición). México: Prentice-Hall Hispanoamericana. ISBN 968-880-167-4.
- Gasque Silvia, Dr. Laura. Introducción al enlace químico. pp. 2-27.
- Escudero P., Lauzurica M., Pascual R., Pastor J.M. (1999). «10». Físico- Química. Estomba 44, Buenos Aires, Argentina: Santillana. pp. 133, 138. ISBN 950-46-0181-2.
Fuentes
- Diccionario de conceptos online con miles de definiciones
- Significados, Conceptos y Definiciones
- Revistas Científicas – Universidad Surcolombiana
- Universidad Pablo de Olavide de Sevilla – España
- Universidad Autónoma del Estado de Hidalgo – México
- TodaMateria – Contenidos escolares de investigación para tareas