Síndrome de Brugada
| ||||
El síndrome de Brugada es una enfermedad de origen genético, que provoca arritmias y paro cardíaco extremo en quien lo padece. Suele ser asintomático, hasta que no se produce el fallo cardíaco, con resultado, muchas veces, de muerte súbita.
Es caracterizada por una anormalidad electrocardiográfica (ECG), el paciente presenta bloqueo de rama derecha, elevación persistente del segmento ST y muerte súbita (MS), más conocido hoy en día como síndrome de Brugada, fue descrito en 1992 como un nuevo síndrome clínico-electrocardiográfico causante de arritmias ventriculares y MS en pacientes sin cardiopatía estructural evidente
El síndrome de Brugada es una canalopatía de reciente descripción y se caracteriza por un patrón electrocardiográfico de pseudo bloqueo de rama derecha con elevación del ST en las derivaciones precordiales derechas, asociado a muerte súbita debido a arritmias ventriculares malignas, habitualmente en personas en edades medias de la vida, sin cardiopatía estructural demostrable.
Sumario
Etiología y aspectos genéticos
El tipo de transmisión es autosómico dominante. Hay una mayor incidencia de casos en varones. Las causas de estas diferencias no son claras, pero podrían encontrarse en algunos factores modificadores genéticos, aunque se han planteado hipótesis de la influencia hormonal en la mayor prevalencia y mortalidad del síndrome en hombres.
Los defectos genéticos conocidos se localizan en el cromosoma 3 y afectan los canales de sodio, creando con ello la base para trastornos de conducción e inhomogeneidad en períodos refractarios que pueden causar arritmias causadas en cambios de la matriz electrofisiológica normal del corazón. Hasta el momento se conocen varios genes mutados responsables de esta enfermedad como son el SCN5a (donde hasta ahora se han identificado más de 100 mutaciones diferentes), el Nav1.5 E1053K y el gen GPD1-L.
Fisiopatología
El fenómeno comienza con una actividad electrofisiológica anormal en el epicardio ventricular derecho. Las bases iónicas y celulares del síndrome se han adjudicado a una distribución homogénea de la corriente de salida transitoria de potasio a través de la pared ventricular. Esta corriente iónica actúa en las etapas tempranas de la repolarización, principalmente en la fase uno del potencial de acción y determina la morfología de espiga y domo en el epicardio y su disminución acentuada o su ausencia en el endocardio ventricular.
El supradesnivel del segmento ST observado en el electrocardiograma de pacientes con Síndrome de Brugada es el resultado de la depresión o pérdida de "domo" del potencial de acción en el epicardio ventricular derecho. Su aparición sólo en derivaciones precordiales derechas es compatible con la observación de la pérdida del domo del potencial de acción más fácilmente inducible en células del epicardio ventricular derecho que en el izquierdo, debido a la mayor densidad de corrientes en el epicardio ventricular derecho. Las arritmias y la muerte súbita de los pacientes con este síndrome se deberían a fenómenos de reentrada en fase dos con punto de partida en el epicardio del ventrículo derecho. La reentrada en fase dos se ha demostrado previamente con la administración de flecainida en un modelo experimental canino.
El acortamiento del potencial de acción y la presencia de una repolarización del tipo "todo o nada", favorecen la presencia de una reentrada en la fase dos, que explica el origen de las arritmias ventriculares. Las extrasístoles ventriculares asociadas a reentrada en fase dos, con intervalos de acoplamiento muy cortos, serían las responsables de perpetuar la arritmia ventricular. Esta conjunción de elementos confiere al síndrome una de sus características únicas, que es el hecho de que el mismo sustrato provea tanto el disparador como la manera de sostener la arritmia. La imagen de bloqueo de rama derecha puede ser secundaria a un bloqueo verdadero de la rama o puede ser la manifestación de una repolarización precoz del ventrículo derecho. Las variaciones circadianas explican la mayor incidencia de muerte súbita durante la noche, cuando el tono vagal es más acentuado. Sin embargo, el sistema nervioso autónomo parece ser únicamente un modulador del síndrome y no la causa del mismo.
Manifestaciones clínicas
El síndrome completo se caracteriza por la ocurrencia de episodios de taquicardia ventricular polimórfica rápida en pacientes con un patrón electrocardiográfico.
Las taquicardias polimórficas rápidas causan episodios de síncope cuando terminan espontáneamente, y la muerte súbita arrítmica cuando persisten y no son terminadas con un choque eléctrico externo. Sin embargo, tal como ocurre con otros síndromes clínico-electrocardiográficos, existen distintas formas de presentación clínica.
Existen pacientes asintomáticos en quienes el electrocardiograma típico del síndrome se encuentra por casualidad durante un examen rutinario o un examen por motivos de seguros o licencia para el deporte. El electrocardiograma de estos pacientes no difiere en nada del electrocardiograma de los pacientes sintomáticos. En otros pacientes, también asintomáticos, el electrocardiograma típico se descubre cuando se registra como escrutinio a causa de la muerte súbita de un familiar con el síndrome.
Además, hay pacientes sintomáticos en quienes inicialmente se había hecho un diagnóstico de síncope de causa desconocida o síncope vaso-vagal o un diagnóstico de fibrilación ventricular idiopática, en quienes el síndrome se reconoce solo después de un largo seguimiento cuando el electrocardiograma cambia espontáneamente de aparentemente normal a claramente anormal. Lo mismo ocurre con otros pacientes en quienes la administración de drogas antiarrítmicas desenmascara el síndrome.
Incidencia
No se conoce con exactitud, ya que esta enfermedad fue descrita hace pocos años (1982). En la actualidad se considera la causa más frecuente de muerte súbita en pacientes por debajo de 50 años de edad no conocidos con enfermedades cardíacas previas.
Hallazgos patológicos
En los estudios anatomopatológicos no se ha observado anomalías estructurales. En este síndrome no hay datos anatomopatológicos que sugieran una displasia arritmogénica del ventrículo derecho. Otros estudios de tipo anatómico como resonancia magnética nuclear y ecocardiografía han mostrado resultados normales.
Electrocardiograma y diagnóstico
Ante la sospecha del síndrome y en ausencia del patrón electrocardiográfico típico en los familiares de primer grado, deben realizarse pruebas farmacológicas con el objetivo de desenmascarar eventuales formas latentes. La prueba se considera positiva si se logra la aparición o la exacerbación del patrón electrocardiográfico, o sea, un aumento del supradesnivel del segmento ST de 1 milímetro (mm) con una duración superior a los 80 milisegundos a partir del punto J. Las drogas más usadas con esta finalidad son: el antiarrítmico de la clase IC flecainida en dosis de 2 miligramos/kilogramo (mg/kg) en 10 minutos de infusión. También pueden usarse ciertos antiarrítmicos de la clase 1A: Procainamida, en dosis de 10 mg/kg en 10 minutos, en ese caso la dosis es de 0,5 mg/kg/minuto y Ajmalina presentada en ámpulas de 50 mg que se administra por vía endovenosa en 5 minutos (Ver anexo-4). La dosis máxima es de 1 mg/kg, administrada en 5 minutos seguida de infusión continua de 0,25 mg/kg en 15 minutos.
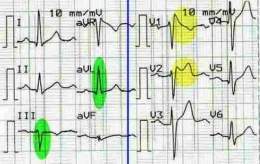
El diagnóstico se hace cuando existe un electrocardiograma (ECG) típico (Ver anexo-5) de bloqueo de rama derecha y elevación del punto J y por ende del segmento ST, en derivaciones precordiales derechas (V1, V2 y V3) y antecedentes familiares de muerte súbita o por presentar estados de síncope; el segmento P-R puede estar normal o ligeramente prolongado, además en algunos casos hay tendencia a desviación del eje eléctrico del corazón hacia la izquierda; en el hisiograma el intervalo H-V se alarga pero que no suele rebasar los 70 metros por segundo. Sin embargo, al tratarse de una enfermedad genéticamente heterogénea, las manifestaciones electrocardiográficas no son idénticas en todos los enfermos, por lo que se elaboró una clasificación de estas manifestaciones que tienen que ver con el patrón de repolarización:
- Tipo 1: Caracterizado por el patrón convexo y elevación del punto J ≥ 2 milímetros o 0,2 milivoltios a su pico, ST gradualmente descendente en su porción terminal seguido de onda T negativa.
- Tipo 2: Patrón en silla de montar y elevación del pto J ≥2 milímetros o 0,2 milivoltios, ST gradualmente descendente en su porción terminal, manteniéndose ≥1 milímetro o 0,1 milivoltio por encima de la línea basal seguido de onda T positiva o bifásica. Este tipo es también conocido como Síndrome Pseudo Brugada (Ver anexo-6).
- Tipo 3: Patrón en silla de montar y elevación del pto J ≥2 milímetros o 0,2 milivoltios, ST gradualmente descendente en su porción terminal, manteniéndose <1 milímetro o 0,1 milivoltio por encima de la línea basal, seguido de onda T positiva.
Pronóstico
En los pacientes que padecen síncope y en aquellos con antecedente de un episodio de casi muerte súbita cardiaca, la incidencia de un nuevo episodio de fibrilación ventricular es muy alta, un tercio de estos pacientes presentan recurrencia en los siguientes dos años. Por desgracia, el pronóstico de los enfermos asintomáticos, es el mismo.
Desde el punto de vista pronóstico parecen existir cuatro grupos de pacientes:
- Los sintomáticos en quienes hay que implantar un desfibrilador.
- Los asintomáticos con una historia familiar de muerte súbita en quienes probablemente hay que colocar un desfibrilador.
- Los asintomáticos sin historia familiar de muerte súbita, cuyas anomalías son inducibles con el estudio electrofisiológico, son también candidatos al desfibrilador.
- Los asintomáticos sin historia familiar de muerte súbita y no inducibles, en quienes probablemente no es necesario ningún tratamiento.
Tratamiento
Hasta el momento, el único tratamiento disponible efectivo es el desfibrilador automático implantable. La controversia se presenta cuando el enfermo es asintomático; también está como inconveniente la edad con que se diagnostica el paciente debido a futuras complicaciones cardiacas y no cardiacas provocadas por el mismo DAI, que van desde complicaciones de la implantación hasta trastornos psiquiátricos con los choques eléctricos. Pese a esto, por la alta letalidad del síndrome, algunos grupos de investigación como el dirigido por los hermanos Brugada recomiendan un tratamiento más agresivo, implantando el cardiodesfibrilador en cada vez más pacientes, incluyendo a los sintomáticos en los que se hayan inducido una arritmia ventricular durante un estudio electrofisiológico; en la actualidad existe gran polémica en torno a esto.
Hay que tener en cuenta que estas estrategias pueden cambiar en el futuro inmediato dependiendo de los resultados de las investigaciones que se están realizando en el momento actual en el campo de la biología molecular, los cuales proporcionarán una curación definitiva para esta enfermedad, demostrando una vez más la dependencia de la medicina moderna de la tecnología.
Fuentes
- Síndrome de Brugada, artículo publicado en el sitio web Brugada.org.
- «Síndrome de Brugada», artículo publicado en la Revista Española de Cardiología.
- Antzelevitch, C., Brugada, P., Borggrefe, M.; Brugada J.; Brugada R.; Corrado D.; et al. (2005): «Brugada syndrome: Report of the Second Consensus Conference: Endorsed by the Heart Rhythm Society and the European Heart Rhythm Association», artículo en revista Circulation, 111: págs. 659-670; 2005.
- Benito, B.; Brugada, J.; Brugada, R.; Brugada, P. (2009): «Brugada syndrome or Brugada electrocardiogram?», respuesta de los autores), artículo en la Journal Am Coll Cardiology, 53: págs. 1569-1570; 2009.
- Brugada, P.; Brugada, J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical and electrocardiographic syndrome. A multicenter report. J Am Coll Cardiol.; 20:1391-6; 1992.
- Brugada, P, Brugada, R, Brugada, J. (2000): «Sudden death in patients and relatives with the syndrome of right bundle branch block, ST segment elevation in the precordial leads V1 to V3 and sudden death». Eur Heart J., 21:321-6; 2000.
- Chen Q, Kirsch GE, Zhang D, Brugada, R, Brugada, J, Brugada, P, et al. Genetic basis and molecular mechanism for idiopathic ventricular fibrillation. Nature. 1998;392:293-6
- De la Osa José A. Muerte súbita del corazón. En: www.granma.cubaweb.cu. Fecha de acceso: 25-11-08
- Ferracci A, Fromer M, Schlapfer J, Pruvot E, Kappenberger L. Primary ventricular fibrillation and early recurrence: apropos of a case of association of right bundle branch block and persistent ST segment elevation. Arch Mal Coeur Vaiss. 1994;87:1359-62
- Giménez, Inés Nélida; Foglia, C.; y Yanela Aguirre, Antonio (2006): «Síndrome de Brugada: revisión», en Revista de Postgrado de Villa Clara: Cátedra de Medicina, págs. 16-20; febrero 2006. Consultado el 23 de noviembre de 2008.
- Hermida, J. S.; Lemoine, J. L.; Aoun, F. B.; Jarry, G.; Rey, J. L.; y Quiret, J. C. (2000): «Prevalence of the Brugada syndrome in an apparently healthy population», artículo en American Journal of Cardiology, 86: págs. 91-94; 2000
- Miyasaka Y, Tsuji H, Yamada K, Tokunaga S, Saito D, Imuro Y, et al. Prevalence and mortality of the Brugada-type electrocardiogram in one city in Japan. J Am Coll Cardiol. 2001; 38: págs. 771-774;
- Priori SG, Napolitano C, Gasparini M, Pappone C, La Bella C, Brignole M, et al. Clinical and genetic heterogeneity of right bundle branch block and ST-segment elevation syndrome: a prospective evaluation of 52 families», en Circulation, 102: págs. 2509-2515; 2000
- Rodríguez Mejías, J. C.; Lardouyet Soto, E. (2003): «Síndrome de Brugada», en: www.bvs.sld.cu/revistas/san/vol7_4_03/san08403.htm 2003. Consultado el 20 de noviembre de 2008.
- Rook, M. B.; Bezzina Alshinawi, C.; Groenewegen, W. A.; Van Gelder, I. C.; Van Ginneken, A. C.; Jongsma, H. J.; et al. (1999): «Human SCN5A gene mutations alter cardiac sodium channel kinetics and are associated with the Brugada syndrome», en Cardiovasc Res., 44: págs. 507-517; 1999.
- Van den Berg, M. P.; De Boer, R. A.; y Van Tintelen, J. P. (2009): «Brugada syndrome or Brugada electrocardiogram?», en Journal of American Collection of Cardiology, 53: pág. 1569; 2009.
- Vatta, M.; Dumaine, R.; Varghese, G.; Richard, T. A.; Shimizu, W.; y Aihara, N. et al. (2002): «Genetic and biophysical basis of sudden unexplained nocturnal death syndrome (SUNDS), a disease allelic to Brugada syndrome», en Hum Mol Genet, 11: págs. 337-345; 2002.
- Wilde, A. A. M.; Antzelevitch, C.; Borggrefe, M.; Brugada, J.; Brugada, R.; Brugada, P.; et al. (2002): «Proposed diagnostic criteria for the Brugada syndrome», en Eur Heart J., 23: págs. 1648-1654; 2002.
- Yan, G. X.; y Antzelevitch, C. (1999): «Cellular basis for the Brugada syndrome and other mechanisms of arrhythmogenesis associated with ST-segment elevation», en Circulation, 100: págs. 1660-1666; 1999.