Ácido nitroso
| ||||||||||||
Ácido nitroso ([[HNO2]]).También conocido como nitrito de hidrógeno, es un ácido inorgánico monoprótico que se encuentra sólo en solución y en sus sales, los nitritos.
Otros nombres
Ácido dioxonítrico (III), dioxonitrato (III) de hidrógeno, ácido azotoso, espíritu de salitre, ácido de Chile, Stickstoff (III)-säure, Espíritu de nitro o ácido de salitre.
Sumario
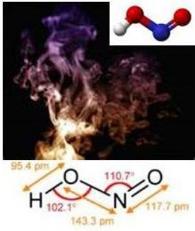
Estructura
Molécula moderadamente débil e inestable, de masa molar de 47 g.mol-1,con una constante de disociación K(HNO2)= 6,0·10-6E (a 25° C), posee enlace covalente polar, tiene propiedades ácida., y es monobásico .
Obtención
El ácido nitroso se puede obtener mediante la:
1.- Reacción de un ácido mineral (como el sulfúrico) con el nitrito de sodio.
2.- Reacción del óxido de nitrógeno con agua.
Este ácido resulta muy poco estable en disolución acuosa y no se ha logrado aislar como tal descomponiéndose con facilidad. Se obtiene un líquido azul que contiene ácido nitroso, descomponiéndose rápidamente desprendiéndose vapores de color pardo.
Propiedades químicas
Descomposición
En estado gaseoso está notablemente disociado
El ácido nitroso se descompone rápidamente en dióxido del nitrógeno, monóxido de nitrógeno, y vapor de Agua.
Si se le intenta concentrar se descompone, siendo estable solamente en disoluciones acuosas diluidas y frías. La descomposición se acelera por calentamiento o en contacto con sustancias de gran superficie, y transcurre según la reacción reversible:
Obteniéndose ácido nítrico, monóxido de nitrógeno y vapor de Agua.
Propiedades reductoras
Como consecuencia de su inestabilidad es una sustancia muy reactiva.
Es oxidante, pudiendo liberar yodo de los yoduros.
Se oxida a ácido nítrico mediante oxidantes fuertes como el permanganato de potasio.
Propiedades oxidantes
Se reduce a monóxido de nitrógeno y a veces a dióxido de nitrógeno e incluso a dinitrógeno
Oxida las sales ferrosas a férricas frente a agentes reductores más enérgicos (amalgamas alcalinas, electrólisis) se reduce a N2O o NH3. Por el contrario, actúa como reductor frente a agentes oxidantes fuertes como el KMnO4 (determinación de nitritos), H2O2, PbO2, halógenos, ozono y otros, que lo convierten en ácido nítrico. Por su propiedad de diazotar aminas orgánicas, encuentra aplicación en la química de los colorantes.
Atmósfera de la tierra
El ácido nitroso está implicado en el ozono presupuesto del más bajo atmósfera: troposfera. Cuando la reacción heterogénea de óxido nitroso (NO2) y agua que produce el ácido nitroso ocurre en la superficie de aerosoles atmosférico, se obtiene como producto fácilmente photolyses a oxhidrilo radicales.
Aplicaciones
El ácido nitroso se emplea para convertir aminas en diazos, esto ocurre por el ataque nucleophilic de la amina sobre nitrito mediante un agente mutágeno que provoca la desaminación oxidativa de la adenina y la citosina, originando transiciones y el diazide se puede entonces liberar.
En soluciones acuosas, el ácido nitroso (HNO2) desamina oxidativamente las aminas primarias aromáticas, de tal forma que convierte la citosina en uracilo Y adenina en la molécula parecida a la guanina, la hipoxantina (que forma dos de los tres enlaces de la guanina con la citosina) .
Efecto de la hipoxantina como mutágeno.
De tal forma que el tratamiento del ADN con el HNO2 o compuestos como las nitrosaminas que reaccionan para formar ácido nítrico, resulta en ambas transiciones A•T – G•C y G•C – A•T.
Se utiliza para preparar sales del diazonium:
HNO2 + ArNH2 + H sup>+1(ac) → ArN2 + 2 H2O
Tales sales son adentro extensamente síntesis orgánica para la Reacción de Sandmeyer y se utilizan, y en la preparación tintes azo, compuestos brillante-coloreados para los cuales es la base de una prueba cualitativa anilinas. Se emplea para destruir tóxico y potencial-explosivo azide del sodio.
Su propiedad en la diazotación de aminas orgánicas es muy importante en la fabricación de colorantes.
Referencias
- Babor,J.A y J.Ibarz:: Química General Moderna. Ed. Ciencias y Técnicas. Ciudad de La Habana, Cuba. 1969.
- Blanco Prieto,J y J. Periera Simo: Química Inorgánica Parte I. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1986.
- Mahan,B.H.: Química Universitaria. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1977.
- Piñón, H y R.Menéndez:: Química Elemental. Ed. Ed. Ciencias y Técnicas. Ciudad de La Habana, Cuba. 1969.
- Sienko, M.J y R.A, Plane:: Química. Ed. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1977.
Fuentes
- http://www.quimica.es/enciclopedia/%C3%81cido_nitroso.html
- http://es.wikipedia.org/wiki/%C3%81cido_nitroso
- http://www.canalsocial.net/ger/ficha_GER.asp?id=10373&cat=quimica
- http://www.esacademic.com/dic.nsf/es_mediclopedia/55110/%C3%A1cido