Anticuerpo
| ||||
Anticuerpos.Conocidos también como Inmunoglobulinas(abreviadamente Ig) Son las moléculas de la inmunidad humoral específica y una de sus principales funciones fisiológicas es la defensa contra los microorganismos extracelulares y las toxinas producidas por los distintos agentes microbianos.
Aunque los blancos de los anticuerpos son comúnmente bacterias, hongos y parásitos extracelulares, estas moléculas tienen también un papel muy importante en el control de los procesos infecciosos producidos por los microorganismos intracelulares, tales como los virus, debido a que pueden reconocerlos antes que ellos infecten las células o cuando son liberados como viriones desde las células infectadas. Sin embargo, a pesar de su alta especificidad por microorganismos y toxinas microbianas, los anticuerpos requieren de otros elementos, tales como las células fagocíticas y las células citotóxicas para eliminar los antígenos.
Sumario
Historia y descubrimiento
El primer uso del término "anticuerpo" se produjo en un texto de Paul Ehrlich, donde el término "Antikörper"(la palabra alemana para anticuerpos) aparece en la conclusión de su artículo "Los estudios experimentales sobre la inmunidad", publicado en octubre de 1891.
El estudio de los anticuerpos se inició en 1890, cuando Emil von Behring y Kitasato Shibasaburo describen la actividad de anticuerpos contra la difteria y el tétanos. Behring y Kitasato expuso la teoría de la inmunidad humoral, proponiendo que un mediador en el suero puede reaccionar con un antígeno extraño.
En la década de 1920, Michael Heidelberger y Oswald Avery observan que los antígenos pueden ser precipitados por los anticuerpos y llegan a demostrar que los anticuerpos se hacen de la proteína.
Las propiedades bioquímicas de las interacciones antígeno-anticuerpo fueron examinados con más detalle en la década de 1930 por John Marrack.
El próximo gran avance fue en la década de 1940, cuando Linus Carl Pauling confirmó la teoría de la cerradura y la llave propuesta por Ehrlich mostrando que las interacciones entre anticuerpos y antígenos dependían más de su forma que de su composición química.
En 1948, Astrid Fagreaus descubrió que las células B, en la forma de las células plasmáticas, son responsables de la generación de anticuerpos.
Un avance importante en estos estudios estructurales fue el descubrimiento en la década de 1960 por Gerald Edelman y Joseph Gally de la cadena ligera del anticuerpo, y su comprensión de que esta proteína era la misma que la proteína descrita en 1845 por Henry Bence Jones. Gerald Edelman descubrió que los anticuerpos están compuestos de disulfuro de bonos vinculados a las cadenas pesadas y ligeras. Casi al mismo tiempo,Rodney Porter caracterizaba el anticuerpo de unión (Fab) y la cola del anticuerpo (Fc) de la IgG.
En conjunto, estos científicos logran deducir la estructura y la secuencia completa de aminoácidos de la IgG, una hazaña para la cual fueron galardonados conjuntamente con el Premio Nobel de Medicina en 1972.
Naturaleza de los anticuerpos
Los anticuerpos son sustancias de naturaleza proteica fabricadas por nuestro sistema inmunitario; son capaces de unirse específicamente a ciertas sustancias que se llaman antígenos.
Estructura de los anticuerpos
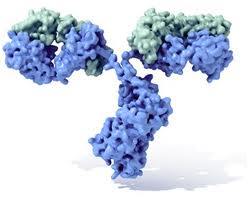
La función esencial de los anticuerpos es activar mecanismos efectores que permitan la eliminación del antígeno del organismo. Están constituidos por cuatro cadenas polipeptídicas: Dos cadenas pesadas (H) idénticas entre si, y dos cadenas livianas (L), iguales entre si. Las dos cadenas pesadas están unidas por enlaces disulfuro y a su vez cada cadena liviana está unida a cada cadena pesada por estos mismos enlaces.
Las cadenas livianas pueden ser de dos tipos: kappa o lambda. En el humano, el 65% de los anticuerpos poseen cadenas kappa y el 35% lambda. Ambas poseen aproximadamente 214 aminoácidos de longitud, que se dividen en dos regiones o dominios: uno llamado región variable de la cadena liviana (V1) que incluye los primeros 107 aminoácidos, y la llamada región constante de la cadena liviana (c1) que incluye la segunda mitad de la cadena. Cada uno de estos dominios posee puentes disulfuro intercatenarios entre las regiones variable y constante.
Las cadenas pesadas son esencialmente de 5 tipos diferentes: mu, delta, gamma, epsilon y alfa. Según la cadena pesada que use el anticuerpo se define su clase o isotipo: si posee cadenas mu, el anticuerpo se denomina inmunoglobulina M o IGM; si posee delta se llama Igd, si posee gamma IgG. Para algunas cadenas pesadas existen subclases diferentes: hay cuatro subclases de gamma: gama 1, 2, 3, y 4, que originan IgG1, IgG2, IgG3 e IgG4, y hay 9 cadenas pesadas distintas para el humano.
Los enlaces disulfuro que unen entre si a las cadenas pesadas (cuyo número varía en las distintas clases y subclases de inmunoglobulinas) están localizados entre los dominio Ch1 y Ch2; esta porción de la molécula recibe el nombre de región bisagra.
Tipos de anticuerpos
Existen cinco clases principales de anticuerpos, llamados isotipos. El isotipo de un anticuerpo es determinado por su región constante. Las cinco clases de anticuerpo son IgG, IgD, IgA, IgE, and IgM; cada isotipo esta asociado con una específica reacción del sistema imunológico. Por ejemplo, anticuerpos del isotipo IgG a menudo reclutan células T citotóxicas que destruyen a las células blanco. El anticuerpo mostrado en la figura anterior es del isotipo IgG1.
Las regiones variables de los anticuerpos reconocen y se unen a antígenos específicos. Es posible para los anticuerpos producidos por más de un tipo de célula B reconocer a un blanco específico. Por ejemplo, una bacteria invasora tendría muchas proteínas blanco en su superficie y sería reconocida por muchos diferentes anticuerpos dentro del mismo cuerpo humano. Hasta una sola proteína (u otro tipo de antígeno) puede ser reconocido por muchos diferentes anticuerpos.
Fuentes
- Articulo Estructura de los Anticuerpos. Disponible en "www.alipso.com". Consultado: 5 de agosto de 2011.
- Articulo El papel del complemento y los anticuerpos en la inflamación. Disponible en "www.encolombia.com". Consultado: 4 de agosto de 2011.
- Articulo Anticuerpo - Información general. Disponible en "www.umm.edu". Consultado: 4 de agosto de 2011.
- Articulo Historia de anticuerpos. Disponible en "www.news-medical.net". Consultado: 4 de agosto de 2011.
- Articulo ¿Qué son los anticuerpos?. Disponible en "www.muyinteresante.es". Consultado: 4 de agosto de 2011.
- Articulo Anticuerpos.Disponible en www.cancerquest.org. Consultado el 4 de agosto de 2011.
- Cavalli-Sforza, Luigi Luca. 2000. Genes, pueblos y lenguas. Primera edición en Ediciones de Bolsillo, BArcelona. 235 pp