Sindrome hemolítico urémico atipico
Síndrome hemolítico urémico atípico. Entidad clínica que se define por la tríada anemia hemolítica microangiopática no inmune, trombocitopenia e insuficiencia renal aguda. Las lesiones histológicas del SHU se caracterizan por la aparición de microangiopatía trombótica (MAT) sistémica, que afecta preferentemente a los vasos renales, observándose engrosamientos de la pared, trombosis y obstrucción de la luz vascular.
Sumario
Clasificación etiológica
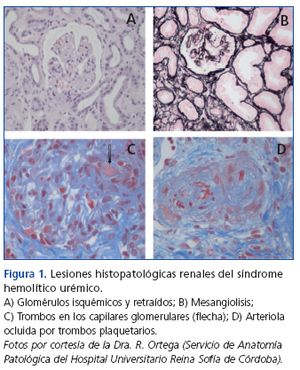
El término MAT define una lesión histológica de arteriolas y capilares que se caracteriza por engrosamiento e inflamación de la pared vascular, desprendimiento de células endoteliales, ensanchamiento subendotelial por acúmulos de proteínas y material de lisis celular, y la presencia de trombos plaquetarios ocluyendo las luces vasculares (figura 1). Existen dos entidades clínicas caracterizadas por lesiones de MAT primaria, de causa y base fisiopatológica diferente: la púrpura trombótica trombocitopénica (PTT) y el SHU.
La trombosis intravascular en la PTT es consecuencia de una deficiencia severa de la actividad metaloproteasa de ADAMTS13 (A Disintegrin And Metalloproteinase with a ThromboSpondin type 1 motif, member 13), una enzima plasmática encargada de fragmentar los multímeros ultralargos del factor de von Willebrand. Dicha deficiencia puede ser de causa genética o adquirida por anticuerpos circulantes de tipo IgG que bloquean ADAMTS13 (especialmente en pacientes en tratamiento con antiagregantes plaquetarios).
El 90 % de los casos de SHU son causados por una infección entérica por STEC a partir de alimentos contaminados (SHU típico/STEC [VTEC]-SHU). La toxina Shiga ejerce un efecto lesivo directo sobre el endotelio vascular desencadenando diversos eventos celulares y vasculares que conducen al desarrollo de MAT. Clínicamente suele debutar con dolor abdominal y diarrea, desarrollándose a los 4-10 días un fracaso renal agudo. El pronóstico suele ser bueno: la mortalidad es < 5 % y se obtiene la recuperación clínica completa en el 80 % de los pacientes.
Por otro lado, el SHUa es una enfermedad en la que los fenómenos de MAT son consecuencia de la desregulación de la vía alternativa del complemento sobre las superficies celulares. Esta alteración puede producirse por mutaciones o polimorfismos que disminuyan la actividad de proteínas reguladoras del complemento o que aumenten la función de proteínas activadoras. En ambos casos, la activación del sistema del complemento (inducida por diversos factores desencadenantes) no se controla adecuadamente y provoca daño endotelial y trombogénesis. De los más de 1.000 pacientes con SHUa publicados en la literatura, se han detectado mutaciones en una o más proteínas del complemento en un 50 % de ellos, aunque no se descarta que en el resto exista también un componente genético o ambiental que determine la alteración del sistema del complemento. De hecho, es destacable el hallazgo de autoanticuerpos contra el factor H del complemento (FH) en el 5-10 % de los pacientes con SHUa. A diferencia del STEC-SHU, que suele ser un evento único, el SHUa es una entidad crónica debido al origen genético de la enfermedad, con mal pronóstico. Tras un primer episodio de SHUa, la mortalidad es del 10-15 % y hasta un 50 % de los pacientes no recuperan la función renal.
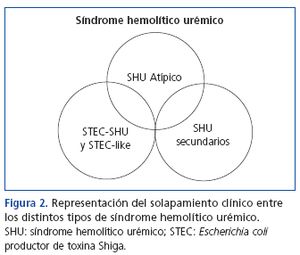
Además de la infección por STEC o de la desregulación genética del complemento, existen otras muchas entidades clínicas y otros factores que pueden asociarse con el desarrollo de SHU o PTT (MAT secundarias). En niños, algunos casos se asocian con aciduria metilmalónica o, más frecuentemente (5 % de los casos de SHU en niños), con infecciones invasivas por serotipos de Streptococcus pneumoniae productores de la enzima neurominidasa, que exponen el criptoantígeno T en la superficie celular y originan el fenómeno de MAT, o bien por infección por virus H1N1. En adultos se han descrito casos de MAT asociados a infección por el virus de la inmunodeficiencia humana, ciertos procesos neoplásicos, fármacos (quimioterápicos, inhibidores de la calcineurina [ciclosporina y tacrolimus], inhibidores de la mTOR [mammalian target of rapamycin; sirolimus, everolimus], inhibidores del factor de crecimiento vascular endotelial, antiagregantes plaquetarios o anticonceptivos orales, entre otros), la hipertensión arterial maligna, el trasplante de médula ósea o de órganos sólidos, el embarazo o enfermedades sistémicas (lupus eritematoso sistémico, esclerodermia y síndrome antifosfolípido). La tabla 1 presenta una propuesta de clasificación etiológica de las MAT. En algunos pacientes puede coexistir más de un factor etiológico responsable de la lesión de MAT, dando lugar a una clínica heterogénea. Recientemente se ha descrito que hasta un 25 % de los pacientes con STEC-SHU y un 86 % de las pacientes con SHU secundario a embarazo pueden presentar mutaciones en el sistema del complemento, pudiéndose considerar en estos casos que la enfermedad subyacente es en realidad un SHUa. En este sentido, la figura 2 representa el potencial solapamiento que puede darse entre estas entidades clínicas. Como el motivo de discusión principal de este documento es la actualización del SHUa mediado por alteraciones en la regulación del complemento, en los siguientes apartados únicamente se hace referencia a esta entidad.
Epidemiología
El SHUa se considera una enfermedad ultra-rara. Existen muy pocos datos acerca de su incidencia y prevalencia, siendo limitados los conocimientos de la epidemiología real de la enfermedad. En Estados Unidos se estima que el SHUa tiene una incidencia anual de ~1-2 casos/millón de habitantes. En Europa, en un reciente estudio multicéntrico internacional se ha observado una incidencia de 0,11 casos/millón de habitantes de entre 0 y 18 años. Con relación a la prevalencia, la EMA (European Medicines Agency) estima que esta puede ser de ~3,3 pacientes por millón de habitantes/año en menores de 18 años, con cifras inferiores en adultos.
El SHUa afecta mayoritariamente a niños y adultos jóvenes, aunque puede aparecer en cualquier edad de la vida. El inicio de la enfermedad es más frecuente antes de los 18 años (60 vs. 40 %), siendo la distribución por sexos similar (con cierta preponderancia en mujeres cuando la enfermedad aparece en la edad adulta).
Clínica
El inicio de la clínica suele ser abrupto, aunque en un 20 % de los pacientes puede ser progresivo (semanas o meses) con anemia subclínica, trombocitopenia fluctuante y función renal conservada. El cuadro se caracteriza por la tríada de anemia hemolítica microangiopática no inmune, trombocitopenia y fracaso renal agudo. Los niveles altos de lactato deshidrogenasa (LDH), los niveles indetectables de haptoglobina y la presencia de esquistocitos confirman la presencia de hemólisis intravascular. Se observa hematuria, proteinuria y/o fracaso renal agudo (con o sin oligoanuria). La presencia de hipertensión arterial, por sobrecarga de volumen o por lesión vascular, es frecuente.
Aunque las lesiones en el SHUa afectan predominantemente a los vasos renales, el carácter difuso del fenómeno de MAT conduce a la afectación de la microvasculatura de otros órganos (cerebro, corazón, intestinos, páncreas y pulmones)1, lo que explica la aparición frecuente de síntomas extrarrenales. Los más frecuentes son los de tipo neurológico (48 %), incluyendo irritabilidad, somnolencia, confusión, convulsiones, encefalopatía, accidente cerebrovascular, hemiparesias, hemiplejías o coma. El infarto de miocardio se ha descrito hasta en un 3 % de los pacientes con SHUa, pudiéndose relacionar con muerte súbita. La miocardiopatía, la insuficiencia cardíaca y la vasculopatía isquémica periférica también han sido descritas, así como la diarrea (30 %) y otros síntomas gastrointestinales (colitis, náuseas y vómitos o dolor abdominal). La variabilidad de la sintomatología dificulta el diagnóstico diferencial con otras causas de MAT.
Fisiopatología
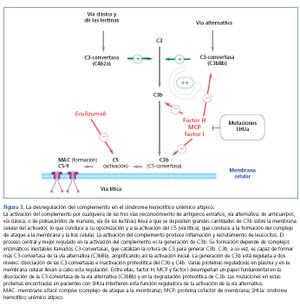
El sistema del complemento, formado por numerosas proteínas plasmáticas circulantes y asociadas a membranas celulares, es esencial en la defensa contra las infecciones, el procesamiento de complejos inmunes, la respuesta de anticuerpos y la eliminación de restos apoptóticos. Su activación por cualquiera de las vías existentes (clásica, de las lectinas y alternativa) conlleva la formación de complejos multiproteicos con actividad C3-convertasa que escinden la proteína C3, generando C3b (figura 3). Esta molécula puede unirse covalentemente a las superficies responsables de la activación del complemento, facilitando su fagocitosis por polimorfonucleares y macrófagos e iniciando el ensamblaje del complejo de ataque a la membrana que conduce a la lisis celular. Además, el C3b amplifica exponencialmente la activación del complemento promoviendo la formación de más C3-convertasas. Para evitar que la activación del complemento lo consuma totalmente e impedir dañar los tejidos propios (el C3b se une indiscriminadamente tanto a patógenos como a células propias), existen numerosas proteínas reguladoras del proceso, como el FH, la proteína cofactor de membrana (MCP) y el factor I del complemento (FI), que disocian las C3-convertasas e inducen la degradación de C3b. En consecuencia, en condiciones normales los niveles de C3b se mantienen bajos y cuando se activa el complemento su depósito se limita a las estructuras responsables de esa activación.
Estudios diversos han establecido que un 40-60 % de los pacientes con SHUa son portadores de mutaciones en genes del complemento (gen del factor H del complemento [CFH], gen de la proteína cofactor de membrana [MCP], gen del factor I del complemento [CFI], gen de la trombomodulina [THBD], gen del factor B del complemento [CFB] y gen del C3 [C3]) que se relacionan con la desregulación de la vía alternativa (tabla 2). El FH actúa en plasma controlando la homeostasis del complemento y sobre superficies celulares evitando el daño a componentes propios. Las mutaciones en FH asociadas con SHUa se agrupan en la región C-terminal, disminuyendo la protección de las superficies celulares al daño accidental producido por la activación del complemento, pero no afectan la regulación del complemento en plasma. La conclusión de estos estudios funcionales en mutantes de FH es que el SHUa es consecuencia de una lesión causada por el complemento debido a una pérdida de regulación de la actividad del complemento sobre las superficies celulares propias. El ensayo funcional de las mutaciones asociadas con SHUa encontradas en otros genes del complemento, como MCP, CFI, CFB o C3, han confirmado las hipótesis anticipadas en los estudios con FH, demostrando además que la desregulación de la activación del complemento sobre las superficies celulares que se produce en el SHUa puede deberse a una disminución en la actividad de las proteínas reguladoras o a una actividad anormalmente elevada de las C3-convertasas. Así, mientras que las mutaciones en FH, MCP, FI y en la trombomodulina (THBD) incapacitan a estas proteínas para realizar su función reguladora, las mutaciones en el factor B del complemento (FB) o C3 resultan en una C3-convertasa más activa.
Un 5-10 % de los pacientes con SHUa presenta autoanticuerpos anti-FH dirigidos contra la región C-terminal, con consecuencias similares a las de las mutaciones en FH. Su papel en la patogénesis del SHUa no está completamente establecido, pero parecen asociarse con el inicio o las recurrencias de la enfermedad. El título de anticuerpos puede disminuir con el tiempo, debiéndose realizar su búsqueda al inicio del SHUa.
La penetrancia del SHUa en los portadores de mutaciones en alguno de los genes del complemento es del 50 % aproximadamente, siendo habitual que en familias con mutaciones identificadas solo algunos de los portadores desarrollen SHUa y que la presentación clínica sea variable. Existe también una gran heterogeneidad clínica entre pacientes no emparentados portadores de la misma mutación. Todo ello sugiere que deben de existir factores adicionales (genéticos y ambientales) que modulan el desarrollo y evolución de la enfermedad. La búsqueda de mutaciones del complemento en pacientes con SHUa y la realización de estudios de asociación casos-controles utilizando polimorfismos genéticos en genes candidatos o marcadores genéticos distribuidos a lo largo del genoma humano han identificado que algunas variantes (polimorfismos) de los genes CFH y MCP modulan la penetrancia y la gravedad de la enfermedad (tabla 2). Estas observaciones, junto con el hecho de que hasta un 10 % de los pacientes con SHUa tienen mutaciones en más de un gen del complemento, indican que la coincidencia de diferentes factores genéticos de riesgo es determinante para el desarrollo del SHUa (teoría de los multiple hits).
De forma adicional a las mencionadas alteraciones genéticas, en el inicio del SHUa participan también factores ambientales desencadenantes. Las mutaciones comentadas anteriormente predisponen a la enfermedad impidiendo una regulación adecuada del complemento sobre las superficies celulares ante una situación que dispare la activación del sistema en la microvasculatura. Los eventos infecciosos desencadenan el SHUa en el 50-80 % de los pacientes, especialmente los del tracto respiratorio superior (virus de la influenza H1N1). La diarrea por gastroenteritis puede preceder al SHUa hasta en un 30 % de los casos (incluyendo diarrea por STEC). En mujeres, el embarazo es un frecuente factor desencadenante de SHUa.
Pronóstico
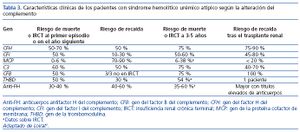
La tabla 3 muestra la evolución clínica de los pacientes con SHUa según el tipo de mutación que presenten. En general, los pacientes con mutaciones en FH y C3 se asocian con un peor pronóstico durante el episodio de SHUa y los meses siguientes, con unas tasas de mortalidad o insuficiencia renal crónica terminal (IRCT) y de recurrencia del 50-70 % y del 50 % respectivamente. Por el contrario, solo el 0-6 % de los pacientes con mutaciones en MCP fallecen o progresan a IRCT, aunque el riesgo de recaída es mayor. A medio plazo, 3 de cada 4 pacientes con mutaciones en FH, C3 o FB fallecen o presentan IRCT.
Diagnostico
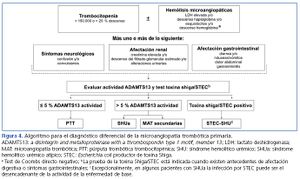
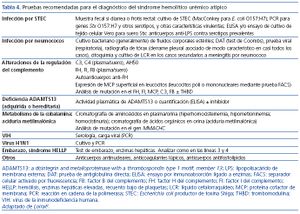
La figura 4 y la tabla 4 muestran, respectivamente, un algoritmo para el diagnóstico diferencial de MAT y las pruebas biológicas recomendadas en los pacientes con sospecha diagnóstica de SHUa. Debido a la rápida evolución y gravedad de la MAT, es necesario diferenciar en el proceso diagnóstico un primer nivel inmediato (primeras 24 h), que tiene como objetivo la identificación sindrómica e instauración precoz de medidas de soporte, de un segundo nivel dirigido al diagnóstico etiológico.
En los pacientes con MAT la analítica mostrará la presencia de trombopenia (plaquetas < 150.000/mm o descenso > 25 % desde el inicio) y hemólisis microangiopática (hemoglobina < 10 mg/dl con test de Coombs directo negativo [si bien algunos pacientes con SHU relacionado con neumococo pueden presentar un test de Coombs directo positivo], LDH elevada, descenso de haptoglobina, reticulocitosis y presencia de esquistocitos). Aunque es posible detectar algunos esquistocitos en la mayoría de los pacientes con enfermedad renal, preeclampsia o válvulas mecánicas, un número de esquistocitos > 1 % es diagnóstico de MAT en ausencia de otra causa conocida.
La observación de unos niveles elevados de creatinina sérica, un filtrado glomerular (FG) bajo o la presencia de proteinuria o hematuria son indicativos de la disfunción renal. En pacientes pediátricos no se precisa biopsia renal para el diagnóstico. En adultos, la realización de una biopsia renal suele recomendarse ante un fracaso renal agudo para perfilar la etiología, descartar otros procesos y valorar el pronóstico, si bien la indicación de biopsia debe valorarse individualizadamente en los pacientes con sospecha de MAT debido al riesgo de sangrado.
Es necesaria una historia clínica completa que incluya la historia familiar y la búsqueda de factores desencadenantes, así como una exhaustiva exploración física. Contrariamente a lo que se consideraba hace años, en la actualidad se admite que los signos y síntomas de los diferentes tipos de MAT no son específicos y no permiten realizar el diagnóstico diferencial. Clásicamente, la distinción entre SHU y PTT se basaba en criterios clínicos, considerándose el SHU cuando predominaba la afectación renal y la PTT cuando predominaba la afectación neurológica. Sin embargo, se ha descrito que un 50 % de los pacientes con PTT presentan disfunción renal y un 50 % de los pacientes con SHUa presentan alteraciones neurológicas. Tampoco la clínica permite diferenciar entre STEC-SHU y SHUa, ya que hasta un 30 % de los casos de SHUa se inician tras una gastroenteritis o presentan diarrea (síntoma característico del STEC-SHU).
La detección de la toxina Shiga o el cultivo positivo de STEC en pacientes con MAT es diagnóstico de STEC-SHU, mientras que el diagnóstico de PTT requiere la demostración de que la actividad plasmática de ADAMTS13 es ≤ 5 %60. En el resto de los casos el diagnóstico deberá orientarse hacia SHUa, siendo necesario realizar pruebas adicionales para descartar MAT secundarias.
Tratamiento
Terapia plasmatica
Las dos modalidades de Terapia Plasmatica (TP) son la infusión de plasma (IP) y el recambio plasmático (RP). En la IP el paciente recibe plasma fresco congelado viroinactivado ajeno (FFP: fresh frozen plasma) con reguladores del complemento funcionales. En el RP se remplaza el plasma del paciente con SHUa por FFP, por lo que no solo se administran dosis elevadas de proteínas reguladoras del complemento funcionales, sino que también se eliminan los inhibidores solubles del complemento disfuncionales endógenos, con menor riesgo de sobrecarga de volumen. Además en el RP se depuran también los anticuerpos anti-FH y los posibles factores inflamatorios/trombogénicos que participan en el daño endotelial y la hiperagregación plaquetaria. Clásicamente, el tratamiento de elección recomendado en los episodios de SHUa consiste en la instauración precoz e intensiva de RP a volúmenes elevados en frecuencia variable según la actividad de la enfermedad, mientras que las IP suelen ser ineficaces, excepto en los escasos pacientes con déficit completo de FH. En general, la TP no se considera eficaz en pacientes con mutaciones en MCP, ya que esta es una proteína no circulante anclada a la membrana celular, observándose que prácticamente la totalidad de estos pacientes remiten tras un episodio de SHUa independientemente del uso de TP.
Aunque no se dispone de ensayos clínicos prospectivos, la TP ha sido empíricamente el tratamiento de elección para el SHUa durante años, tras observarse hace más de tres décadas que disminuía la mortalidad en pacientes con PTT-SHU. En los pacientes con anticuerpos anti-FH, se ha observado que el tratamiento inmunosupresor concomitante a la TP puede mejorar los resultados. En estos casos, un título elevado de anticuerpos se correlaciona con un mayor riesgo de recaída y de secuelas renales. La aparición de reacciones anafilácticas al FFP, la hipervolemia, la hipertensión, la insuficiencia cardíaca o la hiperproteinemia son complicaciones potenciales de la IP. Las principales complicaciones del RP son la obstrucción de la vía venosa (6 %), hipotensión (5 %) y alergia (4 %), cuya frecuencia es más elevada en los pacientes pediátricos.
Eculizumab
Eculizumab es un anticuerpo IgG2/4κ monoclonal humanizado que se une a la proteína del complemento C5 con gran afinidad, bloqueando la escisión a C5a y C5b e impidiendo la generación del complejo C5b-9 del complemento terminal (complejo de ataque de membrana) (figura 3). En el SHUa la desregulación de la vía alternativa del complemento conlleva una activación incontrolada de este que provoca daño en estructuras propias mediante la formación del complejo de ataque de membrana. En este sentido, el bloqueo del complemento terminal con eculizumab reduce rápida y sostenidamente el proceso, y en múltiples casos publicados de pacientes con SHUa se ha observado una buena respuesta clínica al fármaco.
La eficacia y seguridad de eculizumab frente al SHUa ha sido evaluada en dos recientes estudios clínicos de fase II prospectivos, multicéntricos, controlados, abiertos y de 26 semanas de duración, en pacientes ≥ 12 años con enfermedad primaria o recurrente tras el TR. Uno incluyó 17 pacientes resistentes a TP (≥ 4 sesiones/semana) (estudio C08-002) y el otro 20 pacientes en tratamiento crónico con plasma (≥ 8 semanas) (estudio C08-003). Las mutaciones más frecuentes en estas poblaciones fueron las relacionadas con FH (15 pacientes) y FI. Tres pacientes presentaban mutaciones en MCP, tres en C3 y uno en FB. Se hallaron anticuerpos anti-FH en 4 pacientes y en 10 no se identificó ninguna alteración genética. En ambos estudios la respuesta al eculizumab fue similar entre los pacientes en los que se identificaron mutaciones y/o anticuerpos anti-FH y en los que no se halló ninguna alteración genética. La respuesta fue también similar independientemente del tipo de mutaciones identificadas. A los 6 meses de tratamiento con eculizumab las tasas de normalización hematológica (≥ 2 mediciones consecutivas normales de plaquetas y LDH) fueron del 76 % en el estudio de resistentes y del 90 % en el de crónicos. Las tasas de pacientes libres de eventos de MAT (no disminución de plaquetas > 25 %; sin necesidad de TP ni de nuevas sesiones de diálisis) fueron del 88 y del 80 %, observándose una reducción significativa de la tasa de intervenciones diarias para MAT (sesiones de IP/RP o nuevas sesiones de diálisis) desde 6 y 1,5 intervenciones en el nivel basal a ninguna (p < 0,0001). Al final del seguimiento el FG había aumentado significativamente en ambas poblaciones (resistentes: +31 ml/min/1,73 m2, p = 0,0001; crónicos: +6,1 ml/min/1,73 m2, p = 0,0003) y el 80 % de los pacientes resistentes que estaban en diálisis al inicio del tratamiento (4 de 5) pudieron abandonarla al final de este. Se observó que los pacientes que iniciaron eculizumab en los primeros 10 días tras el diagnóstico de SHUa presentaron un mayor incremento del FG que los que lo iniciaron a los 2-4 meses (+59 ml/min/1,73 m2 vs. +7 ml/min/1,73 m2, p = 0,03). En los estudios de extensión (seguimiento medio: 64-62 semanas) la mejoría de la función renal se mantuvo. En relación con los niveles de proteinuria, tras un año de eculizumab estos fueron significativamente menores vs. el nivel basal (p = 0,05). Se comunicaron efectos adversos en 19 pacientes, incluyendo 4 efectos adversos graves (peritonitis, infección por influenza, trastorno venoso e hipertensión severa). Debido a su mecanismo de acción, eculizumab incrementa el riesgo de infección por Neisseria meningitidis, por lo que todos los pacientes fueron vacunados contra Neisseria (vacuna tetravalente) antes de iniciar el tratamiento o recibieron profilaxis antibiótica, sin observarse ningún caso de meningitis. La supervivencia fue del 100 % en ambos estudios.
Existe también un estudio retrospectivo de 19 pacientes pediátricos tratados en condiciones de práctica clínica con eculizumab durante 28 semanas de media4,11. En dicho estudio, el 89 % de los pacientes normalizaron la cifra de plaquetas y el 68 % se mantuvieron libres de eventos de MAT. La tasa de intervenciones para MAT se redujo desde ~3 por paciente/semana a 0. El FG aumentó ≥ 15 ml/min/1,73 m2 en el 47 % de los pacientes y en el 50 % se eliminó la necesidad de diálisis. Los efectos adversos más frecuentes fueron pirexia (47 %), diarrea (32 %) e infecciones del tracto respiratorio superior (32 %).
Basándose en estos resultados, la FDA (Food and Drug Administration) y la EMA aprobaron en Estados Unidos y Europa, respectivamente, la indicación de eculizumab para el tratamiento del SHUa4. La reciente disponibilidad del fármaco en nuestro país ofrece la posibilidad de mejorar sustancialmente el manejo de los pacientes con SHUa, ya que la indicación aprobada autoriza su uso en primera línea. A continuación, se presentan recomendaciones de tratamiento del SHUa realizadas por los autores del presente documento a partir de las evidencias disponibles y la experiencia clínica.