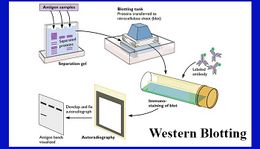
Western blot
| ||||||
Western blot. Técnica analítica empleada en biología celular y molecular que permite identificar proteínas específicas en una mezcla compleja de proteínas extraídas de un tejido o tipo celular. Puede ser utilizada para evaluar el tamaño de la proteína de interés, así como medir los niveles de expresión de proteínas. La especificidad de la técnica se logra mediante el uso de un anticuerpo que reconoce y se une a un epítopo único de la proteína de interés. Es un método ampliamente utilizado en biología molecular, bioquímica, inmunogenética, inmunohistoquímica, inmunocitoquímica y otras disciplinas.
Sumario
Antecedentes
El método Western blot fue propuesto por primera vez por Harry Towbin, Julian Gordon y Theo Staehelin en 1979, cuando realizaron y evaluaron la transferencia electroforética de proteínas en geles de poliacrilamida hacia membranas de nitrocelulosa, marcando el inicio de las técnicas de transferencia de proteínas. El procedimiento debe su nombre a la similitud con el método Southern blot, desarrollado previamente.
Principio
El método consta de tres procesos principales: la separación de las proteínas mediante electroforesis, la transferencia a un soporte sólido y el marcaje de la proteína diana mediante el uso de anticuerpos primarios y secundarios específicos que permiten su detección. La electroforesis permite la separación de las proteínas de acuerdo a la movilidad, que depende de la carga, el tamaño y la estructura de las proteínas. A través de la transferencia, las proteínas se mueven desde el interior del gel a una membrana de nitrocelulosa (NC) o difluoruro de polivinilideno (PVDF). Sin preactivación, las proteínas se combinan con la membrana de nitrocelulosa a través de interacciones hidrofóbicas. Para la detección de las proteínas, se utiliza el anticuerpo primario y el anticuerpo secundario específicos conjugado con una enzima. El sustrato reacciona con la enzima que se une al anticuerpo primario o secundario para generar una sustancia coloreada, es decir, bandas proteicas visibles.
Procedimiento
1. Preparación de la muestra
En la mayoría de los ensayos, las proteínas se extraen mediante procesos químicos y/o mecánicos. El método elegido dependerá del tipo de muestra de partida, de la localización subcelular de la proteína y de las condiciones óptimas que requiera el anticuerpo para reconocer el epítopo proteico. En los procesos de lisis químicas, se suelen utilizar detergentes. La estructura química de estos permite romper las membranas celulares y solubilizar las proteínas. Se añaden inhibidores de proteasas para prevenir que estas puedan dañar las proteínas de interés además de dodecilsulfato de sodio (SDS) y beta-mercaptoetanol o ditiotreitol (DTT) para reducir y desnaturalizar las proteínas. En ocasiones, la proteína de interés no debe ser reducida o desnaturalizada porque un anticuerpo particular solo reconoce esta forma de la proteína. Por lo tanto, los pasos de reducción y desnaturalización se pueden omitir, si es necesario.
2. Electroforesis
La mayoría de ensayos Western Blot, se realizan en geles de poliacrilamida en condiciones desnaturalizantes (SDS-PAGE). Bajo estas condiciones desnaturalizantes y de reducción, las proteínas cargadas negativamente, cuando se someten a un campo eléctrico, migran al electrodo positivo. Debido a que el SDS iguala la carga en todas las proteínas, la tasa de migración viene determinada por su peso molecular. Las moléculas más pequeñas migran más rápidamente que aquellas con pesos moleculares mayores.
3. Transferencia
El principio de la transferencia es similar a la electroforesis, ya que se "transfieren" del gel, las proteínas cargadas negativamente hacia un polo positivo dentro de un campo eléctrico. Para esto el gel se coloca adyacente a una membrana porosa, y este sándwich de membrana y gel se agrega a un casete de transferencia con la membrana más cercana al polo positivo. Los tipos de membranas disponibles son comúnmente PVDF o nitrocelulosa. Cada una tiene diferentes características. La membrana de PVDF, ofrece una mayor resistencia mecánica, resistencia al SDS y una mayor unión que la nitrocelulosa. La membrana de nitrocelulosa tiene la ventaja de proporcionar un menor ruido de fondo y no requiere un pretratamiento con metanol.
4. Inmunotinción
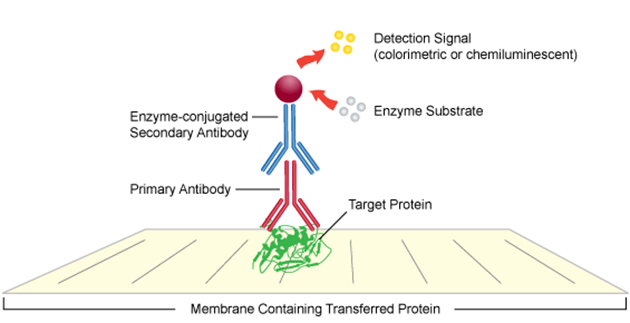
El primer paso es bloquear el espacio vacío en la membrana con una proteína neutral. A menudo, son soluciones a base de proteínas, como la leche descremada en polvo o la albúmina de suero bovino (BSA). Las proteínas en la leche o la BSA se unen a la membrana para cubrir los espacios libres, para que el anticuerpo no se adhiera a estas áreas más adelante. Luego, la membrana se incuba con el anticuerpo primario. En general, los anticuerpos reconocen una secuencia de aminoácidos (epítopo) que queda expuesta al eliminar la estructura tridimensional de la proteína en condiciones desnaturalizantes y reductoras. Los geles nativos se pueden utilizar cuando los anticuerpos requieren la proteína plegada para el reconocimiento del antígeno. Una vez que el anticuerpo se ha unido, la membrana debe lavarse para eliminar cualquier anticuerpo residual. La membrana se trata entonces con el anticuerpo secundario que se conjuga con una molécula que se puede visualizar fácilmente. El anticuerpo secundario será específico para el anticuerpo primario, por lo que se une solo a este, permitiendo la detección de la proteína de interés.
5. Detección
La detección de la proteína se puede hacer mediante métodos directos o indirectos. Los métodos directos utilizan un anticuerpo primario conjugado con un marcaje detectable, como una enzima, molécula fluorescente o marcaje radiactivo. Los métodos indirectos utilizan dos anticuerpos; un anticuerpo primario y un anticuerpo secundario contra la especie del primer anticuerpo. En la detección indirecta, es el anticuerpo secundario el que está conjugado con un marcaje detectable. Esta última es la forma más utilizada debido a la amplificación de la señal que produce. Los tres tipos de detección que se usan comúnmente en el Western Blot son quimioluminiscencia, fluorescencia y colorimetría (Figura 1).
Aplicaciones
- Es un método excelente con una alta sensibilidad (0.1 ng) para detectar una proteína en particular.
- Se utiliza en el diagnóstico clínico de diferentes enfermedades. Como prueba confirmatoria para la detección de VIH, enfermedad de Lyme, encefalopatía espongiforme bovina entre otras.
- Se utliza para cuantificar proteínas y otros productos génicos en estudios de expresión génica.
- Dado que el Western blot detecta las proteínas por su tamaño y capacidad para unirse al anticuerpo, es apropiado para evaluar la expresión de proteínas en las células y el análisis de las fracciones de proteínas durante los procesos de purificación.
- Se utiliza para el análisis de diferentes biomarcadores como factores de crecimiento, citocinas y hormonas.
- Determinación de anticuerpos específicos en suero para el diagnóstico de neurocisticercosis cerebral y meningitis tuberculosa.
- Es útil para comparar la expresión de una proteína diana en varios tejidos o ver cómo una proteína en particular responde a una enfermedad o a tratamiento con medicamentos.
Ventajas
Sensibilidad
Uno de los mayores argumentos a favor de Western Blot es su sensibilidad. Debido a la capacidad para detectar tan solo 0.1 nanogramos de proteína en una muestra, la técnica puede servir teóricamente como una herramienta de diagnóstico precoz eficaz, detectando incluso la más mínima respuesta inmunogénica de un virus o bacteria en una muestra de un paciente. Un Western blot indirecto contribuye aún más a esta sensibilidad a partir de la capacidad del anticuerpo secundario para amplificar la intensidad de la señal detectada por el sistema de imágenes. Una mayor sensibilidad significa que se necesitan menos anticuerpos para las pruebas, lo que reduce significativamente los costos de laboratorio.
Especificidad
La técnica debe su especificidad a dos grandes factores contribuyentes. Primero, la electroforesis en gel clasifica una muestra en proteínas de diferente tamaño, carga y conformación. Este proceso en sí mismo es un gran paso hacia la detección, ya que las bandas formadas en el gel ya dan pistas sobre el tamaño de la proteína o polipéptido de interés. La especificidad de la interacción anticuerpo-antígeno sirve como el segundo factor importante. Debido a que los anticuerpos específicos muestran afinidad por proteínas específicas, el proceso puede detectar selectivamente una proteína objetivo incluso en una mezcla de 300,000 proteínas diferentes.
Desventajas
Propenso a resultados falsos o subjetivos
A pesar de su sensibilidad y especificidad, un Western blot puede producir resultados erróneos. Un resultado falso positivo es cuando un anticuerpo reacciona con una proteína no deseada, que es lo que ocurre con frecuencia cuando un paciente que se está haciendo la prueba del VIH tiene tuberculosis o una serie de infecciones parasitarias. Un falso negativo, por otro lado, puede resultar fácilmente si a las proteínas más grandes no se les da el tiempo suficiente para transferirlas adecuadamente a la membrana. La transferencia y el procesamiento incorrectos a menudo producen bandas sesgadas, desvaídas o incluso múltiples, lo que hace que los resultados de las pruebas estén sujetos a la interpretación del técnico.
Alto costo y demanda técnica
El costo de un Western blot es una combinación de los gastos individuales para anticuerpos etiquetados, analistas expertos y equipos de laboratorio. El método requiere precisión en cada paso para la identificación adecuada de los componentes de una muestra. Un error menor en la concentración de reactivo o en el período de incubación puede ser negativo para todo el proceso. Finalmente, el equipo requerido para la detección y la obtención de imágenes (sistemas de detección quimioluminiscentes, fluorescentes, radiactivos o láser) puede ser demasiado costoso para la unidad de microbiología promedio.
Fuentes
- https://www.nature.com/scitable/definition/western-blot-288/
- https://www.nationaldiagnostics.com/electrophoresis/article/overview-western-blotting
- https://www.bosterbio.com/protocol-and-troubleshooting/western-blot-principle
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3456489/#!po=1.42857
- https://www.e-allscience.com/blogs/articulos/introduccion-a-western-blot
- https://es.mosg-portal.com/advantages-disadvantages-western-blot-8670663-357
- https://www.sinobiological.com/category/wb-medical-diagnosis
- https://blog.praxilabs.com/2020/05/29/western-blot-concept/
- https://microbenotes.com/western-blotting-introduction-principle-and-applications/
- https://microbenotes.com/western-blot/