Glucógeno
| ||||||
Glucógeno. Polisacáridos, es la forma principal de almacenaje de carbohidratos en los animales, se encuentra en proporción mayor en el hígado (hasta 6%) y en el músculo, se encuentra del 2-3% . Sin embargo, debido a su masa mayor, el músculo almacena tres a cuatro veces la cantidad de glucógeno que tiene el hígado como reserva. Al igual que el almidón, es un polímero ramificado de alfa-glucosa.
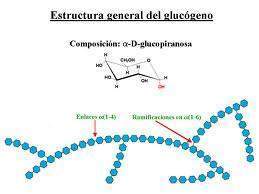
En las células hepáticas, el glucógeno aparece en forma de grandes gránulos, constituidos por agrupaciones de simples moléculas, muy ramificadas, por lo que tiene un peso molecular muy elevado. A semejanza de la amilopectina, el glucógeno es un polisacárido de la D-glucosa con enlaces alfa 1-4, sin embargo, está más ramificado, y su molécula es más reducida que la amilopectina; las ramificaciones aparecen cada 8 a 12 residuos de glucosa.
El glucógeno puede aislarse de los tejidos animales digiriéndolos con disoluciones calientes de KOH en las que los enlaces no reductores alfa 1-4 y alfa 1-6 son estables.
Sumario
Estructura del glucógeno
Su estructura puede parecerse a la de amilopectina del almidón, aunque mucho más ramificada que ésta. Está formada por varias cadenas que contienen de 12 a 18 unidades de α-glucosas formadas por enlaces glucosídicos 1,4; uno de los extremos de esta cadena se une a la siguiente cadena mediante un enlace α-1,6-glucosídico, tal y como sucede en la amilopectina. Una sola molécula de glucógeno puede contener más de 120.000 moléculas de glucosa. La importancia de que el glucógeno sea una molécula tan ramificada es debido a que:
- La ramificación aumenta su solubilidad.
- La ramificación permite la abundancia de residuos de glucosa no reductores que van a ser los lugares de unión de las enzimas glucógeno fosforilasa y glucógeno sintetasa, es decir, las ramificaciones facilitan tanto la velocidad de síntesis como la de degradación del glucógeno.
El glucógeno es el polisacárido de reserva energética en los animales que se almacena en el hígado (10% de la masa hepática) y en los músculos (1% de la masa muscular) de los vertebrados. Además, pueden encontrarse pequeñas cantidades de glucógeno en ciertas células gliales del cerebro. Gracias a la capacidad de almacenamiento de glucógeno, se reducen al máximo los cambios de presión osmótica que la glucosa libre podría ocasionar tanto en el interior de la célula como en el medio extracelular.
Cuando el organismo o la célula requieren de un aporte energético de emergencia, como en los casos de tensión o alerta, el glucógeno se degrada nuevamente a glucosa, que queda disponible para el metabolismo energético.
En el hígado la conversión de glucosa almacenada en forma de glucógeno a glucosa libre en sangre, está regulada por la hormona glucagón y adrenalina. El glucógeno hepático es la principal fuente de glucosa sanguínea, sobre todo entre comidas. El glucógeno contenido en los músculos es para abastecer de energía el proceso de contracción muscular.
El glucógeno se almacena dentro de vacuolas en el citoplasma de las células que lo utilizan para la glucólisis. Estas vacuolas contienen las enzimas necesarias para la hidrólisis de glucógeno a glucosa.
Glucógeno muscular
El glucógeno muscular es la forma de energía preferida por el organismo en la mayoría de los entrenamientos o ejercicios físicos. Es el que aporta energía en ejercicios da media y alta intensidad. En los ejercicios de máxima intensidad de menos de quince segundos de duración la energía proviene directamente del ATP.
El glucógeno por medio de distintos procesos se convierte en ATP que es la forma de energía más básica. Si el proceso requiere de gran cantidad de energía se realizara por la glucolisis y parte se convertirá en ácido láctico, para este proceso no hace falta oxígeno. Por el contrario si el proceso es menos intenso el glucógeno o glucosa pasara por el ciclo krebs y será necesaria la utilización del oxigeno, esto es lo denominado ejercicio aeróbico.
Importancia biomédica
La función del glucógeno muscular es actuar como una fuente de fácil disponibilidad de unidades de hexosa para la glucólisis dentro del propio músculo. El glucógeno hepático sirve en gran parte para exportar unidades de hexosa para la conservación de la glucosa sanguínea, en particular entre comidas.
Después de 12 a 18 horas de ayuno, el hígado casi agota su reserva de glucógeno. El glucógeno muscular sólo disminuye de manera significativa después de ejercicio vigoroso prolongado. Puede inducirse un almacenaje mayor de glucógeno muscular con dietas ricas en carbohidratos después de la depleción por el ejercicio.
Las "enfermedades por almacenamiento de glucógeno" son un grupo de trastornos hereditarios que se caracterizan por movilización deficiente del glucógeno y depósito de formas anormales del mismo, conduciendo a debilidad muscular e inclusive muerte.
Metabolismo del glucógeno
Digestión de Almidón y Glucógeno
En los animales, la digestióndel almidón y del glucógeno empieza en la boca, con la acción de la alfa-amilasa que se secreta en la saliva. Esta enzima rompe con los enlaces internos alfa 1-4 de ambos polímeros.
En el intestino, la digestión continúa, facilitada por la alfa- amilasa secretada por el páncreas. Esta enzima degrada la amilosa a maltosa y un poco de glucosa. Sin embargo, solo degrada parcialmente la amilopectina y el glucógeno, porque no es capaz de romper los enlaces alfa 1,6 que se encuentran en los puntos de ramificación.
El producto de la digestión completa de la amilopectina o del glucógeno por la alfa-amilasa se denomina dextrina límite, para continuar su degradación es necesaria la acción de una "enzima desramificante", la alfa 1-6 glucosidasa (también llamada isomaltasa). Esta acción expone un nuevo grupo de ramificaciones con enlaces alfa 1-4, que pueden ser atacadas por la alfa-amilasa, hasta alcanzar una nueva serie de ramificaciones con enlaces alfa 1-6.
El resultado final de la acción secuencial de estas dos enzimas es la degradación completa del almidón o glucógeno a maltosa y algo de glucosa. La maltosa se rompe hidrolíticamente por la maltasa, dando 2 moléculas de glucosa, que se absorbe a continuación al torrente circulatorio y se transporta a los diversos tejidos para su utilización.
Movilización del Glucógeno
Las principales reservas de glucógeno de los vertebrados se encuentran en el músculo esquelético y en el hígado. La degradación de estas reservas en energía utilizable, o movilización del glucógeno, requiere las rupturas fosforolíticas secuenciales de los enlaces alfa 1-4, catalizadas por la glucógeno fosforilasa.
En las plantas, el almidón se moviliza de manera similar por la acción de la fosforilasa del almidón. Ambas reacciones liberan glucosa 1- fosfato a partir de los extremos no reductores del polímero de glucosa. La reacción de ruptura está ligeramente desfavorecida en condiciones estándar pero las concentraciones intracelulares relativamente elevadas de fosfato inorgánico hacen que esta reacción opere in vivo casi exclusivamente en la dirección de degradación, en vez de en la dirección de síntesis.
Al igual que la alfa-amilasa, las fosforilasas no son capaces de romper más allá de los puntos de ramificación alfa 1-6, de hecho, la ruptura se detiene a los cuatro residuos de glucosa de un punto de ramificación. El proceso desramificador requiere la acción de una segunda enzima llamada "desramificante" (alfa1-4 glucantransferasa), la cual cataliza dos reacciones. En primer lugar, está la actividad transferasa, en la que la enzima elimina tres de los residuos de glucosa restantes y transfiere este trisacárido intacto al extremo de alguna ramificación externa.
A continuación, el residuo de glucosa que queda unido aún a la cadena por un enlace alfa 1-6 se rompe por la actividad alfa 1-6-glucosidasa, que posee la misma enzima desramificadora. Ello da lugar a una molécula de glucosa libre y una ramificación de tres residuos de glucosa con enlaces alfa 1-4, esta ramificación que ha quedado ahora expuesta puede ser atacada por la fosforilasa. El resultado final de la acción de estas dos enzimas es la degradación completa del glucógeno a glucosa 1- fosfato (el producto final de la glucosa).
La importancia de almacenar energía de los hidratos de carbono en forma de un polímero altamente ramificado puede radicar en la necesidad del animal de generar energía de manera muy rápida, tras los estímulos apropiados. La glucógeno fosforilasa ataca los enlaces exoglucosídicos, es decir, rompe de manera secuencial a partir de los extremos no reductores. Cuantos más extremos de este tipo existen en un polímero con mayor rapidez puede movilizarse. Para metabolizarse mediante la glucólisis, la glucosa 1- fosfato producida por la acción de la fosforilasa debe convertirse en glucosa 6-fosfato.
Esta isomerización la lleva a cabo la fosfoglucomutasa. Desde el punto de vista de su mecanismo, esta reacción es similar a la de la fosfoglicerato mutasa, excepto que en la fosfoglucomutasa hay una fosfoserina en vez de una fosfohistidina en la enzima que reacciona con el sustrato.
La serina que lleva el grupo fosfato es excepcionalmente reactiva, como indica el hecho de que la fosfoglucomutasa, como la quimotripsina y otras proteasas de serina, se inhibe de forma irreversible por el diisopropilfluorofosfato. Ambos procesos dan lugar a formas fosforiladas de glucosa,que no pueden salir de las células hepáticas. La conversión de glucosa libre se realiza mediante la acción de la glucosa –6-fosfatasa, que hidroliza la glucosa-6.fosfato a glucosa y ortofosfato. Esta enzima está presente también en el riñón y en el intestino. En cambio, el glucógeno muscular se utiliza principalmente como fuente de glucosa-6-fosfato para el catabolismo en las células musculares. En consecuencia, en el músculo no hay glucosa-6-fosfatasa, como tampoco la hay en el cerebro, que depende casi exclusivamente de la glucosa de la sangre como principal fuente de energía. Ello garantiza que la glucosa-6-fosfato formada a partir del glucógeno no difunda hacia el exterior de estas células, puesto que, como se ha indicado antes, los azúcares fosfato no atraviesan con facilidad las membranas celulares.
Síntesis del Glucógeno Hepático
La síntesis de glucógeno tiene lugar durante la fase posprandial de absorción, cuando la concentración de glucosa en la vena porta es superior a 150 mg/100ml, y en general cerca de 180mg/100ml durante la absorción activa. Se cree que no hay barrera para la entrada libre de glucosa a los hepatocitos; durante dicha fase de absorción, entran pues a las células del hígado grandes cantidades de glucosa.
Este fenómeno inicia la síntesis de la enzima hepática específica de la fosforilación de glucosa llamada glucocinasa. Lo mismo hace la insulina, en tanto que el ayuno o la falta de insulina detienen la síntesis de glucocinasa. Sin embargo, la insulina desencadena un fenómeno de competición por parte de los músculos estriados, pues acelera la entrada de glucosa a las células de éstos, donde interviene en la fabricación de glucógeno. Es probable que, mientras se sintetiza glucocinasa, la hexocinasa inespecífica fosforila la glucosa en el hígado.
Pero el papel en conjunto desempeñado por la hexocinasa es mucho menor que el de la glucocinasa. Ambas enzimas transfieren fosfato del ATP al carbono 6 de la glucosa, pero el producto final (glucosa 6-fosfato) inhibe la hexocinasa. Mientras dura la absorción, la elevada cantidad de glucosa significa un alto nivel de glucocinasa, que forma bastante glucosa 6-fosfato para invertir el equilibrio habitual entre glucosa-1-fosfato y glucosa-6-fosfato, normalmente de 19 a 1, que corresponde a la enzima fosfoglucomutasa. Cuando se ha formado suficiente glucosa 6-fosfato para invertir este ingrediente, se inicia la glucogénesis, apareciendo glucosa 1-fosfato.
Luego la enzima transferasa de uridilo une el trifosfato de uridina a la glucosa-1-fosfato, formando difosfato de uridina y glucosa (UDPG). La unidad glucosilo del UDPG pasa enseguida al glucógeno, al que se une por un enlace alfa-1-4 por acción de la enzima sintetasa de glucógeno (llamada también transglucosilasa UDPG-glucógeno).
En particular, la sintetasa de glucógeno se activa por desfosforilación, mientras que ocurre lo contrario en el caso de la fosforilasa. Tal vez existan relaciones mutuas entre la fosforilación y desfosforilación de estas dos enzimas, de manera que al activarse una, se inactiva otra, y viceversa. La activación de sintetasa de glucógeno aumenta por efecto de la insulina.
La sintetasa de glucógeno fija unidades de glucosilo a las ramas externas del glucógeno, mediante enlaces 1,4 únicamente. Después de añadir de esta manera de 7 a 21 unidades de glucosilo, otra enzima, llamada "de ramificación" (transglucosidasa de amilo 1, 4, 1,6) transfiere algunas de estas unidades y las dispone como ramificaciones, mediante enlaces 1,6 sobre la misma cadena o sobre otra. De esta manera, se obtiene una molécula compacta ramificada; de no ser así, se obtendría una forma alargada, desparramada, parecida a la de un sauce llorón.
Sin embargo, Hers (1964) señala que en el organismo intacto las concentraciones relativas de fosfato inorgánico y de glucosa-1-fosfato de glucosa son tales que la fosforilasa sólo desdobla el glucógeno, y su función de síntesis se traduce mas bien por remodelado de la molécula.
Catabolismo del Glucógeno
La glucogenólisis aumenta en el músculo varios cientos de veces inmediatamente después del comienzo de la contracción. Esto comprende la activación rápida de la fosforilasa causada por la activación rápida de la fosforilasa cinasa por el calcio, la misma señal que inicia la contracción. La fosforilasa cinasa muscular tiene cuatro tipos de subunidades: alfa, beta gamma y delta, en una estructura representada como (alfa-beta gamma-delta).
Las subunidades alfa y beta contienen residuos de serina que son fosforilados por la proteincinasa dependiente de AMPc. La subunidad beta fija 4 iones calcio y es idéntica a la proteína fijadora de calcio, calmodulina. La fijación del calcio activa el sitio catalítico de la subunidad gamma en tanto que la molécula permanece en la configuración b desfosforilada.
Sin embargo, la forma a fosforilada sólo es activada en forma total en presencia de calcio. En un hecho significativo que la calmodulina sea análoga en estructura a la TpC, la proteína fijadora de calcio en el músculo.
Una segunda molécula de calmodulina o de TpC puede interactuar con la fosforilasa cinasa, aumentando la activación. Por lo tanto la activación de la contracción muscular y de la glucogenólisis son realizadas por la misma proteína fijadora de calcio, que asegura su sincronización.
Las enzimas que participan en la glucogenólisis son:
- Fosforilasa: Es la enzima más importante para el desdoblamiento del glucógeno. Rompe el enlace 1,4 de la unidad de glucosilo del extremo de una rama o cadena de glucógeno, y cataliza simultáneamente la transferencia del glucosilo liberado a un fosfato inorgánico. De esta manera, la fosforilasa puede desdoblar casi la tercera parte de la molécula de glucógeno en glucosa 1-fosfato.
Lo que queda de la molécula de glucógeno después de que la fosforilasa ha ejercido su efecto máximo se llama "dextrina límite". La fosforilasa hepática se activa por transfosforilación (del ATP), debida a la enzima cinasa de desfosfofosforilasa, en presencia de magnesio. Esta activación es acelerada varias veces por el monofosfato cíclico de adenosina (AMP, o fosfato de 3,5-ribosa-adenina cíclica).
El AMP se forma a partir del ATP por efecto de la enzima ciclasa de adenilo, que se encuentra en las membranas celulares. El glucágon y la adrenalina triplican la formación de AMP, por lo tanto, activan así la fosforilasa hepática, lo que explica su potente efecto glucogenolítico.
- Fosforilasa del Músculo: Esta enzima difiere de la fosforilasa hepática por varias razones, principalmente porque existe en dos formas, las variedades a y b. La fosforilasa a del músculo (P.M. 495 000) es un dímero de b, y contiene cuatro unidades de fosfato de piridoxal por molécula, en tanto que la variedad b sólo contiene dos. Las dos variedades presentan transformaciones mutuas.
En el músculo en reposo predomina ampliamente la fosforilasa b; se activa y convierte en fosforilasa a por efecto de la cinasa de fosforilasa b, activada a su vez por el AMP cíclico.
Puesto que la adrenalina (pero no el glucágon) aumenta considerablemente la formación de la AMP cíclico en el músculo, esta hormona aumenta la actividad de las fosforilasas del músculo e hígado, mientras que la acción del glucágon sólo se ejerce sobre el hígado.
En reposo, el AMP cíclico del músculo no basta para activar la fosforilasa, pero el ejercicio muscular y la anaerobiosis probablemente aumentan localmente la concentración del adenilato cíclico.
- Enzima de desramificación (glucosidasa de 1,6 –amilo):Puesto que la fosforilasa sólo ataca los enlaces 1,4 glucosídicos, deja de actuar cuando llega a un punto de ramificación. Cori y Larner (1951) dedujeron que la fosforólisis de las principales cadenas externas se detiene a varias unidades glucosílicas de distancia de un punto de ramificación; pero en el caso de las ramas laterales, prosigue hasta que sólo queda la unidad de glucosilo fijada por el enlace 1,6. La molécula de glucógeno "deshojada" o podada por la fosforilasa se llama "dextrina límite".
En este punto, la enzima de desramificación ataca el enlace 1,6 en cuestión, liberando unas moléculas de glucosa por cada punto de ramificación, lo que permite que vuelva a actuar la fosforilasa. En teoría cuando menos, estas intervenciones sucesivas de fosforilasa y enzima de desramificación pueden llevar el glucógeno al estado de cadena basal solamente, lo que se podría llamar el tronco; se puede producir así de 92 a 93% de glucosa 1-.fosfato y de 7 a 8% de glucosa libre.
- Glucotranferasa de oligo:Walker y Whelan ya sospechaban la presencia de esta enzima como contaminante en los preparados de glucosidasa de 1-6 amilo. En diversos análisis efectuados se obtuvieron resultados que hasta la fecha sugieren que la acción de la fosforilasa sobre las cadenas terminales se detiene a cuatro unidades de glucosilo de distancia de un punto de ramificación. En esta etapa (dextrina límite), la mayor parte de las cadenas externas "desprendidas" de la molécula parecen formadas por cuatro unidades alfa- 1,4-glucosilo, a partir de un punto de ramificación. Se cree que la glucotransferasa de oligo- 1,4 ---------1,4, pasa tres de estas unidades al extremo de otra cadena; por consiguiente, la fosforilasa puede volver a actuar sobre la cadena, ya más larga, y la enzima de desramificación puede atacar el enlace 1,6 en el punto de ramificación.
- Alfa amilasas:Olivarría y Torres (1962) demostraron que la alfa-amilasa del hígado podía atacar el glucógeno mediante:
- Producción de oligosacáridos de cadena recta, como maltotriosa y maltotetrosa, a partir de las ramas externas del glucógeno.
- Liberación de sacáridos ramificados y de maltosa, desde el interior de la molécula. Existen varias maltasas (glucosidasas alfa 1,4) para transformar estos productos en glucosa. Sin embargo, todavía se ignora la importancia de la vía alfa-amilasa-oligosacárido maltasa en el catabolismo del glucógeno.
- Glucógeno de lisosomas:Los lisosomas poseen un conjunto de enzimas capaces de hidrolizar prácticamente cualquier componente del citoplasma que contienen entre otras, fosfatasa ácida, RNAasa, DNAasa, catepsina, beta-glucoronidasa, sulfatasa de arilo, beta-N-acetilglucosaminidasa, beta-galactosidasa y alfa-1,4(glucosidasa). La función de esta última enzima en el metabolismo celular normal no se conoce todavía, pero la falta de maltasa ácida de lisosomas en la enfermedad de Pompe tiene como consecuencia el almacenamiento de glucógeno en acúmulos limitados por membranas (lisosomas).
Funciones de las reservas de glucógeno
El glucógeno constituye la principal fuente de energía para la contracción del músculo esquelético. Dado que el hígado obtiene la mayor parte de su energía metabólica de la oxidación de los ácidos grasos, el glucógeno hepático tiene una función muy distinta, como fuente de glucosa sanguínea que se transporta a otros tejidos para su catabolismo.
El hígado actúa fundamentalmente como un "glucostato", sensor de las concentraciones de glucosa sanguínea que ajusta en función de ello la síntesis y degradación de glucógeno; gran parte de esta regulación comporta el control de la glucógeno sintasa y la fosforilasa. Para cumplir esta función, el hígado contiene unas reservas de glucógeno relativamente elevadas, desde un 2 a un 8% del peso del órgano.
En el hígado, la velocidad máxima de síntesis y degradación de glucógeno son aproximadamente iguales, mientras que en el músculo la velocidad máxima de glucogenólisis supera a la síntesis de glucógeno en unas 300 veces.
Aunque la enzimología de la síntesis y degradación del glucógeno es semejante en el hígado y el músculo, el control endocrino del hígado es bastante diferente. Las enzimas difieren también estructuralmente.
Fisiopatologías
Las enfermedades relacionadas con el metabolismo del glucógeno se denominan glucogenosis. Se han descrito deficiencias congénitas de la mayoría de las enzimas o transportadores del metabolismo de glucógeno. En el caso de la fosforilasa, se han descrito deficiencias que afectan a la enzima hepática o muscular ya que se trata de proteínas diferentes. Además, cuando son varios los polipéptidos que forman una enzima , cada subunidad puede estar afectada específicamente.
Ello explica la existencia de formas ligadas al cromosoma X y una forma autosómica de deficiencia de fosforilasa b quinasa. En 1954, Cori inició la numeración de estas enfermedades, de las que actualmente se conocen hasta la IX. La multiplicidad de defectos que se han descrito, demuestra que el glucógeno no es esencial para la vida.
Por otra parte, está claro que las enfermedades debidas a alteraciones enzimáticas diferentes pueden cursar con manifestaciones clínicas similares. Los órganos más afectados por las alteraciones de las enzimas y el metabolismo del glucógeno son el hígado y el músculo esquelético, dado que es en ellos donde se almacena en una mayor proporción.
Si la deficiencia afecta a una enzima hepática (glucogenosis tipos I, III, VI Y VIII) la sintomatología está relacionada con la aparición de hipoglucemia, debido a la incapacidad del hígado para liberar glucosa a partir de glucógeno.
Al mismo tiempo aparece hepatomegalia y los hepatocitos adquieren una apariencia arbórea. También es característico que los pacientes no respondan a la administración de glucagón, como hormona hiperglucemiante.
Los signos y síntomas clínicos aparecen normalmente en estos pacientes entre el mes y el año de vida y los más característicos son: hipoglucemia, hepatomegalia, cara de muñeca, acidosis láctica, hipertrigliceridemia, hipercolesterolemia, pruebas hepáticas anormales y osteoporosis.
Cuando la deficiencia enzimática afecta al músculo (tipos V Y VII), los síntomas clínicos están relacionados con la incapacidad de suministrar combustible metabólico rápido para la contracción muscular.
Los síntomas son débiles y sólo son aparentes en el joven al realizar ejercicios violentos. En otras formas de glucogenosis (tipos II Y IV), los problemas están relacionados con el acúmulo de glucógeno en un compartimiento subcelular anormal (tipo II) o con una estructura anormal (tipo IV).