Amilodosis
| ||||
Amiloidosis. Acumulación en los tejidos de diversas proteínas fibrilares insolubles amiloide en cantidades suficientes para deteriorar la función normal.
Sumario
Etiología
La causa de la producción de amiloide y de su deposición en los tejidos es desconocida. Los mecanismos pueden variar según los diferentes tipos bioquímicos de amiloidosis. Por ejemplo, en la amiloidosis secundaria (v. más adelante) puede existir un defecto en el metabolismo de la proteína precursora (el reactante de fase aguda, amiloide A sérico), mientras que en la amiloidosis hereditaria parece estar presente una variante proteica determinada genéticamente.
Fisiopatología
En la amiloidosis primaria, una población monoclonal de células de la médula ósea produce fragmentos de cadenas ligeras o cadenas ligeras completas que pueden ser procesadas anormalmente para producir amiloide. Al microscopio óptico, el amiloide es una sustancia homogénea sumamente refringente con afinidad por el colorante rojo Congo en tejidos fijados y también in vivo. Al microscopio electrónico, el amiloide está constituido por fibrillas lineales no ramificadas de 100 Å (10 nm); en la difracción de rayos X tiene un patrón beta.
Clasificación
Bioquímicamente se han definido tres tipos principales de amiloide y varias otras formas menos frecuentes. El primer tipo, que tiene una secuencia N-terminal homóloga a una parte de la región variable de una cadena ligera de una inmunoglobulina, se denomina AL y se presenta en la amiloidosis primaria y en la amiloidosis asociada con el mieloma múltiple. El segundo tipo tiene una secuencia N-terminal específica de una proteína no inmunoglobulina denominada proteína AA y se presenta en pacientes con amiloidosis secundaria. El tercer tipo, que se asocia con una polineuropatía amiloide familiar, es generalmente una molécula de transtiretina (prealbúmina) que tiene una sola sustitución de aminoácido.
Se han encontrado otros amiloides hereditarios constituidos por gelsolina mutante en algunas familias, apolipoproteína A-I mutante en varias otras y otras proteínas mutantes en el amiloide hereditario de las arterias cerebrales. En el amiloide asociado con la hemodiálisis crónica, la b2-microglobulina constituye la proteína amiloide. El amiloide asociado con el envejecimiento en la piel y con los órganos endocrinos puede representar otras formas bioquímicas de amiloidosis. El amiloide que se encuentra en las lesiones histopatológicas de la enfermedad de Alzheimer está constituido por proteínas b.
Los análisis químicos relativos a diversas formas de amiloidosis han llevado a una clasificación más perfeccionada. Una proteína singular (una pentraxina) denominada AP (o AP sérica) se asocia universalmente con todas las formas de amiloide y constituye el fundamento de una prueba diagnóstica.
Actualmente se reconocen tres formas clínicas sistémicas principales. La amiloidosis se clasifica como primaria o idiopática (forma AL) cuando no existe una enfermedad asociada, y como secundaria, adquirida o reactiva (forma AA) cuando se asocia con enfermedades crónicas, sean infecciosas (tuberculosis, bronquiectasias, osteomielitis, lepra) o inflamatorias (artritis reumatoide, ileítis granulomatosa). El amiloide se asocia también con el mieloma múltiple (AL), la enfermedad de Hodgkin (AA), otros tumores y con la fiebre mediterránea familiar (AA). La amiloidosis puede acompañar al envejecimiento. El tercer tipo principal aparece en formas familiares no asociadas con otra enfermedad, a menudo con tipos característicos de neuropatía, nefropatía y cardiopatía.
En la amiloidosis primaria (AL) puede haber afectación de corazón, pulmones, piel, lengua, glándula tiroides y tracto intestinal. Los "tumores" amiloides localizados se pueden encontrar en el tracto respiratorio o en otras localizaciones. Con frecuencia se ven afectados órganos parenquimatosos (hígado, bazo, riñón) y el sistema vascular, en especial el corazón.
La amiloidosis secundaria (AA) muestra predilección por bazo, hígado, riñón, glándulas suprarrenales y ganglios linfáticos. Sin embargo, no resulta respetado ningún sistema y la afectación vascular puede ser amplia, aunque es raro que el corazón se vea afectado. El hígado y el bazo suelen estar aumentados de tamaño, ser duros y de consistencia gomosa. Generalmente los riñones están aumentados de tamaño. Los cortes de bazo tienen grandes zonas translúcidas de aspecto céreo donde los cuerpos de Malpigio normales están reemplazados por amiloide pálido, produciendo el bazo en sagú. La amiloidosis hereditaria se caracteriza por una neuropatía periférica sensitiva y motora, a menudo una neuropatía autonómica y amiloide cardiovascular y renal. Puede presentarse un síndrome del túnel carpiano y anomalías del cuerpo vítreo.
El amiloide asociado con ciertos procesos malignos (p. ej., mieloma múltiple) tiene la misma distribución que el amiloide idiopático (AL); en otros tumores malignos, carcinoma medular de tiroides) puede aparecer sólo localmente en asociación con el tumor o las metástasis. El amiloide se encuentra con frecuencia en el páncreas de individuos con diabetes mellitus de inicio en la edad adulta.
Síntomas y signos
Los síntomas y signos son inespecíficos, determinados por el órgano o el sistema afectados, y a menudo enmascarados por la enfermedad subyacente, que puede ser mortal antes de que se sospeche la presencia de amiloidosis. El síndrome nefrótico es la manifestación temprana más llamativa. En las etapas iniciales puede observarse sólo una ligera proteinuria; más tarde aparece el complejo de síntomas característico con anasarca, hipoproteinemia y proteinuria masiva.
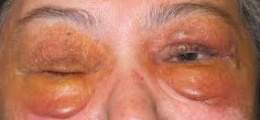
La enfermedad amiloide del hígado produce hepatomegalia, pero rara vez ictericia. Se ha descrito una hepatomegalia masiva (peso del hígado >7 kg). Los resultados de las pruebas de función hepática suelen ser normales, aunque puede observarse una excreción anormal en la prueba de la bromo-sulfoftaleína sódica (que se realiza pocas veces) o elevación de la fosfatasa alcalina. Puede presentarse a veces hipertensión portal con varices esofágicas y ascitis. Las lesiones cutáneas pueden ser de aspecto céreo o translúcidas; puede aparecer una púrpura por amiloidosis de los vasos cutáneos delgados.
La afectación cardíaca es frecuente y puede presentarse en forma de cardiomegalia, insuficiencia cardíaca resistente al tratamiento o alguna de las arritmias frecuentes. En varias familias se ha observado parada auricular.
El amiloide GI puede causar anomalías de la motilidad esofágica, atonía gástrica, alteraciones de la motilidad del intestino delgado y grueso, malabsorción, hemorragia o seudoobstrucción. La macroglosia es frecuente en la amiloidosis primaria y en la relacionada con un mieloma.
La amiloidosis de la glándula tiroides puede dar lugar a un bocio firme, simétrico y no doloroso a la presión, parecido al estruma (tiroiditis) de Hashimoto o de Riedel. En raros casos de mieloma múltiple, la artropatía por amiloide puede parecerse a la artritis reumatoide. La neuropatía periférica, que no es una manifestación inicial rara, es frecuente en algunas amiloidosis familiares y también se produce en algunos casos de amiloidosis primaria o asociada a mieloma.
La afectación pulmonar (sobre todo en las amiloidosis AL) puede caracterizarse por nódulos pulmonares focales, lesiones traqueobronquiales o depósitos alveolares difusos. En varias familias con amiloidosis hereditaria se producen opacidades amiloides en el cuerpo vítreo y deformaciones festoneadas bilaterales de los bordes pupilares.
Diagnóstico
Se sospecha en función de los síntomas y signos descritos anteriormente, pero sólo puede diagnosticarse mediante biopsia. La aspiración de grasa del panículo abdominal y la biopsia de mucosa rectal son las mejores pruebas selectivas. Otros lugares útiles para la biopsia son las encías, la piel, los nervios, el riñón y el hígado. Los cortes de tejido deben teñirse con rojo Congo y observarse con microscopio de polarización para observar la birrefringencia verde característica del amiloide. Para confirmar el diagnóstico de amiloidosis se ha utilizado la proteína AP sérica marcada con isótopos en una prueba gammagráfica.
Pronóstico
El pronóstico depende del éxito del tratamiento de la enfermedad subyacente. Todas las formas de amiloidosis renal tienen un mal pronóstico, pero los pacientes pueden permanecer estables e incluso mejorar con un tratamiento de sostén (p. ej., erradicación de la pielonefritis).
La diálisis y el trasplante renal han mejorado el pronóstico aún más. La amiloidosis asociada con el mieloma múltiple tiene el peor pronóstico; es frecuente la muerte en el curso de un año.
Los tumores amiloides localizados se pueden extirpar sin recurrencias. La amiloidosis miocárdica es la causa más frecuente de la muerte, principalmente debida a las arritmias o a insuficiencia cardíaca refractaria al tratamiento. En las amiloidosis familiares el pronóstico varía en cada miembro de la familia.
Tratamiento
El tratamiento se dirige en primer lugar a la causa subyacente; dicho tratamiento puede detener la evolución de la amiloidosis. El tratamiento de la amiloidosis misma es generalmente sintomático. Se ha realizado trasplante renal en pacientes con amiloide renal; la supervivencia a largo plazo es comparable a la de otras nefropatías, pero la mortalidad es más alta en los años iniciales. El amiloide reaparece con el tiempo en el riñón donado, pero varios receptores han evolucionado bien y han vivido hasta 10 años.
El tratamiento actual de la amiloidosis primaria incluye un programa con prednisona/melfalán o prednisona/melfalán/colchicina. Los ensayos clínicos en curso están comparando estos programas, que han sido ampliados recientemente con trasplantes de células primitivas con un éxito considerable. La digital puede desencadenar arritmias en la enfermedad amiloide cardíaca y debe utilizarse con precaución.
El trasplante de corazón se ha utilizado con éxito en pacientes cuidadosamente seleccionados. Se ha utilizado la colchicina para prevenir los ataques agudos de fiebre mediterránea familiar, y se ha demostrado que los pacientes tratados de ese modo no desarrollan nuevo amiloide y el amiloide establecido disminuye.
Se ha demostrado que en la amiloidosis debida a mutaciones de la transtiretina resulta muy eficaz el trasplante de hígado, que elimina el lugar de síntesis de la proteína mutante.