Ciclooxigenasas
| ||||||
La ciclooxigenasa o COX es una enzima capaz de convertir el ácido araquidónico, que participa en la formación de las membranas celulares, en prostaglandina H2, responsable de muchas funciones fisiológicas, especialmente a nivel muscular. Las COX también son, en parte, responsables de fenómenos inflamatorios. Así, la ciclooxigenasa puede ser contrarrestada por los fármacos antiinflamatorios no esteroideos (AINS), del tipo aspirina o ibuprofeno, que los inhiben.
Es una enzima responsable de la formación de mediadores biológicos importantes llamados prostanoides, que incluye la prostaglandina, la prostaciclina, y los tromboxanos, a partir del ácido araquidónico. La inhibición farmacológica de la ciclooxigenasa alivia los síntomas de la inflamación. Los medicamentos antiinflamatorios no esteroides (AINEs), como el diclofenac y la nimesulida, ejercen sus efectos a través de la inhibición de la ciclooxigenasa.
Sumario
Tipos de ciclooxigenasa
Hay tres tipos de ciclooxigenasa: la ciclooxigenasa-1 (COX-1), la ciclooxigenasa-2 (COX-2) y la Ciclooxigenasa-3 (COX3 las cuales poseen alrededor de 600 aminoácidos cada una. La función de la COX-1 es la de regular la proliferación de las células normales o neoplásticamente transformadas. La COX-1 está presente en todos los tejidos especialmente en el riñón y el tubo gastrointestinal y participa en la producción de prostaglandinas que intervienen en procesos fisiológicos tales como: protección del epitelio gástrico, mantenimiento del flujo renal, la agregación plaquetaria. La función de la COX-2 es la de mediar en los procesos de inflamación y en la señalización por prostanoides.
Ciclooxigenasa 1 (COX1): Tiene como función la regulación de la proliferación de las células normales o neoplásticamente transformadas. La COX-1 es constitutiva en todos los tejidos especialmente en riñón y el tubo gastrointestinal. Participa en la producción de prostaglandinas que intervienen en procesos fisiológicos tales como: protección del epitelio gástrico, mantenimiento del flujo renal, la agregación plaquetaria, la migración de neutrófilos y también se expresan en el endotelio vascular. Se encuentra asociada al retículo endoplásmico de las células. Se han descrito dos pequeñas isoformas (PCOX-1a y PCOX-1b) de la COX-1. Estas proteínas derivan de un splicing alternativo del RNA mensajero del gen de la COX-1.
Ciclooxigenasa 2 (COX2): Tiene como función mediar en los procesos de inflamación y en la señalización por prostanoides. La COX-2 se expresa tras inducción inflamatoria, aunque es constitutiva en SNC y riñón. La expresión de la COX-2 es provocada por diversos mediadores inflamatorios (interferón γ, factor de necrosis tumoral α, interleucina 1, factores de crecimiento, etc.) en diversas células (monocitos, macrófagos, células endoteliales, sinoviocitos, condrocitos y osteoblastos) y tejidos (aparato reproductor, sistema nervioso central, estómago, riñón, pulmón y ciertos tejidos afectados por procesos neoplásicos). Se encuentra asociada a la envoltura nuclear de las células.
Ciclooxigenasa 3 (COX3): Isoforma de la COX1, se ha observado en humanos una abundante expresión del RNA mensajero de la misma en el cortex cerebral y el corazón. La inhibición de esta isoforma podría estar relacionada con el efecto antipirético de muchos AINEs.
Formulación química
Araquidonato + AH2 + 2 O2
Prostaglandina-H2 + A + H2O
Estructura y Mecanismo de la Ciclooxigenasa
Las prostaglandinas son potentes mediadores de la inflamación. El primer paso de la síntesis de prostaglandinas a partir de ácido araquidónico es una dioxigenación del araquidonato que da lugar a PGG2, seguida de una reacción de reducción a PGH2. Ambas reacciones son catalizadas por la enzima ciclooxigenasa (COX), también conocida como Prostaglandina G/H sintetasa, que aparece en la membrana como un dímero. La actividad de esta enzima resulta inhibida por un grupo de fármacos conocidos como AntiInflamatorios No Esteroideos o AINEs.
Existen dos isoformas de COX en animales: COX-1 que mantiene una producción fisiológica normal de prostaglandinas, y COX-2, que es inducida por citoquinas, mitógenos y endotoxinas en células inflamatorias, y que es la responsable de la producción de prostaglandinas en el proceso inflamatorio. Las dos formas guardan un alto grado de homología entre ellas, como podrás comprobar al observar el resultado de un alineamiento múltiple de secuencias.
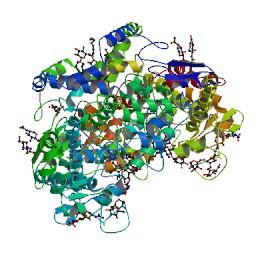
Estructura de la enzima
La estructura de la COX-1 procedente de vesículas seminales de carnero se pudo resolver mediante cristalografía de rayos X en 1994. En el cristal aparece como un dímero, y en cada uno de los monómeros se pueden distinguir 3 dominios:
El primer dominio (residuos 33-72) forma un pequeño módulo compacto que es similar al factor de crecimiento epidérmico.
El segundo dominio (residuos 73-116) forma una espiral en el sentido de las agujas del reloj de cuatro segmentos alfa-helicoidales a lo largo de una cara de la proteína . Este es el dominio de unión a la membrana. Los segmentos helicoidales son anfipáticos, con la mayor parte de sus residuos hidrofóbicos orientados hacia fuera de la proteína, donde pueden interaccionar con una de las capas lipídicas de la membrana (proteína monotópica).
El tercero (residuos 117-583) es el dominio catalítico, una estructura globular que contiene los centros activos ciclooxigenasa y peroxidasa.
El centro activo peroxidasa incluye un grupo hemo El Fe3+ que se encuentra en el centro de este grupo hemo está coordinado por His-388 y por His-207. El centro activo ciclooxigenasa se encuentra al fondo de un estrecho túnel o canal hidrofóbico. Tres de las hélices alfa del dominio de unión a la membrana están en la entrada de este túnel. Las paredes del túnel están definidas por cuatro hélices alfa, formadas por los residuos 106-123, 325-353, 379-384 y 520-535. Al fondo de este canal hidrofóbico se encuentra un importante residuo catalítico, la Tyr-385. La actividad peroxidasa hemo-dependiente está implicada en la formación de un radical Tyr-385, que es necesario para desempeñar la actividad ciclooxigenasa.
- La aspirina inactiva la COX de forma irreversible al acetilar el residuo de Ser 530 y dejar el resto de salicilato en el interior del túnel.
- El ibuprofeno actúa compitiendo de modo reversible por el sitio de unión al substrato en el túnel.
- Flurbiprofeno e indometacina son miembros de una tercera clase de inhibidores que producen una inhibición lenta, tiempo-dependiente COX-1 y COX-2. En estos complejos es de destacar la interacción electrostática entre el grupo carboxilato de los inhibidores (cargado negativamente) y la Arg-120 (cargada positivamente) presente en el canal, y que supuestamente sirve para atraer al sustrato de ácido araquidónico durante la catálisis. La cavidad donde se unen estos inhibidores tradicionales a la COX-1 está limitada por la cadena lateral de la isoleucina-523.
- La presencia de una valina en la COX-2 en la posición ocupada por Ile-523 en la COX-1 permite a algunos inhibidores (como nimesulida y SC-558) acceder a una cavidad adyacente al sitio activo y establecer interacciones adicionales con otros residuos de la enzima, por ejemplo la arginina que sustituye a la histidina en la posición 513. De este modo actúan como inhibidores débiles de COX-1 pero inhiben la COX-2 de forma lenta y tiempo-dependiente. Con esta inhibición selectiva de COX-2 se espera que este tipo de fármacos sean capaces de bloquear la inflamación sin dar lugar a las toxicidades gastrointestinal y renal características de los AINEs tradicionales que probablemente son el resultado de la inhibición de la COX-1.