Citogenética humana
| ||||||
Citogenética Humana. La citogenética clínica es la rama de la genética médica que tiene por objeto el estudio del número, la estructura y la función de los cromosomas. Permite detectar anomalías cromosómicas causantes del retardo mental (RM), Malformaciones Congénitas Múltiples (MCM) y trastornos hematooncológicos. Se realiza a partir de cromosomas obtenidos de un cultivo de linfocitos de sangre periférica, pero puede también realizarse en otros tejidos.
Sumario
Historia
En 1921 Theophilus S. Painter demostró la presencia del cromosoma Y en preparaciones obtenidas a partir de testículo. Determinó que el total de cromosomas eran 48. Luego, en 1956, Tjio de Indomesia y Albert Levan de Suecia determinaron que en realidad el número de cromosomas en la especie humana no eran 48, sino 46. Más adelante, Ford y Hamerton confirmaron esta tesis. Este hallazgo fue determinante en el comienzo de la citogenética humana. A partir de entonces muchos científicos la aplicaron al estudio de la correlación genotipo-fenotipo.
En 1959, Jeróme Lejeune, médico de la clínica des Maladies Infantiles del Hôpital Necker-Enfants Malades de París, descubrió que la trisomía 21 era la causa del Síndrome de Down. Lejeune demostró también que la deleción del brazo corto del cromosoma 5 se asociaba con el Síndrome del Grito de Gato (Cri du Chat).
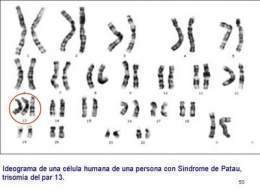
En 1960 se destacan otros tres acontecimientos en el ámbito de la citogenética. Klaus Patau descubre la trisomía D: 47,XX,+13, una anomalía congénita denominada también Síndrome de Patau, que consiste en la presencia de un cromosoma 13 suplementario, en lugar de las dos copias normales. El paciente con este tipo de trastorno genético se caracteriza por presentar múltiples alteraciones graves en órganos y sistemas vitales. Ese mismo año John H. Edwards en la Universidad de Wisconsin, descubre la trisomía 18, anomalía cromosómica rara, caracterizada por la presencia de un cromosoma adicional en el par 18, que responde al cariotipo 47, XX,+18. En el campo de la hematooncología, los científicos Peter Nowel y David Hungerford descubrieron el cromosoma Filadelfia, primera anomalía congénita adquirida (no constitucional) asociada a la leucemia mieloide crónica. Trece años después, Janet D. Rowley demostró que se producía como consecuencia de la traslocación genética 9;22. Posteriormente se han identificado innumerables anomalías congénitas asociadas a diferentes tipos de leucemias y linfomas.
Desde 1959 hasta 1963 se demuestran aneuploidías cromosómicas resultado de anomalías en los cromosomas sexuales. Tal es el caso de:
- Síndrome de Turner: ocurre en las mujeres. A las células les falta todo o parte de uno de los cromosomas X. Fue descubierto por el Dr Henry Turner.
- Síndrome de Klinefelter: es un cuadro que ocurre entre los hombres que tienen un cromosoma X adicional en la mayoría de sus células, por lo que su dotación genética sería entonces XXY.
- Síndrome Triple X: se presenta en las mujeres que poseen un cromosoma X extra en cada célula, por lo que su dotación genética sería entonces XXX. Este síndrome no es hereditario.
Técnicas de bandeamiento
Otro acontecimiento importante en la historia de la citogenética fue la introducción de las técnicas de bandeamiento por Caspersson y colaboradores, lo cual permitió una adecuada identificación de cromosomas normales y de reordenamientos cromosómicos de diversa naturaleza en plantas, animales y humanos. En el caso de los humanos el bandeamiento permite diferenciar y caracterizar un mayor número de nuevos síndromes de malformación y retardo mental congénitos. El gran desarrollo experimentado por los métodos de bandeo, llevó a la necesidad de estandarizar la información citogenética obtenida. En 1971 se realiza la Conferencia de París donde se establece un Sistema Internacional de Nomenclatura para los cromosomas humanos en base a su patrón de bandas G. Estas normas, conocidas como Sistema Internacional de Nomenclatura Cromosómica (ISCN, International System of Chromosome Nomenclature) se han ido actualizando en los años sucesivos.
A continuación se muestran algunas:
| Banda | Método | Características |
|---|---|---|
| Q | Tinción con quinacrina. Se examina con microscopio de luz fluorescente y se ven bandas brillantes en distintas intensidades. Las bandas más brillantes se corresponden con las G+. | Bandas fluorescentes brillantes. |
| G | Tinción con Giemsa, previo tratamiento controlado con tripsina, que degrada las proteínas y produce bandas claras y oscuras. A las oscuras se les llama G+. | Las bandas G oscuras corresponden a las Q brillantes. |
| R | Varias técnicas. Tinción con Giemsa previo tratamiento con calor. El bandeo R es el reverso del bandeo G. | Patrón inverso al de las Q y G, útiles para definir los extremos de los cromosomas. |
| I | Varias técnicas | Resaltan las regiones teloméricas. |
| C | Extracción de DNA/proteínas, tinción con Giemsa o fluorocromos (actinomicina D o cromomicina) y tratamiento previo con calor o álcalis. | Resaltan las regiones centroméricas. |
| I | Varias técnicas | Resaltan las regiones teloméricas. |
| NOR | Tinción con plata | Tiñen las regiones organizadoras del nucléolo (acrocéntricos en el hombre). |
Otra técnicas
- Hibridación in situ fluorescente (FISH): Determinar la presencia, número de copias y localización de secuencias de ADN. Su costo no es demasiado elevado, es rápida y sencilla. Se aplica a células en interfase y en división. Solo es informativa de la secuencia que se desea investigar. Fue desarrollada por Gall y Pardue en 1969 con sondas radioactivas (fragmentos de ADN), que posteriormente fueron reemplazadas por sondas marcadas con fluorocromos (FISH)
- hibridación in situ fluorescente multicolor:
- M-FISH): Detecta rearreglos cromosómicos complejos que involucran más de un cromosoma e identifica cromosomas marcadores. Pesquisa de todo el genoma. Clarifica rearreglos cromosómicos complejos. Es laboriosa y de alto costo. Requiere células en división y de muy buena calidad No detecta intracromosómicas.
- Cariotipo espectral o técnica SKY:Es el análisis de todos los cromosomas de un organismo simultáneamente en el cual cada uno de ellos se encuentra marcado con un color diferente. Esta técnica es útil para identificar cambios en la morfología de los cromosomas. Es útil para comparar e identificar mutaciones o anormalidades en los cromosomas.
- Array CGH (aCGH): Detecta pérdidas y ganancias de secuencias de ADN. Pesquisa de todo el genoma. No necesita células en división. Tanto el equipamiento como los reactivos son costosos. Las anomalías congénitas que se detectan deben ser confirmadas por FISH. No detecta AC balanceadas. Los cromosomas metafásicos son reemplazados por una matriz o array de miles de clones que contienen segmentos del genoma humano.
Síndromes producidos por microdeleciones
- Síndrome de Williams
- Síndrome Miller Dieker
- Síndrome de Prader-Willi
- Síndrome de Angelman
- Síndrome de Smith Magenis
- Síndrome de Di George
Áreas en Medicina a las que aporta la Citogenética
- Neonatología
- Pediatría
- Urología
- Cardiología
- Psiquiatría
- Hematología
- Neurología
- Ginecobstetricia
- Medicina Fetal
- Endocrinología
- Oncología
Fuentes
- Síndrome de Turner
- El estudio de los cromosomas humanos
- Una saga citogenética:El descubrimiento de los métodos de bandeo cromosómico. Significado y proyección bio-médica
- Rol de la citogenética en pediatría
- Utilidad de la citogenética en la medicina actual.Visión histórica y aplicación
- Citogenética y enfermedad
- Síndrome de Klinefelter