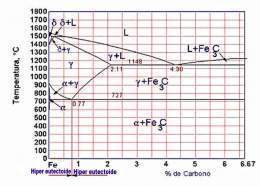
Diagrama hierro carbono
| ||||
Diagrama hierro(Fe) carbono(C): También llamado de equilibrio o de fases Fe-C se emplea para la representación de las transformaciones que sufren los aceros al carbono con la temperatura, admitiendo que el calentamiento (o enfriamiento) de la mezcla se realiza muy lentamente de modo que los procesos de difusión (homogeneización) tienen tiempo para completarse.
Sumario
Orígen
El estado actual del diagrama de equilibrio de las aleacioneshierro-carbono fue establecido como resultado de las investigaciones hechas por varios científicos. La elaboración de este diagrama fue empezada por D. Chernov, quien estableció en 1968 los puntos críticos del acero.
Más tarde volvió a estudiar reiteradamente este diagrama. N. Gutovski, M. Wittorft, Roberts Austen, Roozebomhicieron una gran aportación al estudio de este diagrama. Los últimos datos acerca del diagrama están expuestos en las obras de I. Kornilov.
Generalidades del diagrama Fe-C
Las aleaciones hierro-carbono pertenecen al tipo de aleaciones que forman una composición química. El carbono se puede encontrar en las aleaciones hierro-carbono, tanto en estado ligado (Fe3C), como en estado libre (C, es decir, grafito), por eso, el diagrama comprende dos sistemas:
- Fe-Fe3C(metalestable): Este sistema está representado en el diagrama con líneas llenas gruesas y comprende aceros y fundiciones blancas, o sea, las aleaciones con el carbono ligado, sin carbono libre (grafito).
- Fe-C (estable): En el diagrama se representa con líneas punteadas; este sistema expone el esquema de formación de las estructuras en las fundiciones grises y atruchadas donde el carbono se encuentra total o parcialmente en estado libre (grafito).
Para estudiar las transformaciones que tienen lugar en aceros y fundiciones blancas se emplea el diagrama Fe-Fe3C, y para estudiar fundiciones grises, ambos diagramas (Fe-Fe3C y Fe-C).
La temperatura a que tienen lugar los cambios alotrópicos en el hierro está influida por elementos de aleación, de los cuales el más importante es el carbono. Esta la parte entre hierro puro y un compuesto intersticial, carburo de hierro, que contiene 6.67 % de carbono por peso; por tanto, esta porción se llamará diagrama de equilibrio hierro - carburo de hierro. Este no es un verdadero diagrama de equilibrio, pues el equilibrio implica que no hay cambio de fase con el tiempo; sin embargo, es un hecho que el compuesto carburo de hierro se descompondrá en hierro y carbono (grafito).
Las reacciones eutéticas y eutectoides difieren entre sí, en más de un aspecto importante. Las reacciones eutéticas implican el paso de una fase líquida a dos fases sólidas mientras que las reacciones eutectoides se efectúa totalmente dentro del estado sólido.
Fases y constituyentes
El hierro puro presenta tres estados alotrópicos a medida que se incrementa la temperatura desde la temperatura ambiente:
- Hasta los 911 °C (temperatura crítica AC3), el hierro ordinario, cristaliza en el sistema cúbico de cuerpo centrado y recibe la denominación de hierro α o ferrita.
Es un material dúctil y maleable responsable de la buena forjabilidad de la aleaciones con bajo contenido en carbono y esferromagnético hasta los 770 °C (temperatura de Curie a la que pierde dicha cualidad; se suele llamar también AC2). La ferrita puede disolver pequeñas cantidades de carbono.
- Entre 911 y 1400 °C cristaliza en el sistema cúbico de caras centradas y recibe la denominación de hierro γ o austenita.
Dada su mayor compacidad la austenita se deforma con mayor facilidad y es paramagnética.
- Entre 1400 y 1538 °C cristaliza de nuevo en el sistema cúbico de cuerpo centrado y recibe la denominación de hierro δ
que es en esencia el mismo hierro alfa pero con parámetro de red mayor por efecto de la temperatura.
A mayor temperatura el hierro se encuentra en estado líquido. Si se añade carbono al hierro, sus átomos podrían situarse simplemente en los instersticios de la red cristalina de éste último; sin embargo en los aceros aparece combinado formando carburo de hierro (Fe3C), es decir, un compuesto químico definido y que recibe la denominación de cementita de modo que los aceros al carbono están constituidos realmente por ferrita y cementita.
Además de éstos, existen otros dos constituyentes, la ledeburita y la perlita. La primera es el nombre que se da a la composición eutética sólida; se presenta únicamente en el hierro colado y, después de la transformación que se lleva a cabo al enfriarse a la temperatura ambiente, adquiere un aspecto moteado. La lebedurita transformada consiste en colonias de perlita en una red continua (llamada matriz) de cementita.
La perlita es un constituyente muy importante que se encuentra tanto en el acero como en el hierro colado. La perlita tiene valores de dureza y ductilidad intermedios a los de la ferrita y la cementita.
Otros constituyentes
Las texturas básicas descritas (perlíticas) son las obtenidas enfriando lentamente aceros al carbono, sin embargo modificando las condiciones de enfriamiento (base de los tratamientos térmicos) es posible obtener estructuras cristalinas diferentes:
- La martensita es el constituyente típico de los aceros templados y se obtiene de forma casi instantánea al enfriar rápidamente la austenita. Es una solución sobresaturada de carbono en hierro alfa con tendencia, cuanto mayor es el carbono, a la sustitución de la estructura cúbica centrada en el cuerpo por tetragonal centrada en el cuerpo. Tras la cementita (y los carburos de otros metales) es el constituyente más duro de los aceros.
- Velocidades intermedias de enfriamiento dan lugar a la bainita, estructura similar a la perlita formada por agujas de ferrita y cementita pero de mayor ductilidad y resistencia que aquélla.
- También se puede obtener austenita por enfriamiento rápido de aleaciones con elementos gammágenos (que favorecen la estabilidad del hierro γ) como el níquel y el manganeso, tal es el caso por ejemplo de losaceros inoxidables austeníticos.
Antaño se identificaron también la sorbita y la troostita que han resultado ser en realidad perlitas de muy pequeña distancia interlaminar por lo que dichas denominaciones han caído en desuso.
Transformación de la austenita
El diagrama de fases Fe-C muestra dos composiciones singulares
Eutéctico
Composición para la cual el punto de fusión es mínimo que se denomina ledeburita y contiene un 4,3% de carbono (64,5 % de cementita). La ledeburita aparece entre los constituyentes de la aleación cuando el contenido en carbono supera el 2% (región del diagrama no mostrada) y es la responsable de la mala forjabilidad de la aleación marcando la frontera entre los aceros con menos del 2% de C (forjables) y las fundiciones con porcentajes de carbono superiores (no forjables y fabricadas por moldeo).
De este modo se observa que por encima de latemperatura crítica A3[1] los aceros están constituidos sólo por austenita, una solución sólida de carbono en hierro γ y su microestructura en condiciones de enfriamiento lento dependerá por tanto de las transformaciones que sufra ésta.
Eutectoide
Un eutectoide en la zona de los aceros, equivalente al eutéctico pero en estado sólido, donde la temperatura de transformación de la austenita es mínima. El eutectoide contiene un 0,77 %C (13,5% de cementita) y se denomina perlita. Está constituido por capas alternas de ferrita y cementita, siendo sus propiedades mecánicas intermedias entre las de la ferrita y la cementita.
La existencia del eutectoide permite distinguir dos tipos de aleaciones de acero:
- Aceros hipoeutectoides (< 0,77% C): Al enfriarse por debajo de la temperatura crítica A3 comienza a precipitar la ferrita entre los granos (cristales) de austenita y al alcanzar la temperatura crítica A1 la austenita restante se transforma en perlita. Se obtiene por tanto a temperatura ambiente una estructura de cristales de perlita embebidos en una matriz de ferrita.
- Aceros hipereutectoides (>0,77% C): Al enfriarse por debajo de la temperatura crítica se precipita el carburo de hierro resultando a temperatura ambiente cristales de perlita embebidos en una matriz de cementita.