Heptóxido de Dicloro
| ||||||
Heptóxido dicloro. Es el compuesto químico con la fórmula Cl2O7. Este óxido de cloro es el anhídrido de ácido perclórico.
Sumario
Origen
Es producida por la destilación cuidadosa de ácido perclórico en presencia de agente deshidratante pentóxido de fósforo:
2 HClO4 + P4O10=Cl2O7 + H2P4O11
El óxido de cloro puede eliminarse por destilación de la mezcla. También se puede formar por la iluminación a las mezclas de cloro y ozono. Poco a poco se hidroliza de nuevo a ácido perclórico, que también es peligroso cuando anhidro.
Estructura
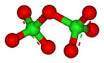
El Cl2O7
es una molécula endotérmica, lo que significa que es intrínsecamente inestable.
2 Cl2O7= 2 Cl2 + 7 O2
El Cl2O7
está doblado con un ángulo de Cl-O-Cl de 118,6 dando la molécula C2 de simetría. Las distancias Cl-O terminales son 1.709 y los cl = S distancias son 1.405. En este compuesto, cloro existe en su estado de oxidación formal más alto de 7, aunque la unión en esta molécula es significativamente covalente.
Propiedades Químicas
Heptóxido dicloro reacciona con aminas primarias y secundarias en solución de tetracloruro de carbono para producir N-perchloryls:
2 RNH2 + Cl2O7= 2 RNHClO3 + H2O
2 R2NH + Cl2O7= 2 R2NClO3 + H2O
También reacciona con alquenos para dar percloratos de alquilo. Por ejemplo, reacciona con propeno en una solución de tetracloruro de carbono para producir perclorato de isopropilo y perclorato de 1-cloro-2-propilo. Heptóxido dicloro es un óxido fuertemente ácida, y en la solución que forma un equilibrio con ácido perclórico.
Medidas de Seguridad
A pesar de que es el óxido de cloro más estable, Cl2O7 es un oxidante fuerte, así como un explosivo que pueda ser imputado con llama o un choque mecánico, o por el contacto con yodo. Sin embargo, es menos fuertemente oxidante de los otros óxidos de cloro, y no ataca azufre, fósforo, o de papel cuando está frío. Tiene los mismos efectos en el cuerpo humano como cloro elemental, y requiere las mismas precauciones.
Enlaces externos
Fuentes
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- IUPAC Gold Book. Compendium of Chemical Terminology. 2a. ed. (1997). Versión en línea: (2006-) "enantiomer"
- IUPAC Gold Book. Compendium of Chemical Terminology, 2ª ed. (1997). Versión en línea: (2006-) "enantiomerically pure (enantiopure)"
- Tratado de Química Orgánica: Tomo 1 (1ª parte). Química Orgánica sistemática. F. Klages. Editorial Reverté, 1968. ISBN: 8429173145. Pág. 21
- Nomenclatura D-L. Curso de biomoléculas. Juan Manuel González Mañas. Universidad del País Vasco.