Inmunodeficiencia con hiper-IgM
| ||||
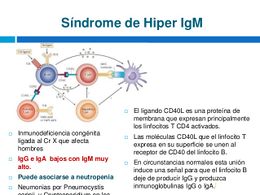
Inmunodeficiencia con hiper-IgM. El Síndrome de Hiper-IgM (SHIM) es una inmunodeficiencia primaria congénita poco frecuente, caracterizada por infecciones recurrentes y niveles plasmáticos normales o aumentados de inmunoglobulina M (IgM) y niveles disminuidos de IgG, IgA e IgE. Esta enfermedad se hereda típicamente como un rasgo genético recesivo ligado al cromosoma X (XSHIM). La causa del XSHIM es un defecto molecular en el gen que codifica para el ligando del CD40 (CD40L), molécula presente normalmente en los linfocitos T activados, imprescindible para la diferenciación y cambio de isotipo de inmunoglobulinas (Igs) en los linfocitos B.
Las manifestaciones clínicas del SHIM se inician generalmente durante el primer o segundo año de vida. Es frecuente observar infecciones recurrentes de las vías respiratorias altas y bajas de etiología mayoritariamente bacteriana, aunque existe cierta predisposición a presentar neumonías por Pneumocystis carinii. Otras características clínicas de estos individuos son la presencia de fenómenos autoinmunes, neutropenia, diarrea crónica, hepatoesplenomegalia y predisposición al desarrollo de neoplasias de estirpe linfoide (leucemias y linfomas). El presente caso describe un paciente con diagnóstico clínico y molecular de XSHIM quien presentó colangitis esclerosante y neoplasia vesicular durante su enfermedad.
Sumario
Definición
Los pacientes con el Síndrome Hiper IgM ligado al X (XHIGM) tienen un defecto o deficiencia de una proteína que se encuentra en la superficie de los linfocitos T. La proteína afectada se llama “ligando CD40” y se encuentra formada por un gen del cromosoma X. Por lo tanto, esta enfermedad de inmunodeficiencia primaria se hereda como un rasgo recesivo ligado al X y se encuentra por lo general solo en niños varones. Como consecuencia de la deficiencia de ligando CD40, los linfocitos T afectados del paciente no pueden instruir a los linfocitos B para que cambien la producción de gammaglobulinas de IgM a IgG e IgA. Como resultado, los pacientes con esta enfermedad de inmunodeficiencia primaria tienen niveles reducidos de IgG e IgA del suero y un nivel normal o elevado de IgM. Además, ya que el ligando CD40 es importante para otras funciones de los linfocitos T, tienen también un defecto en algunas de las funciones protectivas de sus linfocitos T. Se ha observado una enfermedad parecida al síndrome XHIGM en mujeres y algunos hombres en los que el gen ligando CD40 es normal. Las bases moleculares precisas para estas otras formas del síndrome Hiper IgM están siendo estudiadas y recientemente se han identificado varios defectos.
Diagnóstico
El diagnóstico del Síndrome Hiper IgM ligado al X debe ser considerado en cualquier niño que presente hipogammaglobulinemia caracterizado por un nivel bajo o ausente de IgG e IgA y un nivel normal o elevado de IgM. Un hallazgo característico es la falla de las células T activadas de expresar el ligando CD40. Sin embargo, algunos pacientes con Inmunodeficiencia Común Variable pueden tener una expresión marcadamente deprimida de ligando CD40, mientras que el gen ligando CD40 es perfectamente normal. Por lo tanto, el diagnóstico final del síndrome XHIGM depende de la identificación de una mutación que afecta al gen ligando CD40. Este tipo de análisis de ADN puede ser realizado en varios laboratorios especializados. .
Cuadro clínico
La mayoría de los pacientes con el síndrome Hiper IgM ligado al x (XHIGM por sus siglas en inglés) manifiestan síntomas clínicos durante el primer o segundo año de vida. Su problema más común es un aumento en la susceptibilidad a infecciones. Las infecciones más comunes son las infecciones inferiores y superiores del tracto respiratorio. Los agentes infecciosos más frecuentes son las bacterias. Sin embargo, una variedad de otros microorganismos pueden también provocar infecciones graves. Por ejemplo, la Neumonía pneumocistis carinii es relativamente común durante los primeros meses e vida y su presencia puede ser la primera indicación que un niño tiene el síndrome XHIGM. Las infecciones pulmonares pueden ser también causadas por virus tales como el Citomegalovirus y hongos como el Criptococo. Las quejas gastrointestinales, más comúnmente la diarrea y malabsorción, también han sido reportadas en algunos pacientes.
Uno de los principales organismos que provocan síntomas gastrointestinales es el Criptosporidio que puede causar colangitis esclerosante, una enfermedad grave del hígado. Aproximadamente la mitad de los pacientes con el síndrome XHIGM manifiestan neutropenia (recuento bajo de glóbulos blancos en sangre) ya sea transitoria o persistente. La causa de la neutropenia es desconocida, aunque la mayoría de los pacientes responden al tratamiento con el factor estimulante de colonias, G-CSF. La neutropenia es comúnmente asociada con úlceras bucales, proctitis (inflamación del recto) e infecciones de la piel. El agrandamiento de los nódulos linfáticos se observa con mayor frecuencia en pacientes con el síndrome XHIGM que en la mayoría de las enfermedades de inmunodeficiencia primarias. Como resultado, los pacientes presentan de manera común anginas agrandadas, bazo grande y nódulos linfáticos e hígado agrandados. Los trastornos autoinmunes pueden también ocurrir en pacientes con el síndrome XHIGM. Sus manifestaciones pueden incluir artritis crónica, recuento bajo de plaquetas (trombocitopenia), anemia hemolítica, hipotiroidismo y enfermedad del riñón.
Tratamiento
Ya que los pacientes con el síndrome Hiper IgM ligado al X (XHIGM) tienen una severa deficiencia de IgG, las infusiones regulares de IVIG cada 3 o 4 semanas son efectivas en disminuir la cantidad de infecciones (véase el capítulo de Terapia Médica Específica). Las infusiones regulares de IVIG reemplazan el IgG faltante y en muchas ocasiones resultan también en una reducción o normalización del nivel IgM del suero.
Ya que los pacientes con el Síndrome XHIGM presentan también una marcada susceptibilidad a la Neumonía pneumocistis carinii, es importante iniciar tratamiento profiláctico para la neumonía pneumocistis carinii iniciando a los infantes afectados en profilaxis con trimetoprima-sulfametoxazola (Bactrim, Septra) tan pronto como el diagnóstico del síndrome XHIGM se efectúe. Algunas veces, la neutropenia puede mejorar durante el tratamiento con IVIG. Los pacientes con neutropenia persistente pueden responder también a la terapia de factorestimulante de colonias de granulocitos. (G-CSF). Sin embargo, el tratamiento con G-CSF es únicamente necesario en ciertos pacientes y el tratamiento a largo plazo con G-CSF no es recomendado. Los niños con XHIGM, al igual que otros pacientes con enfermedades de inmunodeficiencia primarias, no deben recibir vacunas con virus vivos ya que existe una posibilidad remota que el indicio de virus en la vacuna pueda causar enfermedades. Es también importante reducir la posibilidad de contaminación del agua para beber con criptosporidio ya que la exposición a este organismo puede provocar síntomas gastrointestinales graves y enfermedad crónica del hígado.
La familia debe ser proactiva y comunicarse con las autoridades responsables del suministro local de agua y preguntar sí el agua es segura y ha sido analizada para el criptosporidio. Ya que los pacientes con síndrome de XHIGM tienen defectos en la función de los linfocitos T además de la hipogammaglobulinemia, el tratamiento con IVIG puede no protegerlos por completo contra todas las infecciones. Por lo tanto, en los últimos años se han apoyado los transplantes de médula ósea y de células madre del cordón umbilical. Si existen hermanos del los mismos padres que se encuentren sanos, se deben examinar los tejidos de toda la familia, incluyendo al paciente y a los donadores potenciales para determinar si existe un hermano con HLA idéntico que pudiera servir como donador del transplante de médula ósea. Más de una docena de pacientes con XHIGM han recibido transplantes de médula ósea de hermanos con HLA idéntico con gran éxito. Es por esto, que una cura permanente para este trastorno es posible.
El transplante de células madre del cordón umbilical, compatibles total o parcialmente, ha sido efectuado también con éxito, resultando en una reconstrucción inmune completa. Esta estrategia es especialmente prometedora si no existe un hermano donador compatible. Los transplantes de donadores compatibles no relacionados (MUD) son casi tan exitosos como los transplantes de hermanos compatibles, especialmente si son realizados cuando el receptor es joven (< 8 años). Ya que los pacientes con XHIGM tienen reacciones de importancia de las células T ante los transplantes de órganos, incluyendo el transplante de médula ósea, se requieren bajas dosis de radiación o medicinas inmunosupresoras.
Herencia
El síndrome Hiper IgM ligado al X (XHIGM) es heredado como un trastorno recesivo ligado al X. Por lo tanto, sólo los niños pueden ser afectados. Véase el capítulo de Herencia para información más completa acerca de cómo los trastornos recesivos ligados al X son transmitidos de generación en generación. Ya que esta es una enfermedad heredada, transmitida como un rasgo recesivo ligado al X, pueden existir hermanos o tíos maternos (hermanos de la mamá) que presenten hallazgos cínicos similares. Sin embargo, como en otros trastornos ligados al X, puede que no existan otros miembros de la familia afectados. Si se conoce la mutación precisa del gen para el ligando CD40 en una familia dada, y si el feto es masculino, es posible realizar diagnóstico prenatal. De la misma forma, las mujeres de la familia pueden ser examinadas para ver si son portadoras de la mutación y por lo tanto si se encuentran en riesgo de tener un hijo afectado.
Expectativas
Aunque los pacientes con el síndrome Hiper IgM ligado al X tienen defectos en la producción tanto de IgG como de IgM y algunos aspectos de las funciones de los linfocitos T, existe un número de terapias efectivas lo que permite que estos niños crezcan y se conviertan en adultos productivos y felices.
Caso clínico
Varón de 15 años con antecedentes de recién nacido de término adecuado para edad gestacional y tres hermanos sanos sin antecedentes familiares de relevancia. Fue hospitalizado por primera vez al año y 9 meses de edad por sepsis a germen desconocido y endocarditis bacteriana subaguda. Dos meses después, presentó un absceso bilateral de caderas, que requirió drenaje quirúrgico. Adicionalmente, la madre refiere que el niño presentó, durante los primeros 2 años de vida, abscesos recurrentes de cuero cabelludo e impétigo tratados en forma ambulatoria.
A los 10 años de edad fue hospitalizado por presentar neumonía bilateral complicada con pleuroneumonía basal derecha por Mycoplasma pneumoniae y atelectasia secundaria. Dos meses después se volvió a hospitalizar por un adenoflegmón inguinal izquierdo. Durante esta hospitalización se detectaron niveles elevados de transaminasas (SGPT: 88 UI/L) y fosfatasas alcalinas (1656 UI/L) con serología para virus hepatitis A, B y C negativos. Por este motivo, se le realizó una biopsia hepática la cual fue informada inicialmente como inflamación parenquimatosa compatible con hepatitis aguda. Durante esta última evaluación, se realizó una electroforesis de proteínas que reveló una hipogamaglobulinemia significativa. Posteriormente, se realizó una cuantificación de Igs que demostró niveles aumentados de IgM y niveles disminuidos de IgG e IgA.
El hemograma fue normal, sin presencia de neutropenia (recuento de neutrófilos: 5220 células/mm3) y los estudios de quimiotaxis y fagocitosis de levaduras, al igual que los niveles de complemento C3 y CH50 resultaron normales. Las subpoblaciones linfocitarias revelaron una cantidad disminuida de linfocitos CD4, un índice CD4/CD8 marcadamente invertido y una cantidad de linfocitos B (CD19) normal. No existían antecedentes de transfusiones y su serología para anticuerpos anti VIH 1 y 2, anti-nucleares, anti-DNA y anti-músculo liso fueron negativos. Con estos datos se planteó como diagnóstico probable SHIM y síndrome colestásico en estudio.
Se inició tratamiento con cotrimoxazol forte por riesgo de infección por Pneumocystis carinii, e inmunoglobulina endovenosa con esquema de terapia de reemplazo mensual (400 mg/kg/mes). Se realizó seguimiento con control clínico y hemogramas mensuales. El nivel de IgG aumentó y los niveles de IgM disminuyeron en forma progresiva hasta lograr niveles normales. Con el fin de confirmar el diagnóstico, se analizó una muestra de sangre para estudio de expresión de CD40L en linfocitos T activados y estudio de mutación genética del paciente y su madre. El estudio de expresión de CD40L, se realizó mediante citometría de flujo en Clínica Las Condes y luego repetido en el Laboratorio de Inmunodeficiencias Primarias de la Universidad de Washington (Seattle, Washington, EE.UU.).
Este estudio demostró un déficit total de expresión de CD40L en los linfocitos T activados del paciente y expresión parcial en los linfocitos maternos. Los estudios genéticos se realizaron utilizando técnicas moleculares las cuales revelaron la presencia, tanto en el paciente como en su madre, de una mutación nonsense (cambio de una base nucleotídica que produce un codón de parada) en el exón 1 del segmento transmembrana del CD40L. Este hallazgo confirmó el patrón de transmisión ligado al cromosoma X y determinó el estado de portadora de la madre.
Debida la persistencia de niveles elevados de transaminasas, se postuló el diagnóstico de colangitis esclerosante dada la asociación con el SHIM, por lo que se revisó la biopsia hepática un mes después, identificándose la presencia de imágenes en inflamación crónica que compromete los conductos biliares intrahepáticos con aspecto de "tela de cebolla" e indemnidad de la membrana basal en los espacios porta, compatible con colangitis esclerosante.
Posteriormente, se realizó una colangeografía endoscópica retrógrada que apoya el diagnóstico de colangitis esclerosante al demostrar compromiso intrahepático en ausencia de compromiso extrahepático. Se inició tratamiento con ácido ursodeoxicólico 250 mg/día, vitamina E 400 UI/día, y vitamina ACD 30 gotas/día.
En su evolución posterior al establecimiento de tratamiento, el paciente relató el desarrollo de episodios recurrentes de infecciones de tracto respiratorio agudo, sinusitis, otitis media aguda y conjuntivitis, síndrome bronquial obstructivo recurrente, los cuales se asociaron a una irregularidad en la frecuencia de administración de Ig intravenosa (en ocasiones una vez cada 3 meses). Sin embargo, su compromiso hepático disminuyó notoriamente, con ausencia de elementos de colestasia, sin coluria, acolia, ictericia ni prurito y una proyección hepática de 12 centímetros. A los 14 años de edad, durante un control de rutina por gastroenterólogo, se le solicitó una ecotomografía abdominal que demostró la presencia de pólipos vesiculares. Evolucionó en forma estable y un año más tarde se volvió a realizar un control ecotomográfico que mostró crecimiento de los pólipos. Por esta razón, se indicó una colecistectomía laparoscópica, cuyo estudio anatomopatológico evidenció un adenocarcinoma de la vesícula biliar bien diferenciado de tipo papilar infiltrante hasta la subserosa. Debido a lo anterior, el paciente volvió a intervenirse quirúrgicamente donde se realizó una bisegmentectomía hepática (VI B-V), más linfadenectomía de los ganglios 8, 12, 13 y 16. Estos fueron informados como negativos para lesión maligna y el estudio de metástasis fue negativo. Un año después de la operación, asistió a control acompañado por su madre, a quien se le pesquisó ictericia de piel y mucosas, estando clínicamente asintomática. Después de una evaluación exhaustiva, a la madre se le diagnosticó cirrosis biliar primaria. Se le indicó tratamiento con ácido ursodeoxicólico, el cual no ha recibido por problemas económicos.
Discusión
El XSHIM se genera por un defecto genético causado por mutaciones en el gen del CD40L, el cual codifica una proteína expresada primariamente en linfocitos T CD4+ activados. La interacción entre el CD40L de las células T activadas y el CD40 de las células B, macrófagos y células dendríticas, es crítica en la proliferación de linfocitos B y cambio de isotipo o clase de cadena pesada de Igs (ej: de IgM --> IgG), además de la formación de centros germinales en el linfonodo. El CD40L también actúa como un factor de crecimiento, de inducción y activación de las células T, siendo una molécula coestimuladora tanto para los linfocitos T helper 1 (TH1) y linfocitos T. Finalmente, la interacción CD40-CD40L es esencial para la activación de la función efectora de los macrófagos por las células T.
Existen también otras formas de SHIM no ligada a X, que no presentan alteraciones en el gen del CD40L, sino alteraciones moleculares en otros genes tales como el gen que codifica para una proteína denominada AID (activating-induced cytidine deaminase) implicada en el cambio de isotipo, mutación somática y formación de centros germinales. Recientemente, se han descrito también mutaciones en el gen que codifica para el CD40, molécula imprescindible en el desarrollo, crecimiento y diferenciación de las células B.
Uno de los problemas que suelen enfrentar en muestro medio los pacientes con inmunodeficiencias primarias es la tardanza o falla en el diagnóstico. Esto puede deberse a la baja incidencia de estos cuadros y que en ocasiones pueden cursar períodos de tiempo oligosintomáticos, y que de no mediar algún episodio de enfermedad grave, no se sospecha una inmunodeficiencia de base. En el caso de nuestro paciente, se pudo llegar al diagnóstico gracias a que actualmente se cuenta con técnicas de laboratorio que permiten un mejor diagnóstico de diversas inmunodeficiencias, incluso el XSHIM.
Esto se realiza mediante la detección o ausencia de expresión de CD40L en linfocitos T sanguíneos activados in vitro con forbol miristato acetato (PMA) e ionomicina, seguido de una tinción con una molécula quimérica soluble de CD40-Ig o con anticuerpos monoclonales de CD40L. Los linfocitos T marcados son luego analizados por citometría de flujo, donde se puede cuantificar la expresión de CD40L en la superficie celular de dichas células. La confirmación diagnóstica de XSHIM se efectúa mediante estudios moleculares. La búsqueda de mutaciones es posible desde que se conoce la estructura del gen CD40L, permitiendo así el diagnóstico incluso cuando no hay linfocitos disponibles. Las técnicas anteriores además permiten, al igual que en algunas otras inmunodeficiencias, detectar la anomalía genética en los períodos pre y post natal, o determinar el estado de portador de una madre, hermana o hija del paciente.
Aunque no ha sido descrito en nuestro paciente, la diarrea es un hallazgo frecuente que ocurre en pacientes XSHIM, que puede ser aguda o crónica1. La diarrea crónica acuosa se asocia con frecuencia a infección por Cryptosporidium que diversos autores han intentado asociar al desarrollo de colangitis esclerosante. La asociación de colangitis esclerosante e inmunodeficiencia refleja la asociación frecuente que existe entre inmunodeficiencias humorales y autoinmunidad. Esto puede observarse en pacientes con SHIM, inmunodeficiencia común variable, deficiencia de IgA, entre otras. Es posible que en XSHIM, esta asociación se deba en parte a una capacidad reducida de inducir subpoblaciones reguladoras de linfocitos T necesarias para generar tolerancia antigénica. Por otro lado, las células de epitelio biliar hepático normalmente expresan CD40L frente a estímulos inflamatorios crónicos, generando un proceso efectivo de protección contra gérmenes intracelulares como Cryptosporidium. El defecto de CD40L puede llevar a un proceso de inflamación crónica, como antesala al desarrollo de una patología autoinmune y posteriormente una neoplasia. La infección de piel y tejidos blandos como se observó en nuestro paciente es infrecuente, sin embargo, las úlceras orales y proctitis son manifestaciones comunes, que se asocian usualmente a neutropenia.
Los pacientes con SHIM, en especial aquellos con XSHIM tienen un riesgo mayor de desarrollar neoplasias, predominantemente linfomas. Un rasgo también característico de la XSHIM es la mayor incidencia de tumores hepáticos y biliares. En nuestro paciente no se detectaron autoanticuerpos inespecíficos ni específicos contra estructuras hepáticas. Sin embargo, llama la atención el desarrollo de una patología autoinmune hepática como la cirrosis biliar primaria en la madre, a quien se le demostró ser portadora de la misma mutación del gen del CD40L que nuestro paciente.
Las infecciones bacterianas que suelen observarse con frecuencia en el SHIM, hacen necesario un tratamiento agresivo, el cual se basa principalmente en la terapia de reemplazo de anticuerpos mediante el uso de inmunoglobulina intravenosa a dosis de 400 mg/kg/mes. Esta actúa reduciendo de forma significativa la frecuencia de infecciones, disminuye o normaliza los niveles de IgM y corrige la neutropenia, si ésta existe previamente. Debido a la mayor incidencia de infecciones por gérmenes oportunistas, los pacientes con XSHIM requieren de tratamientos más agresivos como el uso de profilaxis continua con cotrimoxasol para prevenir infección por Pneumocystis carinii, anfotericina B y flucitosina en caso de criptococosis. La neutropenia suele ser un hallazgo frecuente en pacientes con SHIM, que puede llegar a ser muy severa, predisponiendo a una mayor frecuencia de infecciones especialmente bacterianas. En nuestro paciente no se detectó la presencia de neutropenia. La enfermedad hepática se maneja con los esquemas descritos en el caso clínico. Sin embargo, dada la mala evolución que presentan los pacientes con compromiso del hígado, debe llegarse con frecuencia al trasplante hepático que hasta el momento ha tenido pobres resultados dada la alta recidiva de enfermedad autoinmune.
El pronóstico de los pacientes con XSHIM no es alentador. Un estudio retrospectivo de 56 pacientes reveló que 23,2% había muerto, con una edad promedio de 11,7 años. Las principales causas de muerte incluyeron infección, enfermedad hepática severa y tumores. La infección por Pneumocystis carinii tuvo un impacto importante en la morbimortalidad durante el primer año de vida, mientras que la enfermedad hepática contribuyó principalmente a la mortalidad tardía.
En conclusión, nuestro caso trata de un niño portador de una severa inmunodeficiencia humoral diagnosticada tardíamente que deriva hacia una enfermedad hepática autoinmune (colangitis esclerosante), desarrollando posteriormente una neoplasia (cáncer biliar) asociada al órgano afectado. En este paciente se logró realizar un adecuado estudio celular, molecular y genético de su inmunodeficiencia gracias a la colaboración de diversos centros especializados en nuestro país y en el extranjero. Lamentablemente, debido a la gravedad de su condición de base y lo irregular de su tratamiento, en gran parte por el alto costo de éste, el paciente ha cursado diversas complicaciones que le otorgan un pronóstico reservado.