Síndrome de Barth
| ||||||
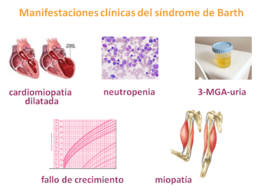
Síndrome de Barth (BTHS): Es un error congénito del metabolismo de los fosfolípidos caracterizado por: miocardiopatía dilatada (CMD), miopatía esquelética, neutropenia, retraso en el crecimiento y aciduria orgánica.
El síndrome fue bautizado en honor del Dr. Peter Barth (neurólogo pediátrico) de los Países Bajos por su estudio y descubrimiento en 1983.
Herencia
El síndrome de Barth (BTHS) es una condición genética ligada al cromosoma X, generalmente transmitida de madre a hijo (aunque mutaciones nuevas ocurren con frecuencia relativamente alta y existe un caso confirmado de una paciente femenina con BTHS). Una madre portadora de una mutación en el gen de Barth (en el gen de tafazzin también llamado TAZ o G4.5) no tiene síntomas, probablemente debido a inactivación sesgada del cromosoma X.
Un hijo varón de una mujer portadora tiene un 50% de probabilidad de tener Síndrome de Barth y 50% de probabilidad de ser sano; en cambio, una hija de mujer portadora tiene un 50% de ser también portadora y 50% de no llevar el gen afectado. Todas las hijas de un varón afectado con síndrome de Barth serán portadoras, pero ninguno de sus hijos tendrán el síndrome. Debido al hecho de que hay madres que no son portadoras, es importante hacer el estudio genético de todas las madres de niños con Barth para poder definir el riesgo o probabilidad genética en cada familia. Todos los niños varones emparentados con un individuo con síndrome de Barth a través de la línea femenina deben hacerse el estudio porque hay gran variabilidad fenotípica hasta entre hermanos afectados.
Etiología
El BTHS está causado por mutaciones en el gen TAZ (tafazzin; Xq28) que codifica la aciltransferasa Taz1p implicada en el metabolismo de la cardiolipina, un fosfolípido muy importante de las membranas mitocondriales internas. La función defectuosa de Taz1p da lugar a una remodelación anormal de la cardiolipina lo cual compromete finalmente la estructura mitocondrial o la función de la cadena respiratoria.
Diagnóstico
El diagnóstico estaba basado en un cribado metabólico de la orina mostrando excreciones elevadas de ácidos orgánicos (por lo general ácido 3-metilglutacónico), seguido por la secuenciación del gen TAZ. Sin embargo, la excreción de 3-MGC puede ser normal incluso en casos graves. Por lo que la prueba diagnóstica de elección es el análisis de la relación de monolisocardiolipina/cardiolipina en sangre, tejidos, fibroblastos o muestras de sangre del cribado neonatal. El diagnóstico diferencial incluye cardiomiopatías hereditarias, dilatadas y nutricionales y neutropenia idiopática/cíclica. El diagnóstico prenatal es posible en familias en las que se conoce la mutación.
Síntomas
Los principales síntomas de este síndrome multi-sistémico frecuentemente incluyen combinaciones y diferentes grados de severidad de:
- Miocardiopatía (Fallo cardiaco): Músculo cardíaco débil está generalmente asociado con agrandamiento del corazón (generalmente dilatación con hipertrofia variable del miocardio, a veces con ventrículo izquierdo no compactado y/o fibroelastosis endocardíaca).
- Neutropenia (Neutropenia en BTHS): (Crónica, cíclica, o intermitente) El sistema inmune sufre de una reducción de los neutrófilos, un tipo de glóbulos blancos muy importante en la defensa contra las infecciones bacterianas. Debido a neutropenia, estos niños son susceptibles a úlceras bucales, fiebres, o infecciones bacterianas, por ejemplo neumonía bacteriana y abcesos cutáneos.
- Músculos esqueléticos subdesarrollados y debilidad muscular: Todos los músculos, incluyendo el corazón, tienen una deficiencia celular que limita la habilidad de producir energía. La debilidad muscular y mayor fatiga debida a ejercicio o esfuerzo son características de BTHS
- Crecimiento retrasado: La mayoría de los muchachos con BTHS tienen peso y altura bajo el promedio. La falta de crecimiento de estos niños se atribuye frecuentemente a mala nutrición o a efectos secundarios de una enfermedad crónica. De hecho, ésta es rara vez la causa y los tratamientos nutricionales usuales son contra-indicados. Por medio del Registro de Datos Médicos de BSF, se ha observado que el crecimiento es similar o más severo que crecimiento retrasado sistémico; ésto es seguido por un crecimiento acelerado hasta alcanzar altura normal durante los años de adolescencia media a tardía
- Intolerancia al ejercicio
- Deficiencia de cardiolipina: Las células no pueden sintetizar una cantidad adecuada de cardiolipina tetralinoléica, un lípido (molécula similar a grasa) que es esencial para formar mitocondrios de estructura normal y para la producción de energía.
- Aciduria 3 metilglutacónica, Tipo II (MGA, Tipo II): Esto es debido a función anormal de los mitocondrios (los principales productores de energía de la célula). Sin embargo hay casos confirmados de BTHS que tienen niveles normales de ácido 3-metilglutacónico (3MGA). En el pasado, los niños fallecían antes de los 3 años debido a fallo del corazón o infecciones. Sin embargo, hoy en día la supervivencia y el futuro de estos individuos han mejorado mucho, ya que tenemos mejores diagnósticos, tratamientos médicos apropiados y buena supervisión de todos los síntomas. (Típicamente, hay un aumento de 5 a 20 veces de este ácido orgánico que se mide en la orina)
Tratamiento
El tratamiento es esencialmente de apoyo y multidisciplinar. El tratamiento clásico de la insuficiencia cardíaca ha incluido el uso de inhibidores de la enzima convertidora de angiotensina, betabloqueantes, digoxina y diuréticos, aunque no ha estudios publicados que analicen la eficacia de estas terapias. El 14% de los pacientes del Registro de la Barth Syndrome Foundation han requerido un trasplante cardíaco.
La mayoría de los pacientes, incluso aquéllos cuya nutrición es totalmente adecuada, muestran una disminución de la velocidad de crecimiento durante los dos primeros años. Pueden usarse suplementos de harina de maíz (maicena) a la hora de dormir para proporcionar una fuente alternativa de glucosa y así limitar el grado de pérdida de masa muscular que resulta de una noche de ayuno.
Los pacientes con neutropenia sintomática (que les produce infecciones de repetición) generalmente se tratan con una combinación de factor estimulante de granulocitos subcutánea y antibióticos profilácticos. Muchos pacientes muestran evidente mejoría sintomática (prevención de las úlceras aftosas y dolor en las encías, reducción de las infecciones bacterianas). Los antibióticos profilácticos se usan con frecuencia para reducir el riesgo de infecciones graves, especialmente en los niños que tienen neutropenia intermitente.
Además de la intervención médica y quirúrgica, el manejo de los pacientes con síndrome de Barth incluye la terapia de soporte con otros especialistas como fisioterapeutas y terapeutas ocupacionales, logopedas, psicólogos y educadores especiales. Los pacientes con esta enfermedad compleja, por lo tanto, están mejor gestionados por un equipo multidisciplinario dentro de unidades especializadas.
No obstante, el pronóstico del síndrome de Barth de diagnóstico precoz y tratamiento proactivo ha mejorado mucho en los últimos tiempos y especialmente la calidad de vida de los pacientes que lo padecen.
El fallo cardíaco es tratado con medicación convencional o con un trasplante cardíaco si es refractario. El riesgo de sepsis bacteriana en los casos de neutropenia intermitente puede reducirse mediante el uso de antibióticos profilácticos y/o el uso intermitente de un factor estimulante de colonias de granulocitos. Las dificultades en la alimentación pueden necesitar alimentación por sonda nasogástrica o gastrostomía.
Fuentes
- https://www.barthsyndrome.org/bsf-international/espanol/el-Sindrome-de-barth
- http://www.guiametabolica.org/ecm/sindrome-barth/info/diagnostico-tratamiento-sindrome-barth
- http://www.guiametabolica.org/ecm/sindrome-barth/info/es-sindrome-barth
- http://www.guiametabolica.org/ecm/sindrome-barth/info/diagnostico-tratamiento-sindrome-barth
- https://www.barthsyndrome.org/home