Transcripción |
|---|
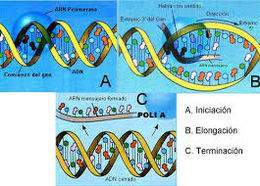
| | Concepto: | Proceso en el que se sintetiza ARN a partir de una plantilla de ADN, permitiendo la transferencia de información genética para la síntesis de proteínas (traducción).[1] |
|
La transcripción es un proceso celular esencial en el que se sintetiza una molécula de ARN complementaria a una secuencia de ADN, facilitando la expresión génica. El ARN resultante (llamado transcrito) sigue las reglas de complementariedad de bases.[2]
Diferencias entre dominios biológicos
Bacterias:
- Transcripción y traducción ocurren acopladas en el citoplasma (sin núcleo).
- Velocidad: ~40 nucleótidos/segundo (Dulin et al., 2015).
Eucariotas:
- La transcripción ocurre en el núcleo.
- La traducción ocurre en el citoplasma.
- Requiere procesamiento del ARN (ej. splicing).
Virus (excepción):
- Algunos virus (como Influenza o SARS-CoV-2) realizan transcripción de ARN (ARN → ARN).
- Usan ARN polimerasas ARN-dependientes (Lodish et al., 2016).
Complementariedad de bases (ADN → ARN)
| Base en ADN |
Base en ARN
|
| A |
U
|
| T |
A
|
| C |
G
|
| G |
C
|
Nota: En virus de ARN, el emparejamiento depende de si su genoma es de sentido positivo o negativo.
Etapas de la transcripción
Iniciación
- Promotores:
- Bacterias: Caja de Pribnow (TATAAT) en posición -10 (Pribnow, 1975).
- Eucariotas: Caja TATA (TATAAA) en posición -25.
- Factores de transcripción:
- ARN polimerasa se une al promotor (Alberts et al., 2017).
- En eucariotas: Complejo de iniciación con factores TFII.
Elongación
- Formación de la burbuja de transcripción (~14 pb desenrolladas).
- Síntesis en dirección 5' → 3'.
- En eucariotas: Modificaciones co-transcripcionales (5' cap, poli-A).
Terminación
- Bacterias:
- Independiente de Rho: Horquilla GC + cola de uracilos.
- Dependiente de Rho: Hexámero ρ reconoce secuencias "rut".
- Eucariotas:
- Señal de poliadenilación (AAUAAA) (Lodish et al., 2016).
- Corte y adición de cola poli-A.
Regulación
- Elementos cis: Secuencias reguladoras (enhancers/silencers).
- Factores trans: Proteínas que se unen a elementos reguladores (Allis & Jenuwein, 2016).
- Modificaciones epigenéticas (metilación, acetilación).
Técnicas de estudio
- Pulso-caza: Uso de nucleótidos marcados (³H-uridina).
- Run-on transcription: Mide transcripción activa.
- RNA-seq: Secuenciación masiva de transcritos (Wang et al., 2009).
Referencias
- ↑ Transcripción. (s. f.). Genome.gov. Recuperado 31 de marzo de 2025, de [1]
- ↑ Resumen de la transcripción. (s. f.). Khan Academy. Recuperado 31 de marzo de 2025, de [2]
Fuentes
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K. & Walter, P. (2017). Molecular biology of the cell (6ª ed.). Garland Science. [3] (Consultado el 31 de marzo de 2025).
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., Amon, A. & Martin, K. C. (2016). Molecular cell biology (8ª ed.). W.H. Freeman. ISBN 978-1464183393. (Consultado el 31 de marzo de 2025).
- National Center for Biotechnology Information. (2023). Eukaryotic transcription control. [4] (Consultado el 31 de marzo de 2025).
- Nature Education. (2014). Transcription: DNA to RNA. Scitable. [5] (Consultado el 31 de marzo de 2025).
- Allis, C. D. & Jenuwein, T. (2016). The molecular hallmarks of epigenetic control. Nature Reviews Genetics, 17(8), 487-500. [6] (Consultado el 31 de marzo de 2025).
- Wang, Z., Gerstein, M. & Snyder, M. (2009). RNA-Seq: a revolutionary tool for transcriptomics. Nature Reviews Genetics, 10(1), 57-63. [7] (Consultado el 31 de marzo de 2025).
- Pribnow, D. (1975). Nucleotide sequence of an RNA polymerase binding site at an early T7 promoter. Proceedings of the National Academy of Sciences, 72(3), 784-788. [8] (Consultado el 31 de marzo de 2025).
- Dulin, D., Bauer, D. L. V., Malinen, A. M., Bakermans, J. J. W., Kaller, M., Morichaud, Z., Petushkov, I., Depken, M., Brodolin, K. & Kulbachinskiy, A. (2015). Pause sequences facilitate entry into long-lived paused states by reducing RNA polymerase transcription rates. Nature Communications, 6, 10157. [9] (Consultado el 31 de marzo de 2025).


