Diferencia entre revisiones de «Hidrazina»
(→Ver además) |
|||
| Línea 24: | Línea 24: | ||
|velocidad_del_sonido= | |velocidad_del_sonido= | ||
}} | }} | ||
| − | '''Hidrazina'''. [[Combustible]] líquido para los [[Motor_Cohete#Motor_Cohete_de_Propulsante_L.C3.ADquido_.28MCPL.29|Motores Cohetes de Propulsante Líquido]] que responde a la fórmula '''N<sub>2</sub>H<sub>4</sub>'''. Se conoce además como ''Diamina'' o ''Hidruro de Nitrógeno''. | + | '''Hidrazina'''. [[Combustible]] líquido para los [[Motor_Cohete#Motor_Cohete_de_Propulsante_L.C3.ADquido_.28MCPL.29|Motores Cohetes de Propulsante Líquido]] que responde a la fórmula '''N<sub>2</sub>H<sub>4</sub>'''. Se conoce además como ''Diamina'' o ''Hidruro de [[Nitrógeno]]''. |
== Propiedades == | == Propiedades == | ||
| − | Es un líquido incoloro y oleoso, fumante al aire e higroscópico. Absorve de la atmósfera el [[Oxígeno]] y [[Anhídrido Carbónico]]. Es tóxica, soluble en [[agua]], [[alcohol]], [[amoníaco]] y otros solventes. | + | Es un [[líquido]] incoloro y oleoso, fumante al aire e higroscópico. Absorve de la [[atmósfera]] el [[Oxígeno]] y [[Anhídrido Carbónico]]. Es tóxica, soluble en [[agua]], [[alcohol]], [[amoníaco]] y otros solventes. |
| − | A temperatura ambiente es estable y no se descompone sin acceso de aire. Es susceptible de descomposición catalítica o térmica, formando una mezcla caliente gaseosa de [[hidrógeno]], [[nitrógeno]] y [[amoníaco]]. | + | A temperatura ambiente es estable y no se descompone sin acceso de [[aire]]. Es susceptible de descomposición catalítica o térmica, formando una mezcla caliente gaseosa de [[hidrógeno]], [[nitrógeno]] y [[amoníaco]]. |
| − | Es propensa a descomponerse con explosión por recalentamiento en espacio cerrado y bajo impulsos potentes. No ataca a muchos | + | Es propensa a descomponerse con explosión por recalentamiento en espacio cerrado y bajo impulsos potentes. No ataca a muchos [[metal]]es, pero en presencia del [[oxígeno]] reacciona con el [[cobre]] y sus [[aleación|aleaciones]] y al mismo tiempo los iones de cobre [[catalizador|catalizan]] la descomposición. |
== Usos == | == Usos == | ||
| − | Se utiliza junto al [[tetróxido de dinitrógeno]], formando un propulsante de inflamación espontánea. En | + | Se utiliza junto al [[tetróxido de dinitrógeno]], formando un propulsante de inflamación espontánea. En la década de [[1940]] en [[Alemania]] se utilizó la mezcla de hidrazina con [[agua]] (Hidrato de hidrazina). |
== Ver además == | == Ver además == | ||
| Línea 40: | Línea 40: | ||
== Fuentes == | == Fuentes == | ||
| − | * | + | *'''Hidrazina'''. Disponible en ''www.quiminet.com/pr3/Hidrazina.htm'' |
| − | * | + | *http://www.insht.es/InshtWeb/Contenidos/Documentacion/FichasTecnicas/FISQ/Ficheros/201a300/nspn0281.pdf |
[[Category:Química]] | [[Category:Química]] | ||
última versión al 14:25 3 dic 2011
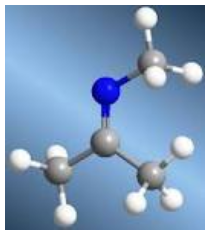
Hidrazina. Combustible líquido para los Motores Cohetes de Propulsante Líquido que responde a la fórmula N2H4. Se conoce además como Diamina o Hidruro de Nitrógeno.
Sumario
Propiedades
Es un líquido incoloro y oleoso, fumante al aire e higroscópico. Absorve de la atmósfera el Oxígeno y Anhídrido Carbónico. Es tóxica, soluble en agua, alcohol, amoníaco y otros solventes.
A temperatura ambiente es estable y no se descompone sin acceso de aire. Es susceptible de descomposición catalítica o térmica, formando una mezcla caliente gaseosa de hidrógeno, nitrógeno y amoníaco.
Es propensa a descomponerse con explosión por recalentamiento en espacio cerrado y bajo impulsos potentes. No ataca a muchos metales, pero en presencia del oxígeno reacciona con el cobre y sus aleaciones y al mismo tiempo los iones de cobre catalizan la descomposición.
Usos
Se utiliza junto al tetróxido de dinitrógeno, formando un propulsante de inflamación espontánea. En la década de 1940 en Alemania se utilizó la mezcla de hidrazina con agua (Hidrato de hidrazina).
Ver además
Fuentes
- Hidrazina. Disponible en www.quiminet.com/pr3/Hidrazina.htm
- http://www.insht.es/InshtWeb/Contenidos/Documentacion/FichasTecnicas/FISQ/Ficheros/201a300/nspn0281.pdf