Hidrólisis
| ||||||
Hidrólisis. Reacción ácido-base entre una sustancia, típicamente una sal, y el agua.
Fundamento teórico de hidrólisis
Una sal se puede considerar que se forma a partir de un ácido y una base, el catión procede de la base, y puede tener carácter ácido, y el anión del ácido, por lo que puede tener carácter básico. Así, el KNO3, se forma por reacción de la base KOH (que aporta el catión K+) con el ácido HNO3 (que aporta el anión NO3-). Atendiendo a la fuerza del ácido y la base que dan lugar a la sal, existen cuatro tipos diferentes de hidrólisis:
1. Hidrólisis de sal de ácido fuerte-base fuerte como, por ejemplo, NaCl (Na+Cl-). Esta sal proviene del HCl (ácido fuerte) y del NaOH (base fuerte), por tanto Na+ y Cl-, serán respectivamente débiles. Na+ + H2O no hay reacción Cl- + H2O no hay reacción Por tanto el pH será neutro (no sufre hidrólisis ni el catión ni el anión)
2. Hidrólisis de sal de ácido débil-base fuerte como, por ejemplo, NaCN (Na+CN-). Esta sal proviene del HCN (ácido débil) y del NaOH (base fuerte), por tanto Na+ será débil y CN- fuerte. Na+ + H2O no hay reacción CN-+ H2O HCN + OH-. Se generan iones hidroxilo (iones hidróxido) , es decir elpH será básico (sufre hidrólisis el anión)
3. Hidrólisis de sal de ácido fuerte-base débil como, por ejemplo, NH4Cl (NH4+ Cl-). Esta sal proviene del HCl (ácido fuerte) y del NH3 (base débil), por tanto NH4+ será fuerte y Cl- será débil. Cl- + H2O no hay reacción NH4+ + H2O NH3 + H3O+. Se generan iones hidronio (hidroxonio) , el pH será ácido (sufre hidrólisis el catión)
4. Hidrólisis de sal de ácido débil-base débil como, por ejemplo, NH4CN (NH4+ CN-). Esta sal proviene del HCN (ácido débil) y del NH3 (base débil), por tanto NH4+ y CN- serán fuertes. NH4+ +H2O NH3 + H3O+ La constante de este equilibrio representará la Ka del NH4+ CN-+H2O HCN + OH- La constante de este equilibrio representará la Kb del CN- Si Ka > Kb , pH ácido; Si Ka < Kb , pH básico; Si Ka = Kb , pH neutro En este caso concreto Ka(NH4+) = 5,6·10-10 y Kb(CN-) = 2,0·10-5 Þ 2,0·10-5 > 5,6·10-10 Þ el pH será básico
Hidrólisis de los polisacáridos
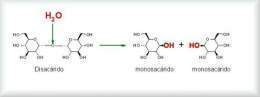
Los disacáridos y los polisacáridos deben ser hidrolizados hasta monosacáridos para poder pasar la pared intestinal para llegar al torrente sanguíneo y poder ingresar al interior de las células para su utilización.
La hidrólisis de un enlace glucosídico se lleva a cabo mediante la disociación de una molécula de agua del medio. El hidrógeno del agua se une al oxígeno del extremo de una de las moléculas de azúcar; el OH se une al carbono libre del otro residuo de azúcar. El resultado de esta reacción, es la liberación de un monosacárido y el resto de la molécula que puede ser un monosacárido si se trataba de un disacárido o bien del polisacárido restante si se trataba de un polisacárido más complejo.
Fuentes
- Hidrólisis de los polisacáridos. Bioquímica y Biología molecular en línea. Dr Eggar Vázques Contreras
- Diccionario de la lengua española
- Wikipedia, la enciclopedia libre