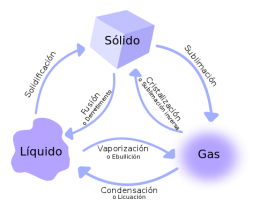
Cambio de estado
| ||||||
Cambio de estado. En física y química es la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la tierra son sólido, líquido y gaseoso; no obstante, el estado de agregación más común en nuestro universo es el plasma, material del que están compuestas las estrellas (si descartamos la materia oscura).
Sumario
Cambios de estado de agregación de la materia
A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia.
- Fusión: Es el paso de un sólido al estado líquido por medio de la energía térmica; durante este proceso isotérmico hay un punto en que la temperatura permanece constante. El punto de fusión es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Cuando dichas moléculas se moverán en una forma independiente, transformándose en un líquido.
- Solidificación: Es la transformación de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El punto de solidificación o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Ebullición: Es el proceso físico en el que un líquido pasa a estado gaseoso. Se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión. Si se continúa calentando el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
La evaporación es rara pero importante e indispensable en la vida cuando se trata del agua, que se transforma en nube y vuelve en forma de lluvia, nieve, niebla o rocío.
Cuando existe un espacio libre encima de un líquido caliente, una parte de sus moléculas está en forma gaseosa, al equilibrarse, la cantidad de materia gaseosa define la presión de vapor saturante, la cual no depende de la temperatura.
- Condensación: Cambio de estado de la materia que se encuentra en forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Cristalización inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el Hielo Seco.
En todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias ni se modifican sus propiedades, solo cambia su estado físico.
Las diferentes transformaciones de fase de la materia, en este caso las del agua, son necesarias y provechosas para la vida y el sustento del hombre cuando se desarrollan normalmente.
Punto de ebullición
Es aquella temperatura en la cual la materia cambia de estado líquido a gaseoso, es decir se ebulle. Expresado de otra manera, en un líquido, el punto de ebullición es la temperatura a la cual la presión de vapor del líquido es igual a la presión del medio que rodea al líquido. En esas condiciones se puede formar vapor en cualquier punto del líquido.
La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que lo componen).
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente – dipolo inducido o puentes de hidrógeno).
Termodinámica
La termodinámica (del griego θερμo-, termo, que significa calor y δύναμις, dínamis, que significa fuerza) es una rama de la física que estudia los efectos de los cambios de magnitudes de los sistemas a un nivel macroscópico. Constituye una teoría fenomenológica, a partir de razonamientos deductivos, que estudia sistemas reales, sin modelizar y sigue un método experimental. Los cambios estudiados son los de temperatura, presión y volumen, aunque también estudia cambios en otras magnitudes, tales como imanación, potencial químico, Fuerza Electromotriz y el estudio de los medios continuos en general.
También podemos decir que la termodinámica nace para explicar los procesos de intercambio de masa y energía térmica entre sistemas térmicos diferentes. Para tener un mayor manejo especificaremos que calor significa energía en tránsito y dinámica se refiere al movimiento, por lo que, en esencia, la termodinámica estudia la circulación de la energía y cómo la energía infunde movimiento. Históricamente, la termodinámica se desarrolló a partir de la necesidad de aumentar la eficiencia de las primeras máquinas de vapor.
El punto de partida para la mayor parte de las consideraciones termodinámicas son las leyes de la termodinámica, que postulan que la energía puede ser intercambiada entre sistemas en forma de calor o trabajo. También se introduce una magnitud llamada entropía, que mide el orden y el estado dinámico de los sistemas y tiene una conexión muy fuerte con la teoría de información.
Proceso isotérmico
Se denomina proceso isotérmico o proceso isotermo al cambio de temperatura reversible en un sistema termodinámico, siendo dicho cambio de temperatura constante en todo el sistema. La compresión o expansión de un gas ideal en contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente.
De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante.
Teoría cinética molecular
Los dos parámetros de los que depende que una sustancia o mezcla se encuentre en un estado o en otro son: temperatura y presión. La temperatura es una medida de la energía cinética de las moléculas y átomos de un cuerpo. Un aumento de temperatura o una reducción de la presión favorecen la fusión, la evaporación y la sublimación, mientras que un descenso de temperatura o un aumento de presión favorecen los cambios opuestos.
Al calentar la sustancia la agitación de las partículas es mucho mayor, es decir, sube la temperatura. Hay que aclarar que la agitación no es la que provoca el calor, sino que la agitación es el propio calor. Si la sustancia es sólida y la agitación de sus partículas es suficiente, entonces la sustancia puede pasar de ser líquida a gaseosa, dependiendo del grado de agitación de las partículas, facilitando así la fusión, vaporización o sublimación de la sustancia.
Por el contrario al enfriar dicha sustancia la agitación de las partículas disminuye y permite realizar los cambios contrarios: solidificación, licuación o condensación, sublimación regresiva.
Fuente
- Diccionario Enciclopédico Océano. Editorial Grupo Océano, Edición 1996.