Diferencia entre revisiones de «Base (sustancia)»
m (Rosarino movió la página Base (Sustancia) a Base (sustancia): corrijo la mala utilización de las mayúsculas en sustantivos comunes y adjetivos que no forman parte del nombre propio) |
(→Propiedades de las bases) (Etiqueta: nuestro-nuestra) |
||
| (No se muestran 3 ediciones intermedias de 2 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Definición | {{Definición | ||
| − | |nombre=Base | + | | nombre = Base |
| − | |imagen= | + | | imagen = Jabonesss.jpeg |
| − | |tamaño= | + | | tamaño = |
| − | |concepto= | + | | concepto = Los distintos tipos de jabón son sustancias base. |
| − | }} | + | }} |
| − | + | ||
| − | ''' | + | Una '''base''' o '''álcali''' es una sustancia que presenta propiedades alcalinas. |
| − | *KOH → OH- + K+ (en disolución acuosa) | + | |
| − | + | La palabra “álcali” proviene del idioma árabe ''al-qaly'' (‘la ceniza’). | |
| − | ==Definiciones de base== | + | |
| − | La definición inicial corresponde a la formulada en | + | Las bases presentan apariencia jabonosa. |
| − | La teoría de Brönsted y Lowry de ácidos y bases, formulada en 1923, dice que una base es aquella sustancia capaz de aceptar un protón (H<sup>+</sup>). Esta definición engloba la anterior: en el ejemplo anterior, el KOH al disociarse en disolución da iones OH<sup>-</sup>, que son los que actúan como base al poder aceptar un protón. Esta teoría también se puede aplicar en disolventes no acuosos. | + | |
| − | Lewis en | + | Según el físico y químico sueco [[Svante Arrhenius]] (1859-1927), una base es toda sustancia que en disolución acuosa se [[ioniza]] para dar lugar a iones OH. |
| − | *Ejemplos de bases de Arrehnius: NaOH, KOH, Al(OH)<sub>3</sub>. | + | De esta forma se explica el comportamiento básico del [[NaOH]]. |
| − | *Ejemplos de bases de Brönsted y Lowry: NH<sub>3</sub>, S<sub>2</sub><sup>-</sup>, HS<sup>-</sup>. | + | |
| + | Otro ejemplo es el hidróxido potásico, de fórmula [[KOH]]: | ||
| + | * KOH → OH- + K+ (en disolución acuosa) | ||
| + | |||
| + | == Definiciones de base == | ||
| + | |||
| + | La definición inicial corresponde a la formulada en 1887 por Arrehnius. | ||
| + | |||
| + | La teoría de Brönsted y Lowry de ácidos y bases, formulada en 1923, dice que una base es aquella sustancia capaz de aceptar un protón (H<sup>+</sup>). Esta definición engloba la anterior: en el ejemplo anterior, el KOH al disociarse en disolución da iones OH<sup>-</sup>, que son los que actúan como base al poder aceptar un protón. Esta teoría también se puede aplicar en disolventes no acuosos. | ||
| + | |||
| + | Lewis en 1923 amplió aún más la definición de ácidos y bases, aunque la teoría de Lewis no tendría repercusión hasta años más tarde. Según la teoría de Lewis una base es aquella sustancia que puede ceder un par de electrones. El ión OH<sup>-</sup>, al igual que otros iones o moléculas como el NH<sub>3</sub>, H<sub>2</sub>O, etc., tienen un par de electrones no enlazantes, por lo que son bases. Todas las bases según la teoría de Arrehnius o la de Brönsted y Lowry son a su vez bases de Lewis. | ||
| + | * Ejemplos de bases de Arrehnius: NaOH, KOH, Al(OH)<sub>3</sub>. | ||
| + | * Ejemplos de bases de Brönsted y Lowry: NH<sub>3</sub>, S<sub>2</sub><sup>-</sup>, HS<sup>-</sup>. | ||
==Nomenclatura de bases== | ==Nomenclatura de bases== | ||
| + | |||
Para crear una base usando diversas nomenclaturas para ellas tomadas a partir de los nombres de los elementos y juntándolos con un ion hidroxilo (OH), tomando el número de valencia del elemento y combinarlos (cambiándolos de posición) como se muestra en la tabla: | Para crear una base usando diversas nomenclaturas para ellas tomadas a partir de los nombres de los elementos y juntándolos con un ion hidroxilo (OH), tomando el número de valencia del elemento y combinarlos (cambiándolos de posición) como se muestra en la tabla: | ||
| − | + | ||
{| class="wikitable" border="1" | {| class="wikitable" border="1" | ||
|- | |- | ||
| − | ! Fórmula | + | ! Fórmula |
! Tradicional | ! Tradicional | ||
! Stock | ! Stock | ||
| Línea 27: | Línea 40: | ||
|- | |- | ||
| Cu(OH) | | Cu(OH) | ||
| − | | Hidróxido | + | | Hidróxido cuproso |
| − | | Hidróxido de | + | | Hidróxido de cobre (I) |
| − | | Monohidróxido | + | | Monohidróxido de cobre |
|- | |- | ||
| Cu(OH)<sub>2</sub> | | Cu(OH)<sub>2</sub> | ||
| − | | Hidróxido | + | | Hidróxido cúprico |
| − | | Hidróxido de | + | | Hidróxido de cobre (II) |
| − | | Dihidróxido | + | | Dihidróxido de cobre |
| − | |} | + | |} |
| − | + | ||
Cuando un elemento tiene más de dos valencias no se le pone nomenclatura tradicional. Al usar la menor valencia, el elemento termina en oso y cuando se usa la mayor termina en ico. En la nomenclatura IUPAC se le va a dar una conformación de prefijos al elemento según su valencia usada (Mono, Di, Tri, Tetra, Penta, Hexa, etc) junto con la terminación -hidroxi u -oxidrilo que es el ion OH con carga −1. | Cuando un elemento tiene más de dos valencias no se le pone nomenclatura tradicional. Al usar la menor valencia, el elemento termina en oso y cuando se usa la mayor termina en ico. En la nomenclatura IUPAC se le va a dar una conformación de prefijos al elemento según su valencia usada (Mono, Di, Tri, Tetra, Penta, Hexa, etc) junto con la terminación -hidroxi u -oxidrilo que es el ion OH con carga −1. | ||
| − | ==Formación de las bases== | + | == Formación de las bases == |
| + | |||
Una base se forma cuando un óxido de un metal reacciona con agua: | Una base se forma cuando un óxido de un metal reacciona con agua: | ||
| − | *MgO | + | * MgO + H<sub>2</sub>O → Mg(OH)<sub>2</sub> |
| − | igual es : | + | igual es: |
| − | *Al<sub>2</sub>O<sub>3</sub> + 3H<sub>2</sub>O → 2Al(OH)<sub>3</sub> | + | * Al<sub>2</sub>O<sub>3</sub> + 3H<sub>2</sub>O → 2Al(OH)<sub>3</sub> |
==Propiedades de las bases== | ==Propiedades de las bases== | ||
| + | |||
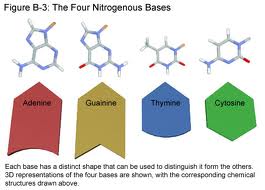
| + | [[Archivo:Bases.jpeg|miniatura|En el [[ácido desoxirribonucleico|ADN]] hay cuatro nucleótidos o “bases nitrogenadas” (que nada tienen que ver con las sustancias base o sustancias alcalinas): <br> • [[adenina]] (A) <br> • [[citosina]] (C) <br> • [[guanina]] (G) <br> • [[timina]] (T).<br> Estas bases forman pares específicos (A con T y G con C).]] | ||
| + | |||
Las bases... | Las bases... | ||
| − | *Cambian de color a los indicadores tratados previamente con ácidos. | + | * Cambian de color a los indicadores tratados previamente con ácidos. |
| − | *En disolución, presentan sabor amargo (a lejía); también destruyen los tejidos vivos y conducen la corriente eléctrica. | + | * En disolución, presentan sabor amargo (a [[lejía]]); también destruyen los tejidos vivos y conducen la corriente eléctrica. |
| − | *Anulan ( | + | * Anulan (“neutralizan”) el efecto de los ácidos. |
| − | *Generan precipitados (sustancias en fase sólida en el seno de un líquido) al ser puestas en contacto con ciertas sales metálicas (por ejemplo, de calcio y de magnesio). | + | * Generan precipitados (sustancias en fase sólida en el seno de un líquido) al ser puestas en contacto con ciertas sales metálicas (por ejemplo, de calcio y de magnesio). |
| − | *Sus disoluciones acuosas producen una sensación suave (jabonosa) al tacto. | + | * Sus disoluciones acuosas producen una sensación suave (jabonosa) al tacto. |
| − | *Sus disoluciones acuosas cambian el color de muchos colorantes vegetales; por ejemplo, devuelven el color azul al tornasol enrojecido por los ácidos. | + | * Sus disoluciones acuosas cambian el color de muchos colorantes vegetales; por ejemplo, devuelven el color azul al tornasol enrojecido por los ácidos. |
| − | *Precipitan muchas sustancias,que son solubles en los ácidos. | + | * Precipitan muchas sustancias, que son solubles en los ácidos. |
| − | *Pierden todas sus propiedades características cuando reaccionan con un [[ácido]]. | + | * Pierden todas sus propiedades características cuando reaccionan con un [[ácido]]. |
| + | |||
Tanto ácidos como bases se encuentran en gran cantidad en productos usados en la vida cotidiana, para la industria y la higiene, así como en frutas y otros alimentos, mientras que el exceso o defecto de sus cantidades relativas en nuestro organismo se traduce en problemas de salud. | Tanto ácidos como bases se encuentran en gran cantidad en productos usados en la vida cotidiana, para la industria y la higiene, así como en frutas y otros alimentos, mientras que el exceso o defecto de sus cantidades relativas en nuestro organismo se traduce en problemas de salud. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | == Fuentes | + | == Bases más comunes == |
| − | *http://laboratorio-quimico.blogspot.com/2013/09/introduccion-los-acidos-y-bases.html | + | |
| − | *http://enciclopedia.us.es/index.php/Base | + | Algunos ejemplos de bases son: |
| − | + | ||
| − | *http://www.textoscientificos.com/quimica/inorganica/acidos-bases | + | * La [[soda cáustica]] ([[NaOH]]) |
| − | *http://html.rincondelvago.com/acidos-y-bases_6.html | + | |
| + | * El [[cloro]] de piscina (hipoclorito de sodio) | ||
| + | |||
| + | * Los medicamentos [[antiácidos]] en general | ||
| + | |||
| + | * Productos de limpieza | ||
| + | |||
| + | * [[Amoníaco]] (NH<sub>3</sub>) | ||
| + | |||
| + | * La [[leche de magnesia]] ([[hidróxido de magnesio]]): Mg(OH)<sub>2</sub> | ||
| + | |||
| + | * El [[bicarbonato de sodio]] | ||
| + | |||
| + | * El [[jabón]] y el [[detergente]] ([[hidróxido de sodio]]). | ||
| + | |||
| + | == Fuentes == | ||
| + | |||
| + | {{listaref}} | ||
| + | :* http://laboratorio-quimico.blogspot.com/2013/09/introduccion-los-acidos-y-bases.html | ||
| + | :* http://enciclopedia.us.es/index.php/Base | ||
| + | :* http://www.textoscientificos.com/quimica/inorganica/acidos-bases | ||
| + | :* http://html.rincondelvago.com/acidos-y-bases_6.html | ||
| + | :* [https://es.wikibooks.org/wiki/Qu%C3%ADmica_/_Definici%C3%B3n_%C3%A1cido-base https://es.wikibooks.org/química:-definiciones-de-compuestos-ácido/base] | ||
| − | [[ | + | [[Categoría: Química inorgánica]] |
última versión al 23:25 8 nov 2022
| ||||||
Una base o álcali es una sustancia que presenta propiedades alcalinas.
La palabra “álcali” proviene del idioma árabe al-qaly (‘la ceniza’).
Las bases presentan apariencia jabonosa.
Según el físico y químico sueco Svante Arrhenius (1859-1927), una base es toda sustancia que en disolución acuosa se ioniza para dar lugar a iones OH. De esta forma se explica el comportamiento básico del NaOH.
Otro ejemplo es el hidróxido potásico, de fórmula KOH:
- KOH → OH- + K+ (en disolución acuosa)
Sumario
Definiciones de base
La definición inicial corresponde a la formulada en 1887 por Arrehnius.
La teoría de Brönsted y Lowry de ácidos y bases, formulada en 1923, dice que una base es aquella sustancia capaz de aceptar un protón (H+). Esta definición engloba la anterior: en el ejemplo anterior, el KOH al disociarse en disolución da iones OH-, que son los que actúan como base al poder aceptar un protón. Esta teoría también se puede aplicar en disolventes no acuosos.
Lewis en 1923 amplió aún más la definición de ácidos y bases, aunque la teoría de Lewis no tendría repercusión hasta años más tarde. Según la teoría de Lewis una base es aquella sustancia que puede ceder un par de electrones. El ión OH-, al igual que otros iones o moléculas como el NH3, H2O, etc., tienen un par de electrones no enlazantes, por lo que son bases. Todas las bases según la teoría de Arrehnius o la de Brönsted y Lowry son a su vez bases de Lewis.
- Ejemplos de bases de Arrehnius: NaOH, KOH, Al(OH)3.
- Ejemplos de bases de Brönsted y Lowry: NH3, S2-, HS-.
Nomenclatura de bases
Para crear una base usando diversas nomenclaturas para ellas tomadas a partir de los nombres de los elementos y juntándolos con un ion hidroxilo (OH), tomando el número de valencia del elemento y combinarlos (cambiándolos de posición) como se muestra en la tabla:
| Fórmula | Tradicional | Stock | IUPAC |
|---|---|---|---|
| Cu(OH) | Hidróxido cuproso | Hidróxido de cobre (I) | Monohidróxido de cobre |
| Cu(OH)2 | Hidróxido cúprico | Hidróxido de cobre (II) | Dihidróxido de cobre |
Cuando un elemento tiene más de dos valencias no se le pone nomenclatura tradicional. Al usar la menor valencia, el elemento termina en oso y cuando se usa la mayor termina en ico. En la nomenclatura IUPAC se le va a dar una conformación de prefijos al elemento según su valencia usada (Mono, Di, Tri, Tetra, Penta, Hexa, etc) junto con la terminación -hidroxi u -oxidrilo que es el ion OH con carga −1.
Formación de las bases
Una base se forma cuando un óxido de un metal reacciona con agua:
- MgO + H2O → Mg(OH)2
igual es:
- Al2O3 + 3H2O → 2Al(OH)3
Propiedades de las bases
Las bases...
- Cambian de color a los indicadores tratados previamente con ácidos.
- En disolución, presentan sabor amargo (a lejía); también destruyen los tejidos vivos y conducen la corriente eléctrica.
- Anulan (“neutralizan”) el efecto de los ácidos.
- Generan precipitados (sustancias en fase sólida en el seno de un líquido) al ser puestas en contacto con ciertas sales metálicas (por ejemplo, de calcio y de magnesio).
- Sus disoluciones acuosas producen una sensación suave (jabonosa) al tacto.
- Sus disoluciones acuosas cambian el color de muchos colorantes vegetales; por ejemplo, devuelven el color azul al tornasol enrojecido por los ácidos.
- Precipitan muchas sustancias, que son solubles en los ácidos.
- Pierden todas sus propiedades características cuando reaccionan con un ácido.
Tanto ácidos como bases se encuentran en gran cantidad en productos usados en la vida cotidiana, para la industria y la higiene, así como en frutas y otros alimentos, mientras que el exceso o defecto de sus cantidades relativas en nuestro organismo se traduce en problemas de salud.
Bases más comunes
Algunos ejemplos de bases son:
- La soda cáustica (NaOH)
- El cloro de piscina (hipoclorito de sodio)
- Los medicamentos antiácidos en general
- Productos de limpieza
- Amoníaco (NH3)
- La leche de magnesia (hidróxido de magnesio): Mg(OH)2
- El jabón y el detergente (hidróxido de sodio).
Fuentes
- http://laboratorio-quimico.blogspot.com/2013/09/introduccion-los-acidos-y-bases.html
- http://enciclopedia.us.es/index.php/Base
- http://www.textoscientificos.com/quimica/inorganica/acidos-bases
- http://html.rincondelvago.com/acidos-y-bases_6.html
- https://es.wikibooks.org/química:-definiciones-de-compuestos-ácido/base