Célula troncal hematopoyética
| ||||||
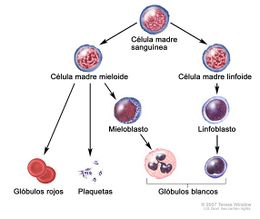
Célula troncal hematopoyética. Célula inmadura que se puede transformar en todos los tipos de células sanguíneas, como glóbulos blancos, glóbulos rojos y plaquetas. Las células madre hematopoyéticas se encuentran en la sangre periférica y en la médula ósea. También se llama célula madre sanguínea.
Sumario
Propiedades
Tres propiedades características de la CTH son, su multi-potencialidad, su capacidad de autorenovación y de proliferación. Por lo tanto, una célula troncal hematopoyética puede ser definida como células clonogénicas que poseen la propiedad de renovarse a sí mismas, de proliferar y de diferenciarse hacia todos los tipos de células sanguíneas.
Estudio de la célula troncal hematopoyética
Con el propósito de comprender la biología de las CTH, se han desarrollado diversos ensayos tanto in vivo como in vitro. La mayoría de estos sistemas permiten estudiar la potencialidad delas CTH para diferenciarse a células sanguíneas maduras o a sus precursores. En general, los ensayos in vitro miden la actividad de células más maduras, y los in vivo, generalmente detectan la actividad de células más primitivas, siendo necesario el trasplante o injerto de las células a un ambiente adecuado para producir la progenie.
Ensayos in vitro
Los sistemas de cultivo in vitro se pueden agrupar en dos categorías generales: los independientes de estroma y los dependientes de estroma:
- Cultivo in vitro independiente de estroma.
Entre los cultivos de este tipo está el ensayo de unidades de formación de colonias en cultivo (CFU-C) el cual detecta el crecimiento de células hacia una población más madura, comprometida al linaje eritroide o mieloide. Las colonias emergen luego de 5 a 14 días de cultivo en un medio semi-sólido, en presencia de uno o más factores de crecimiento. Una célula primitiva que posea potencialidad de multilinaje y un alto grado proliferativo en cultivo, es denominada una “célula formadora de colonias de alto potencial proliferativo” (“high proliferative potencial colony-forming cell”: HPP-CFC). En este caso, es posible observar colonias que se caracterizan por alcanzar un tamaño mayor a 0,5 mm de diámetro y por contener varias células de la línea mieloide.
Cultivo in vitro dependiente de estroma. Un ensayo que se correlaciona mejor con la actividad de las CTH, es el cultivo dependiente de estroma por largos períodos de tiempo o “long-term culture initiating cell” (LTC-IC). Las células primitivas, cultivadas sobre una capa de células estromales generan progenie aproximadamente a las 12 semanas de cultivo, teniendo la precaución de remover células semanalmente para evitar su sobrecrecimiento.
Esta alta capacidad de crecimiento es indicativa de la habilidad de auto-renovación continua que poseen las células primitivas. Ensayos in vivo Uno de los ensayos in vivo ampliamente utilizado, es el de formación de unidades de colonias en bazo o “colony-forming unit-spleen assay (CFU-S), desarrollado en 1961 por Till y McCulloch, el cual se basa en el trasplante de células de médula ósea o de bazo en ratones irradiados letalmente. Luego de 8 ó 12 días, los bazos de estos ratones se analizan para la detección de colonias, llamadas CFU-S8 y CFUS 12, respectivamente. Estas colonias representan dos poblaciones diferentes de células, las que generaron las CFU-S8 son predominantemente uni-potenciales y están compuestas primordialmente de células del linaje eritroide y las CFU-S12 están compuestas por varios tipos de células mieloides, incluyendo eritrocitos, megacariocitos, macrófagos y granulocitos.
Un ensayo más riguroso para evaluar actividad de CTH es el ensayo de repoblación por largos períodos de tiempo o “long term repopulation assay” (LTRA), ya que requiere que las células a analizar posean los criterios que definen una CTH. Las células donantes son multipotenciales si generan células del linaje linfoide (B y T) además del mieloide; poseen capacidad de auto-renovación si son capaces de mantener su actividad por periodos de tiempo prolongados y además, poseen la habilidad de proliferar.
En este ensayo, las células troncales se trasplantan en ratones que han sido irradiados letalmente para depletar las células hematopoyéticas endógenas y se evalúan a las 8 a 10 semanas post-trasplante. Luego de este periodo se espera que haya ocurrido un reestablecimiento de la hematopoyesis con células provenientes de las CTH trasplantadas. La incorporación de marcadores celulares en las CTH donantes comprueba que las células hematopoyéticas generadas en el ratón receptor son efectivamente progenie de las células trasplantadas.
El ensayo de re-trasplante de las CTH en un segundo animal puede ilustrar y cuantificar el proceso de auto-renovación, propiedad de CTH verdaderas.
Identificación y aislamiento de las células troncales hematopoyéticas
Una de las primeras aproximaciones utilizadas para aislar CTH de médula ósea se basó en técnicas de separación por densidad y tamaño. Ensayos de velocidad de sedimentación y centrifugación por gradientes de equilibrio demostraron que las células de CFU-S proliferantes poseen un tamaño que varía entre 7,3 a 9,2 μm de diámetro, en tanto que las células no proliferantes son de 7,0 μm de diámetro.
Enriquecer la obtención de CTH es requisito para su estudio e identificación. Una de las estrategias empleadas utiliza drogas que intervienen en el ciclo celular (vinblastina, 5-Fluorouracil, etc.) que depletan las células proliferantes de la médula ósea y enriquecen la población de células no proliferantes. A pesar de que esta estrategia enriquece la población de CTH y la actividad de CFU-S, la calidad de las células se ve afectada.
Un avance importante para la separación de CTH se logró mediante la utilización de la citometría de flujo o “fluorescence-activated cell sorter” (FACS). Este método utiliza un flujo citométrico que separa células en base a sus características físicas tales como tamaño o granularidad y además, por la presencia de marcadores de superficie celular. Anticuerpos específicos, marcados con moléculas fluorescentes, diseñados a reconocer proteínas de la superficie celular generan un patrón de fluorescencia por la incidencia de un rayo láser, permitiendo su identificación y subsiguiente separación.
Para la utilización de esta técnica fue necesario la identificación de proteínas que fueran expresadas específicamente en la superficie de la CTH. Uno de los primeros antígenos descubierto fue Thy-1 que se expresa en la superficie de las CFU-S de médula ósea de rata, hígado fetal y, en bajos niveles, en la médula ósea de ratón. En 1982, Muller-Sieburg y colaboradores desarrollaron una estrategia para la separación de CTH de ratón por FACS basados en un protocolo de selección negativa, en el cual utilizaron una mezcla de antígenos expresados en células B y T maduras, macrófagos y granulocitos. Combinando esta estrategia y la selección de células negativas para el antígeno de linaje (Lin neg) y con baja expresión de Thy-1 (Thy-1low), se obtuvieron CFU-S enriquecidas 200 veces.
En la actualidad, en ratón se aíslan CTH en base a fenotipos Sca-1pos, c-kitpos, Thy-1.1low, linneg, obteniéndose un enriquecimiento de 2000 veces para actividad de CTH.
Células troncales hematopoyéticas humanas se aíslan comúnmente en base a los marcadores de superficie CD34, CD38-, HLA-DR- y bajos niveles de Thy-1 y la ausencia del marcador de linaje Lin. Estas células poseen la capacidad de multilinaje en ensayos in vivo e in vitro (LTC-IC) y son capaces de mantener su propiedad de auto-renovación en ensayos de repoblación celular en un segundo huésped. Funcionalmente, CD34 es importante en la adhesión de las células hematopoyéticas al estroma de la médula ósea y en la interacción entre progenitores. El antígeno c-kit es un miembro de la familia de los receptores de tirosinas kinasas y el antígeno Sca-1(“stem cell activator”) y aunque su función no está totalmente esclarecida, aparentemente tendría una función en activación celular.
Aunque estos marcadores son útiles para la identificación y purificación de CTH humanas y murinas, no se ha encontrado una molécula cuya expresión sea definitoria de célula troncal, como lo es por ejemplo, la expresión de globina en células rojas. Es así como la expresión de CD34, además de encontrarse en células troncales, se encuentra en endotelio vascular y en algunos fibroblastos y c-kit se expresa en algunas células hematopoyéticas maduras, tales como mastocitos, megacariocitos, linfocitos pre-B, melanocitos, algunas células germinales, cerebro, estómago y testículo.
Fuentes
- Hematoligía Fisiopatología y Diagnóstico Iván Palomo G., Jaime Pereira G., Julia Palma B. Editorial Universidad de Talca, 2005.
- Palomo, I., Pereira. J., Koening, C. “Células y órganos del Sistema Inmune” en Fundamentos de Inmunología básica y clínica. Palomo, I.,
Ferreira, A, Sepúlveda, C., Rosemblatt, M., Vergara, U. (Eds). Cap. 3 Editorial Universidad de Talca, 2002.
- Bono, M.R. “Citoquinas” en Fundamentos de inmunología básica y clínica, Palomo, I., Ferreira, A., Rosemblatt, M., Sepúlveda, C. y
Vergara, U. (Eds). Editorial Universidad de Talca. Capítulo 10, 1998.