Histidina
| ||||||
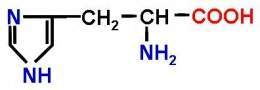
Histidina. Es un aminoácido básico, pero es una base débil. Su símbolo en código de una letra es H y en el de tres letras His. Interviene en centros activos de enzimas y es útil en muchas proteínas por su capacidad de no estar cargada a pH fisiológico y pasar a estado iónico a pH ácido. La histidina mediante una decarboxilasa se transforma en histamina. Este aminoácido esencial, pero mayoritariamente solo en niños. Se encuentra abundantemente en la hemoglobina.
Sumario
Funciones que desempeña
Estas son algunas de las funciones que la histidina, realiza en el organismo:
- Ayuda a combatir algunos de los efectos negativos de la artritis reumatoide, por ejemplo la inflamación y la falta de movilidad.
- Ayuda en la desintoxicación de metales pesados.
- Ayuda en el tratamiento de la impotencia y la frigidez.
- Ayuda a mejorar la respuesta inmunitaria.
- Ayuda a evitar los vómitos en el embarazo.
- Importante para el mantenimiento de las vainas de mielina que protegen las células nerviosas.
- Es necesario para la producción tanto de glóbulos rojos y blancos en la sangre.
- Protege al organismo de los daños por radiación.
- Reduce la presión arterial.
Consecuencias de su déficit
Su carencia puede ocasionar una serie de trastornos en el organismo, estos son algunos de ellos:
- Mayor predisposición a los vómitos durante el embarazo.
- Que la respuesta inmunitaria sea más deficiente.
- Mayor predisposición a la acumulación de radicales libres.
Propiedades químicas
El aminoácido tiene un pKa de 6,5. Esto significa que, pequeñas variaciones del pH fisiológico cambiarán su carga total. Por debajo de un pH de 6, el anillo imidazol está mayoritariamente protonación, con carga positiva. El anillo imidazol es también hidrocarburo aromático.
Durante la catálisis, el nitrógeno básico de la histidina es capaz de captar un protón de la serina, tironina y cisteína, por eso forma parte del centro catalítico de determinados enzimas.
Su cadena lateral está cargada positivamente (aminoácido básico) a valores de pH fisiológico. De los veinte alfa-aminoácidos, únicamente la histidina (con un pkH=6) ioniza dentro de la escala de pH fisiológicos. A un pH de 6, su grupo lateral imidazol sólo está cargado en un 50% lo que hace que la histidina sea neutra en un extremo básico del espectro de pH fisiológico. Este hecho tiene como consecuencia que las cadenas laterales de la histidina participen en las reacciones catalíticas de las enzimas.
En lo que respecta a su papel en la molécula de hemoglobina, el quinto ligando del hemo Fe(II) es HisF8, la histidina proximal (cercana). En la oxihemoglobina el Fe(II) está posicionado o,22 Å fuera del plano del hemo de la lado de la histidina proximal y, además, está coordinado por oxígeno. La histidina distal (distante) se une mediante un puente de hidrógeno al oxígeno. En la hemoglobina la sexta posición del ligando Fe (II) se movió hasta un punto de 0,55 Å fuera del plano del hemo.
Se degrada por alfa-cetoglutarato, aunque la conversión de la histidina en glutamato es más complicada respecto a la del resto de aminoácidos que se degradan mediante esta reacción. Se desamina de forma no oxidativa, luego se hidrata y su anillo imizol se cliva para formar N-formiminoglutamato. Luego el grupo formimino transfiere el tetrahidrofolato para formar ácido glutámico y N5-formimino-tetrahidrofolato.
Alimentos ricos en Histidina
Orígen animal
- Carnes
- Pollo
- Hígado de ternera
- Mortadella
- Pescados
- Lácteos
- Leche en polvo descremada
- Huevos
Orígen vegetal
Uso en algunas enfermedades
Estas son algunas de las enfermedades donde su uso, puede estar indicado.
- Artritis reumatoide
- Frigidez
- Hipertensión arterial
- Infecciones
- Impotencia
- Intoxicaciones por metales pesados
- Neuritis
- Sinovitis tóxica
- Vómitos en el embarazo.