Pata prieta
| ||||||||
Pata prieta (Phytophthora nicotianae Breda de Haan). Agente causal de la enfermedad Pata prieta que afecta fundamentalmente a las raíces y la base del tallo, aunque puede afectar toda la planta, dándole una coloración oscura, de ahí, su nombre común en las plantas de tabaco. Los síntomas varían con la edad de la planta y las condiciones climáticas.
Sumario
- 1 Origen y distribución geográfica
- 2 Daños ocasionados
- 3 Ubicación taxonómica, descripción del agente causal
- 4 Síntomas de la enfermedad en el cultivo del tabaco
- 5 Variabilidad morfo-cultural de p. nicotianae
- 6 Razas y variabilidad patogénica de p. nicotianae
- 7 Variabilidad molecular en el género phytophthora
- 8 Fuentes
Origen y distribución geográfica
La enfermedad pata prieta, causada por el patógeno P. nicotianae, fue descrita por primera vez por Van Breda de Haan en 1896, en semilleros de tabaco en Java. En 1915, se notifica en el sur de Georgia en los Estados Unidos y en 1922 se había extendido a todo el distrito tabacalero de la Florida.
En 1930, se informa en las áreas de tabaco Flue-Cured y Burley en Carolina del Norte, Tennessee y Kentucky, y permaneció hasta 1937, fecha en que se le localizó en el condado de Pitt, unas 200 millas más al este, informándose más tarde en más de 20 países (Lucas, 1975). La enfermedad fue detectada en Honduras y Corea (Nielsen, 1992); en Sudáfrica (Lacourt, 1992); en Zimbabwe y Australia (Nielsen, 1995). Áreas tabacaleras con grandes afectaciones fueron informadas en Filipinas (Truong, 1996) y en China (Ho y Lu, 1997).
Daños ocasionados
En la actualidad, la enfermedad está presente en todos los suelos donde se cultiva tabaco (Sullivan, 2005 b). Esta enfermedad puede afectar casi toda la planta, por lo que es considerada uno de los problemas más serios en el cultivo del tabaco (Nesmith, 2004). Históricamente, se han producido grandes daños en el tabaco en las áreas de América del Norte originadas por P. nicotianae.
En La Florida, en 1993, las pérdidas ascendieron a $ 1 003 278 (Kucharek, 1995); y en Georgia a $ 750 000 (Bertrand, 1995). En Carolina del Norte, entre la campaña 1999-2001 en tabaco Flue-Cured, el 17% del total de las pérdidas por enfermedades se le atribuyeron a este patógeno (Melton y Broadwell, 2003). Esta enfermedad es considerada la más destructiva y extendida en las áreas tabacaleras del mundo (Li y Bass, 2006).
Presencia de nematodos patógenos en las plantas de tabaco
La severidad de la enfermedad pata prieta se acrecienta con la presencia de nematodos patógenos a las plantas de tabaco. Se ha comprobado que la resistencia de cultivares de tabaco disminuye drásticamente en presencia de especies de Meloidogyne. Estudios con M. incognita y M. javanica han demostrado que las interacciones entre estos parásitos y P. nicotianae provocan grandes pérdidas, aún en variedades de tabaco resistentes (Powell y Nusbaum, 1960) citados por Sullivan (2004).
En Cuba, la enfermedad se observó por primera vez en 1905, pero el agente causal no fue aislado e identificado hasta 1957 (Peñalver y García, 1988). En 1959, se inicia el programa de mejoramiento genético dirigido a la obtención de nuevas variedades cubanas de tabaco negro, donde se contempló como uno de los criterios de selección la resistencia a las principales enfermedades, y dentro de éstas, la pata prieta (Espino, 2000 b). En la campaña tabacalera 1983-1984 se produjo un incremento de la incidencia de esta enfermedad, causando epifitotias en semilleros de tabaco, principalmente en la provincia de Pinar del Río.
En las campañas posteriores, el incremento de la enfermedad fue significativo. Tanto en semilleros como en plantaciones, se produjeron daños severos de importancia económica, acompañados de una elevada contaminación en los suelos por la continua siembra de tabaco en las regiones de mayor tradición en el país (Fernández, 1998). En la actualidad, la enfermedad está presente en todas las regiones tabacaleras del país (CNSV, 1995).
Los trabajos de mejoramiento genético realizados en Cuba han proporcionado en gran medida un control eficiente de la enfermedad. Sin embargo, en los semilleros, donde esta resistencia no se expresa, las afectaciones siguen siendo considerables, aún cuando se aplica un adecuado control fitosanitario.
En las plantaciones tabacaleras, donde el control químico resulta prohibitivo desde el punto de vista económico, esta enfermedad también constituye un problema. Por ejemplo, en la campaña tabacalera 2002-2003, P. nicotianae causó pérdidas de un 10,4 % (Espino, 2002 b; 2003 a). Informes más recientes demuestran el aumento considerable de la enfermedad pata prieta con un 45,95% de afectaciones del total del área sembrada, donde las provincias de Pinar del Río, La Habana, Villa Clara y Las Tunas reflejaron los mayores daños (CNVS, 2007).
Ubicación taxonómica, descripción del agente causal
El organismo causante de la enfermedad pata prieta pertenece al:
- Reino Chromista
- Phylum Oomycota
- Clase: Oomycete
- Orden Pythiales
- Familia: Pythiaceae
- Género: Phytophthora
- Especie: P. nicotianae Breda de Haan (Erwin y Ribeiro, 1996)
Descripción
La descripción de Phytophthora nicotianae hecha por Breda de Haan en 1896 no fue adecuada, al informarse la presencia de anteridios paraginos, debido a la mezcla de P. nicotianae con una especie de Pythium. En 1913, Dastur denominó Phytophthora parasitica a una nueva especie de un hongo detectado en plantas de ricino (Ricinus communis L.) y no lo asoció con el descrito por Breda de Haan, debido a que el hongo que describió poseía el anteridio anfigino, diferente de la descripción realizada por Breda de Haan (Ho y Jong, 1989).
Leonian (1925) citado por Erwin y Ribeiro (1996), cuestionó el estatus taxonómico de P. nicotianae porque este tenía el anteridio anfigino igual que P. parasitica. Ashby (1924) debido a este error, suprimió el nombre de P. nicotianae y lo sustituyó por P. parasitica. Más tarde, Tucker (1931) citado por Ho y Jong (1989), basándose en la patogenicidad, designó a los aislamientos de tabaco como P. parasitica var. nicotianae, lo cual se considera un error porque desplazó el epíteto nicotianae que tenía prioridad sobre parasitica y además, porque la patogenicidad no puede ser usada como base para designar una variedad, según el “Código Internacional de Nomenclatura Botánica” (Voss et al., 1983, citados por Erwin y Ribeiro, 1996).
En 1963, Waterhouse, reemplazó el nombre de P. parasitica por P. nicotianae Breda de Haan, porque este último tenía prioridad sobre P. parasitica y después separó P. nicotianae en dos variedades morfológicas: P. nicotianae var. parasitica y P. nicotianae var. nicotianae.
Posteriormente, Tsao y Sisemore (1978), cuando compararon 19 aislamientos, no observaron diferencias morfológicas entre las variedades descritas por Waterhouse (1963). Ho y Jong (1989), de igual forma compararon 13 aislamientos de tabaco y 22 aislamientos de otros hospedantes y concluyeron que entre las denominaciones var. nicotianae y var. parasitica no había diferencias morfológicas.
Estos autores abogaron por la eliminación de ambos epítetos; aunque consideraron más adecuado denominar la especie como P. parasitica, por su extenso uso (Ricci et al., 1992; Benson, 1993). Numerosos estudios se han realizado con respecto a la variación entre P. nicotianae y P. parasitica, aplicando diferentes métodos bioquímicos (McIntyre y Hanlin, 1978; Erselius y Vallavieille, 1984; Oudemans y Coffey, 1991), métodos serológicos (Morton y Dukes, 1967; Cristinizio y Noviello, 1983) y análisis de ADN mitocondrial y cromosómico (Foster et al., 1990) citados por Hall, (1993). Hall (1993), en la descripción efectuada de P. nicotianae, con el empleo de 31 características morfológicas, fisiológicas y bioquímicas; concluyó que no existen diferencias significativas para que se mantengan las dos variedades. El mismo autor propone que el término de variedad pudiera ser eliminado, defendiendo más la terminología de forma especial (f. sp). para la identificación de los aislamientos provenientes de tabaco.
Erwin y Ribeiro (1996) refieren que el nombre P. nicotianae debe prevalecer de acuerdo con el “Código Internacional de Nomenclatura Botánica” vigente. Sin embargo, ambos nombres siguen empleándose en la actualidad. Resúmenes incluidos en los Programas Agrícolas computarizados entre 1970-1994, muestran 907 citas con el nombre de P. parasitica y 536 como P. nicotianae (Erwin y Ribeiro, 1996). Según Erwin y Ribeiro (1996), la morfología del patógeno es la siguiente: Micelio e hifas: Cultivos en madejas radiales, ondulados o en forma de rosetas. Las hifas aéreas son rectas incoloras y no septadas cuando jóvenes, pero ocasionalmente seudo-septadas cuando viejas.
Los contenidos de las hifas son granulares, pero se hacen vacuolados con la edad. El micelio sumergido en el medio de cultivo puede ser recto o irregular con muchos hinchamientos y vesículas hifales. Estos hinchamientos pueden ser solitarios o dispuestos en varias cadenas, frecuentemente con tramos de hifas intermedias, de pequeños a medianamente grandes. Presenta excrecencias radiales frecuentemente numerosas, cortas o largas y filamentosas.
- Clamidosporas: De pocas a muchas, mayormente solitarias. Pueden aparecer más temprano o más tarde, terminales o intercalares. Son esféricas, con excrecencias filamentosas radiales, frecuentemente cortas. La pared puede ser fina o medianamente gruesa. Las clamidosporas están llenas de protoplasma granuloso y con diámetro promedio de 29, 5 µm.
- Esporangióforos: No ramificados o ramificados monocasial o monopodialmente. Cuando la ramificación es monopodial, nacen a menudo una o varias ramas laterales de unos engrosamientos nudosos.
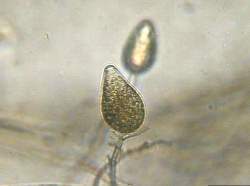
- Esporangios: Aparecen muchos en el cultivo sobre agar, terminales en el portador, esporádicamente intercalares o laterales. Mayormente son simétricos. Pueden tener forma elipsoidal, ovoide o piriforme invertidos o irregulares. Aparecen excrecencias radiales filamentosas muchas veces cortas o largas; con papila hemisférica muy prominente, con dos o raras veces tres papilas, puede aparecer una base redondeada solo en algunos aislados. Los esporangios tienen un tamaño variable (23-79 a 1654µm), con promedio 43,9 x 33,0 µm. Estos pueden producir de 5 a 30 pequeñísimas zoosporas en medio líquido que tienen forma de riñón y con flagelos. Su tamaño varía entre 7-11 µm.
- Oogonios: Aparecen individuales, son muy pocos y solo están en ciertos aislamientos. Son esféricos o casi esféricos y presentan asiento con pedicelo mayormente corto. Tienen un tamaño promedio de 31,8 µm.
- Anteridios: Medianamente grandes de forma esférica a ovoide. Son del tipo anfígenos o sea, el portador del oogonio se desarrolla a través del anteridio.
- Oosporas: La pared mide de 1,0 a 2,3 µm. Miden como promedio 26,7 µm. Son del tipo aplerótico porque ocupan solo parte del oogonio, ubicándose asimétricamente.
Síntomas de la enfermedad en el cultivo del tabaco
Pata prieta es una enfermedad que afecta fundamentalmente a las raíces y la base del tallo, aunque puede afectar toda la planta, dándole una coloración oscura, de ahí, su nombre común en las plantas de tabaco. Los síntomas varían con la edad de la planta y las condiciones climáticas.
En el semillero, las plantas jóvenes de tabaco son muy susceptibles a la enfermedad, son totalmente afectadas y el tallo se torna pardo oscuro o negro. El sistema radicular en su totalidad puede infectarse, tomar un color negro y la planta muere (Lucas, 1975).
En plantación pueden identificarse diferentes tipos de síntomas (Fernández, 1998):
- Afectación en las raíces, que se tornan necróticas. Las plantas se marchitan ligeramente durante el período más caluroso del día, pero se recuperan por la noche. Se observa un desarrollo raquítico, el sistema radicular es destruido y provoca pérdidas considerables en el cultivo.
- Ataque al tallo. Ocurre cuando hay resistencia en las raíces.
- Afectación de raíces y tallos. Provoca el marchitamiento rápido de la planta o la caída de las hojas. El patógeno avanza hacia el tallo hasta una altura entre 15-20 cm, la médula se seca, se torna de color pardo y se separa formando discos. Las pérdidas en este caso pueden ser elevadas.
- Tizón de la hoja. Es frecuente en períodos lluviosos, donde el inóculo presente en el suelo se pone en contacto principalmente con las hojas inferiores de la planta, debido a las salpicaduras del suelo provocadas por la lluvia.
Variabilidad morfo-cultural de p. nicotianae
En Phytophthora spp. se han notificado evidencias que demuestran la meiosis gametangial y la diploidía en su estado somático o vegetativo, lo que justifica la gran variabilidad en los representantes de este género (Shaw, 1983; Brasier, 1992). Se ha expresado que, aunque la mayoría de los caracteres morfológicos son bastante estables, estos pueden estar fuertemente influenciados por el medio ambiente, por lo que resultan poco confiables para los estudios de variabilidad (Webster, 1994).
También se ha observado que las variaciones en las mediciones realizadas a las estructuras asexuales y sexuales de P. nicotianae pueden estar influenciadas por el medio de cultivo, la edad y las condiciones de incubación (Shew y Lucas, 1991). Hall (1993) corrobora estos resultados y demuestra la alta variabilidad en los aislamientos cuando fueron medidas estas estructuras. Sin embargo, este autor considera que las características culturales ó patrón cultural de la colonia y el diámetro de la misma, son parámetros altamente reproducibles, concediéndole un valor adicional a los estudios culturales de la colonia para ser usados en la clasificación de P. nicotianae a nivel macroscópico.
Los medios de cultivo como Harina de Maíz Agar (HMA), Papa Dextrosa Agar (PDA) y Zanahoria Agar (ZA), han sido ampliamente utilizados para establecer patrones culturales a nivel de especie en el género Phytophthora (Erwin y Ribeiro, 1996). A pesar de que los patrones culturales identificados son estables, estos varían dependiendo del medio de cultivo y la temperatura de incubación. Waterhouse (1970) citado por Erwin y Ribeiro (1996), concluyó que la forma de la colonia depende del ángulo y extensión de la ramificación de la hifa y que esta variabilidad se encuentra bajo el control citoplasmático.
Los estudios de caracterización cultural de la colonia han servido para comparar aislamientos de P. palmivora E. J. Butler y otras especies relacionadas. Además, han posibilitado la diferenciación rápida entre especies de P. nicotianae y P. citrophthora (R.E. Sm & E.H. Sm) Leonian, ambos patógenos de plantaciones de cítricos (Erwin y Ribeiro, 1996). En Cuba, no se han realizados estudios culturales en la población de este patógeno y solo existen informaciones sobre las diferencias entre las colonias de tres aislamientos (Peñalver, 1985), por lo que las características culturales de P. nicotianae y la presencia de grupos culturales se desconocen. Debido a esta falta de información, no es posible relacionar estos aspectos con algunos obtenidos por otros autores, ni con otras características de valor práctico como la agresividad; notificadas en otras interacciones planta-patógeno (Kuramae-Izioka et al., 1997; Pérez, 2003).
Razas y variabilidad patogénica de p. nicotianae
Presencia de razas de p. nicotianae
Raza (fisiológica) es el término aceptado para describir patotipos especializados del patógeno en diferentes genotipos del hospedante y fue descrito por Stakman en 1914 para hongos biotróficos (Pérez, 2003). Sin embargo, existen diferentes criterios en cuanto a este término. Vanderplank (1978) distinguió dos tipos de razas: la virulenta y la agresiva, donde la primera coincide con la raza fisiológica descrita por Stakman.
Caten (1987) citado por Pérez (2003), por su parte, informó el terminó de raza como ambiguo, estableciendo cuatro tipos de razas: simples, biológicas, fisiológicas y agresivas. La presencia de razas está ampliamente informada en las diferentes especies del género Phytophthora (Lamour et al., 2003; Jackson et al., 2004; Gallup y Shew, 2006). Las razas fisiológicas son consideradas como biotipos patogénicos a ciertos cultivares de plantas, pero no a otros. El término raza patogénica, es comúnmente usado para la mejor comprensión del fenómeno y consiste, en que la misma es controlada por un solo gen dominante (Erwin y Ribeiro, 1996). Los especialistas del género Phytophthora han aceptado el término de razas fisiológicas, razas patogénicas o simplemente raza para definir aquellos aislamientos con patogenicidad diferencial en distintas variedades de una misma especie de hospedante (Csinos, 2005; Shew et al., 2005). Para P. nicotianae se han descrito desde hace algún tiempo cinco razas fisiológicas (0, 1, 2, 3, 4) y son definidas por su habilidad de infectar cultivares con diferentes genes de resistencia (Sullivan, 2004).
La especialización fisiológica para p. nicotianae fue informada por primera vez por Apple (1962), quien denominó raza 0 a aquellos aislamientos no patogénicos a la especie Nicotiana plumbaginifolia Vir. y líneas derivadas de ésta, diferenciándolos de los aislamientos raza 1, como aquellos aislamientos que causan enfermedad a esta especie. La raza 1 es considerada como la más severa y nociva dentro de las informadas para este patógeno ( Li y Bass, 2006). Desde hace muchos años, se conoce como interactúan ambas razas, y se demostró como emerge la raza 1 en una población identificada y previamente diagnosticada como raza 0, en respuesta a la presión de selección por la siembra de N. plumbaginifolia o de variedades que poseían el gen de resistencia a la raza 0 (Apple, 1962; 1967; Hendrix y Flowers, 1967).
Recientemente, se han confirmado estos resultados en Carolina del Norte y en Georgia, donde la siembra de variedades de tabaco con alta resistencia a la raza 0 ha originado un aumento rápido en poblaciones de la raza 1 de P. nicotianae (Csinos, 2005; Shew et al., 2005; Sullivan et al., 2005 b). Prinsloo y Pauer (1974) identificaron la raza 2 en el Sur de África, donde el cultivar N. tabacum var. A-23, con resistencia a las razas 0 y 1, es susceptible a esta raza, la cual continúa presente en estas zonas tabacaleras, sin estar informada en ningún otro país (Sullivan, 2004). De manera similar, la raza 3 está restringida a las zonas tabacaleras de Connecticut, Estados Unidos (McIntetyre y Taylor, 1978), donde la especie N. nesophila Johnston tiene un comportamiento diferencial frente a las distintas razas.
Esta especie de Nicotiana es susceptible a las razas 0 y 1 y resistente a la raza 3 (Erwin y Ribeiro, 1996). En áreas de Carolina del Norte y Kentucky, se ha informado una nueva raza para P. nicotianae, donde el gen de resistencia Phl de la N. longiflora Cav. está ampliamente extendido. La nueva raza, denominada raza 4, fue identificada a partir de la habilidad de aislamientos del patógeno para superar el gen de resistencia de la Nicotiana longiflora, pero no el gen Php de N. plumbaginifolia, a diferencia de la raza 1 que supera los genes de la N. plumbaginifolia y N. longiflora y de la raza 0 que no es capaz de vencer estos genes (Gallup et al., 2006).
Otros estudios demostraron que la raza 4 fue recuperada en áreas de Carolina del Norte y Virginia, de variedades con resistencia parcial al patógeno, lo cual contradice la afirmación de que bajo tales condiciones no deben aparecer nuevas razas por proceso de selección natural. A partir de este hallazgo, se realizaron inoculaciones con las razas 0 y 4, en parcelas independientes con variedades de bajos, intermedios y altos niveles de resistencia parcial, las cuales trajeron como resultado la obtención de una mezcla de razas 0 y 4 en iguales proporciones en la descendencia, demostrando la estabilidad entre las razas (Gallup y Shew, 2006).
Variabilidad patogénica de p. nicotianae
Todas las especies del género Phytophthora son patógenas de plantas y afectan cultivos importantes a escala mundial. Hay especies que se han especializado en un determinado hospedante como: P. fragarie Hickman, P. phaseoli Thaxt.
En otros casos, pueden infectar a una amplia gama de hospedantes como es el caso de P. nicotianae, de la que existen aislamientos especializados en un hospedante, por ejemplo tabaco (Colas et al., 1998). Los resultados en la patogenicidad de P. nicotianae en diferentes géneros de plantas son bien controvertidos.
Tucker en 1931 citado por Erwin y Ribeiro (1996), comprobó el desarrollo de la enfermedad por inoculación artificial de aislados procedentes de tabaco, sobre un gran número de cultivos, pero solo con poca virulencia. Sin embargo, cuando diferentes especies de plantas como tomate (Lycopersicon esculentum Mill = Solanum lycopersicum L.), papa (Solanum tuberosum L.) y chile (Capsicum frutescens Ktze.), fueron sembrados en suelos altamente infestados de forma natural con P. nicotianae, la infección no ocurrió.
Aislados de P. nicotianae obtenidos de pimientos morrones (Capsicum annuum L.), han resultado patogénicos en tomate y berenjena (Solanum melongena L.), sin provocar síntomas en tabaco (Allagui, 1999). Existen otros estudios relacionados con la patogenicidad diferencial de aislados de P. nicotianae obtenidos de otros cultivos, los cuales demuestran la especialización de los mismos con el hospedante. Larcourt (1992) y Larcourt et al., (1994) comprobaron la presencia de algunos aislamientos especializados en infectar tabaco y otros a tomate relacionando estas diferencias, con la excreción de elicitinas. Las elicitinas son pequeñas proteínas secretadas por todas las especies de Phytophthora, las cuales inducen respuestas de hipersensibilidad y activan mecanismos de defensa en plantas de tabaco, protegiéndolas de infecciones posteriores de patógenos (Lherminier et al., 2003).
Resultados novedosos han sido obtenidos en P. nicotianae, donde se ha encontrado que la producción de elicitina, está restringida solo a los aislados de P. nicotianae no patógenos en tabaco o con muy baja virulencia en el cultivo, los que sí resultan patogénicos en tomate. En estos estudios se concluye que los aislamientos con alta virulencia y especializados en tabaco no producen elicitinas (Larcourt, 1992; Yu, 1995; Colas et al., 1998; Colas et al., 2001). Estos resultados demuestran que el término de forma especial que se usa para los aislamientos patogénicos a tabaco, pudiera tener un basamento genético (Sullivan, 2004).
Dentro del grupo de aislados especializados en infectar tabaco, también se ha informado variabilidad patogénica (Colas et al., 2001; Su Ning y Zhang, 2001; Zhang et al., 2003). Estos resultados también se han comprobado en el Sur de África, donde se ha constatado gran variabilidad en la agresividad de aislamientos como resultado de inoculaciones en cultivares con diferentes niveles de resistencia al patógeno (Van Jaarsveld et al., 2002). En Georgia, se ha informado variabilidad patogénica dentro de las razas 0 y 1 (Csinos, 2004), aunque investigaciones recientes han descrito mayor estabilidad para la raza 1 del patógeno (Gallup et al., 2006).
En Cuba, los estudios de identificación racial y caracterización de la patogenicidad del hongo son escasos. En el país, Peñalver (1983) informó la presencia de la raza 0 en aislamientos obtenidos en la década del 70; año en que no se contaba con las variedades comerciales que se encuentran en la actualidad en explotación. Aislamientos cubanos donados por Peñalver a la colección internacional de P. nicotianae de Bergerac, Francia, también han sido identificados como raza 0 (Lacourt, 1992; Lacourt et al., 1994; Bonnet et al., 1994; Colas et al., 1998). El aislamiento cubano de P. nicotianae con número de referencia 309 en la colección de Bergerac, Francia, fue clasificado por Robin y Guest (1994) como raza 1 utilizando la variedad Flue-Cured NC 2326. Sin embargo, estos mismos autores refieren que dicho aislamiento fue clasificado por Peñalver (1983) y por Bonnet et al. (1994) como raza 0.
La variedad NC 2326 utilizada para la identificación de razas por Robin y Guest (1994) exhibe una resistencia parcial o moderada a las razas 0 y 1 (Goins y Apple 1970; Wernsman et al., 1973; Sullivan, 2004); por lo que esta variedad no es aceptada como diferenciadora entre las razas 0 y 1. Esto evidencia que el aislamiento cubano 309 clasificado como raza 1 sobre la variedad NC 2326 (Robin y Guest, 1994), no fue clasificado correctamente. Estudios más recientes notificaron variabilidad patogénica entre ocho aislamientos de la raza 0 e informan la patogenicidad de aislamientos de P. nicotianae obtenidos de otros hospedantes en tabaco (Fernández, 1998).
Las afectaciones inusuales de la enfermedad pata prieta en variedades resistentes de tabaco, conjuntamente con la única información que se posee en los estudios de razas realizados hace más de 20 años y los escasos aislamientos estudiados para conocer la virulencia de este hongo, justifican los trabajos dirigidos a conocer la variabilidad patogénica de P. nicotianae, con los cuales se puedan generar conocimientos útiles para los programas de mejoramiento genético y para el manejo de la enfermedad.
Comportamiento de p. nicotianae frente al metalaxyl; como forma de variabilidad
A finales de la década del 70 fueron descubiertas las fenilaminas, que incluyen las acilamidas (metalaxyl, furalaxyl y benalaxyl), los butyrolactones (ofurace y milfuran) y los oxazolidinones (oxadixyl). El metalaxyl es utilizado en el control de los hongos del orden Peronosporales, actualmente Pythiales (Van-Jaarsveld y Lowveld, 2002), actuando en la inhibición de la síntesis de ARN (Wollgiehn et al., 1984, citados por Thomidis y Llena (2001). Entre los aislamientos de las especies que integran el género Phytophthora está notificada una amplia variabilidad en la respuesta frente al metalaxyl (Csinos y Bertrand, 1994). Investigaciones con P. infestans (Mont. de Bary) y P. nicotianae concluyeron que la resistencia al metalaxyl es controlada por un gen simple con dominancia incompleta (Erwin y Ribeiro, 1996; Dawn et al., 1999).
En el sur de África, se ha demostrado la amplia sensibilidad de los aislamientos, con excepción de aquellos que proceden de áreas donde las aplicaciones del fungicida fueron muy reiteradas, los cuales han resultado resistentes al producto (Van-Jaarsveld y Lowveld, 2002). En estudios con 877 aislados, Shew (1985) demostró que continuas aplicaciones de metalaxyl en los suelos infectados por P. nicotianae trajeron como resultado la necesidad de un incremento, en solo tres años, de la dosis de 0,4 a 1,2µg/mL del ingrediente activo para controlar la infección.
Otros resultados evidencian que los aislamientos más resistentes causan daños más severos y esta resistencia se mantiene por varios años, aún sin el empleo del fungicida (Benson y Grand, 2000). En estudios de caracterización de poblaciones de P. nicotianae y otras especies del género, no se ha observado ninguna correlación entre la resistencia al fungicida y el origen geográfico o el grupo de compatibilidad sexual (Gisi y Cohen, 1996; Cristinzio y Testa, 1998). Sin embargo, aunque se conoce que no existe ninguna relación entre el número de genes o la composición de los genes de virulencia y la sensibilidad a las fenilaminas, la misma todavía es discutida, por lo que Gisi y Cohen (1996) sugieren efectuar estudios más profundos en este sentido.
En Cuba, se detectó por primera vez la resistencia de P. nicotianae al metalaxyl a finales de 1983, en la provincia de Pinar del Río, situación que se ha mantenido por más de 10 años, con informes posteriores en 1984 en la provincia de La Habana y en 1987 en la provincia de Villa Clara (Muiño, 1997).
En todos los casos, la presencia de cepas resistentes provocó afectaciones más severas en el cultivo, la alta presión de inóculo y las aplicaciones sistemáticas del fungicida favorecieron la aparición de poblaciones resistentes en el campo, resistencia que se mantiene por varios años. Para la clasificación de la respuesta al metalaxyl en P. nicotianae se han establecido diferent es categorías que oscilan, de sensibles a altamente resistentes (Muiño, 1997). En la actualidad, el uso de este producto está muy restringido debido a la gran presión de selección que ejerce sobre las poblaciones de las especies de Phytophthora (Van-Jaarsveld, 2002). Sin embargo en los estudios de caracterización, se emplean con frecuencia las diferentes respuestas del metalaxyl como una variable más, para describir a los aislamientos en las diferentes especies del género Phytophthora (Gómez, 2005; Bhat et al., 2006; Silvar et al., 2006).
En el país, se han efectuados profundo estudios sobre el comportamiento de este patógeno frente al fungicida. No obstante, este parámetro no ha sido utilizado como una variable más en los estudios de caracterización del patógeno. Por estas razones, se hace necesario efectuar estudios en este sentido e incluir aislamientos procedentes de diferentes regiones tabacaleras y la posible relación de los resultados del mismo con otras características del patógeno.
Variabilidad molecular en el género phytophthora
En el género phytophthora se han empleado diferentes técnicas moleculares con contribuciones importantes y resultados novedosos en el campo de la Fitopatología como: en el diagnóstico, la taxonomía, filogenia, mapeo de genes y en la evolución poblacional de diferentes especies, además de jugar un papel primordial en estudios de variabilidad de diferentes especies del género (Kamoun, 2003; Sullivan, 2004; Kang et al., 2005).
Una de las técnicas más empleada para el diagnóstico e identificación de las especies del género Phytophthora, es la amplificación del Espaciador Interno Transcripto (ITS, Internal Transcribed Spacer). Las regiones ITS son segmentos altamente conservados en todos los organismos, por lo que pequeños cambios pueden ser utilizados para clasificar o diferenciar organismos incluso a nivel de especie (Martín et al., 2000).
Los estudios en las regiones ITS han sido ampliamente utilizados en diferentes hongos patógenos (Lübeck et al., 2000). En Phytophthora, como en la mayoría de los organismos eucarióticos, los genes ADNr comprenden una familia de multigenes, en los cuales las copias se colocan en tándem repetidos. Cada tándem consiste en una sola unidad de trascripción que incluye los genes de la subunidad pequeña 5.8 S y de la subunidad grande separada por dos regiones espaciadoras de transcriptos internos ITS I e ITS II (Drenth e Irwin, 2005).
Lee y Taylor (1992) fueron los primeros en estudiar la problemática que existe en la taxonomía del género Phytophthora, comparando las secuencias de las regiones de ITS I y II. Posteriormente, diferentes especies de Phytophthora han sido reclasificadas taxonómicamente, usando los datos de las secuencias de los ITS (Cooke y Duncan, 1997; Cooke et al., 2000; Forster et al., 2000).
Las regiones amplificadas por los cebadores PINF e ITS 5 han sido una herramienta rápida y sensible para la detección en suelo de diferentes propágulos de P. infestans (Wangsomboondee y Ristaino, 2002) y la detección en suelo y agua de propágulos de P. nicotianae (Kong et al., 2003), uno de los objetivos para los cuales han sido empleados. A fin de detectar dentro de esta región mayor polimorfismo, se ha introducido una variante o modificación de los RFLPs (Polimorfismo de la Longitud de los Fragmentos de Restricción, Restriction Fragment Lenght Polymorphism), donde se amplifican los ITS y el producto es cortado con enzimas de restricción. A partir de esta modificación, distintos estudios de variabilidad se han realizado en el mundo.
Ristaino et al. (1998) con el empleo de esta técnica pudo diferenciar aislamientos de P. nicotianae de cítricos, de otros pertenecientes a P. palmivora y de P. citrophthora. Aislamientos de P. nicotianae provenientes de tabaco, tomate, cítricos (Citrus spp.) y plantas ornamentales, mostraron el mismo patrón de amplificación de las regiones ITS y ADNr 5.8 S donde fueron visibles 4 fragmentos después de la digestión con la enzima de restricción RsaI. Este análisis de restricción con RsaI del ADN amplificado no permitió separar grupos de aislamientos de P. palmivora de P. citrophthora, aislados de cítricos, por presentar ambos grupos patrones de restricción similares.
La secuenciación de ADN es una herramienta más sensible aún, que las mencionadas anteriormente. La aplicación de esta técnica en 119 aislamientos permitió corroborar el valor limitado que tienen los caracteres morfológicos como por ejemplo: el tamaño de las esporas, para la clasificación de las especies dentro del género. Sin embargo estos autores encontraron relación entre los tres grupos formados con los datos obtenidos con la secuenciación del ADN y la morfología del esporangio (papilados, semipapilados y no papilados) (Drenth e Irwin, 2001).
En p. parasitica, patógeno de cítrico, las amplificaciones de las regiones ITS I y II, usando diferentes combinaciones de cebadores para su amplificación y posterior secuenciación, produjeron segmentos de 812 a 860 pb. Las secuencias nucleotídicas de estos fragmentos mostraron un 99,3 y 100 % de homología entre los aislamientos analizados y un 98,1 a 99,9% con las obtenidas de los aislamientos de P. nicotianae (= Phytophthora parasitica) encontradas en el Banco de Genes (gi|8927482), lo cual sugiere que ésta es una buena técnica para el diagnóstico confiable de P. parastica en cítrico (Días et al., 2006).
Para estimar la variabilidad interespecífica e intraespecífica en el género Phytophthora, se han utilizado algunas de técnicas, entre las cuales se destacan: Polimorfismo del ADN Amplificado al Azar (RAPD, Random Amplified Polymorphic DNA), RFLP (Ristaino et al., 1998; Forster et al., 2000; Martín et al., 2000).
Los resultados del análisis por RAPD de los seis grupos taxonómicos descritos por Waterhouse (1963) para el género actualmente vigente, se correspondieron con los seis grupos obtenidos del análisis de conglomerado realizado en base a los datos moleculares, demostrando la validez de esta técnica para los estudios taxonómicos del género (Zheng y Warrd, 1998). Aislamientos de P. cinnamomi Rands en China, fueron caracterizados molecularmente utilizando esta misma técnica, la cual detectó alto polimorfismo en el material estudiado, así como sus buenas posibilidades para ser empleada en la determinación de razas del patógeno (Chang et al., 1996).
La variación genética de P. capsici Leonian, examinada por la técnica de RAPD mediante ocho cebadores arbitrarios, generó 92 bandas polimórficas, logrando conformar tres grupos con los aislamientos procedentes de España, lo cual posibilitó además, establecer relaciones filogenéticas entre estos aislamientos y el resto de los aislamientos analizados (Silvar et al., 2006).
Con las técnicas RAPD y RFLP se ha podido detectar una alta diversidad genética para la mayoría de los aislamientos de las especies heterotálicas (P. cinnamomi, P. palmivora, P. cryptogea Pethybr y Lafferty y P. nicotianae), a diferencia de lo observado en las especies homotálicas como P. megasperma Drechs y P.cactorum J. Schröt (Drenth e Irwin, 2001).
Los análisis moleculares realizados en el ADN nuclear en diferentes especies de Phytophthora, por la técnica RFLP, demostraron mayor variabilidad entre aislamientos de P. nicotianae, a diferencia del realizado con el ADN mitocondrial (ADNmt). Sin embargo, para P. capsici, ambos tipos de análisis se correlacionaron, independientemente de la fuente de ADN empleada (Foster et al., 1990). La técnica de RFLP aplicada al estudio de diversidad genética en aislamientos de P. nicotianae provenientes de diferentes regiones del mundo, mostró que existe un mayor polimorfismo genético en la zona del Caribe, donde se encontraron los cinco grupos obtenidos por RFLP a diferencia de otras zonas del mundo, lo cual apunta hacia un proceso de diferenciación más amplio entre los aislamientos en esta zona geográfica (Larcourt et al., 1994).
En la actualidad, han surgido otras variantes más sensibles y rápidas basadas en la Reacción en Cadena de la Polimerasa (PCR, Polymerase Chain Reaction). La PCR en tiempo real fue comparada con ensayos de PCR convencionales y resultó ser más sensible y específica, y con mayores ventajas para el diagnóstico de especies de Phytophthora (Silvar et al., 2005; Tooley et al., 2006). Existen numerosos trabajos (Colas et al., 1998; Su Ning y Zhang, 2001; Sullivan, 2004) donde son utilizadas las técnicas moleculares para los estudios de la variabilidad molecular en P. nicotianae.
En Cuba no se ha abordado esta temática para esta especie. La caracterización molecular de aislamientos de P. nicotianae, serán novedosos para el país y permitirán conocer la variabilidad genética del hongo, lo cual brindará una valiosa información y sentará las bases metodológicas para estudios posteriores con otras entidades y especies dentro del género Phytophthora en el ámbito nacional.
Fuentes
- Allagui, M.B. Morphologic, biologic and molecular characterizations of Phytophthora nicotianae isolates responsible for syndrome associating root and damping off of pepper (Capsicum annuum L.) in Tunisia. Faculté Universitaire des Science Agronomiques de Gembloux (Belgium) Thèse Docteur es Sciences Agronomiques et Ingénierie Biologique ) 160 pp, France , 1999.
- Appiah, J. y Flood, P. D. Inter- and intraspecific morphometric variation and characterization of Phytophthora isolates from cocoa. Plant Pathology 52: 168–180, 2003.
- Apple, J. L. Pathogenic, cultural and physiological variation within Phytophthora nicotianae. Phytopathology 7: 773:-739, 1957.
- Apple, J.L. Physiological specialization with Phytophthora parasitica var. nicotianae. Phytopathology 52: 351-392, 1962.
- Apple, J. L. Occurrence of race 1 of Phytophthora parasitica var. nicotianae in North Carolina and its implications in breeding for disease resistance. Tabacco Science 11: 79-83, 1967.
- Bhat, R. G; Aradhya, M. K.; Browne, G. T. Genetic and pathogenic variation in Phytophthora cactorum affecting fruit and nut crops in California. Plant Diseases 90:161-169, 2006.
- Benson, D. M. Suppression of Phytophthora parasitica on Catharanthus roseus with aluminum. Phytopathology 83: 1303-1308, 1993.
- Benson, D. M.; Grand, L. F. Incidence of Phytophthora root rot of fraser fir in North Carolina and sensitivity of isolates of Phytophthora cinnamomi to metalaxyl. Plant. Diseases 84:661-664, 2000.
- Bertrand, P. Tobacco disease losses (Black Shank). “The proceeding of the tobacco worker’s .“Conference 9-12, 36-42, January, Florida: Busch Gardens, 1995.
- Bonants, P.; Weerdt, M. H.; VanGent-Pelzer, M.; Lacourt, I.; Cooke, D. y Duncan, J.M. Detection and Identification of Phytophthora fragariae Hickman By the Polymerase Chain Reaction. Eur. J. Plant. Pathol., 103, 345–355, 1997.
- Bonnet, P.; Lacourt, I.; Venard, P.; and Ricci, P. Diversity in pathogenicity to tobacco and in elicitin production among isolates of Phytophthora parasitica. J.of Phytopathology 141: 25-37,1994.
- Brasier, C. M. Evolutionary biology of Phytophthora, Part I: Genetic System, Sexuality and the Generation of Variation. Annu. Rev. Phytophatology 30: 153171,1992.
- Centro Nacional de Sanidad Vegetal. Registro e Información Estadística Fitosanitaria de los Cultivos. / CNSV., La Habana: MINAG., p. 1-14, 1995.
- Centro Nacional de Sanidad Vegetal. Registro e Información Estadística Fitosanitaria de los Cultivos. / CNSV., La Habana: MINAG. p. 1-17, 2000.
- Centro Nacional de Sanidad Vegetal. Registro e Información Estadística Fitosanitaria de los Cultivos. / CNSV., La Habana: MINAG.,p. 1-11 , 2007.
- Chang, T. T.; Yang, W.W.; Wang, W.Y. Use of random amplified polymorphic DNA markers for the detection of genetic variation in Phytophthora cinnamomi in Taiwan. Botanical Bulletin of Academia Sinica 37:165-171, 1996.
- Colas, V., Lacourt, I; Ricci, P. y Vanlerberghe-Masutti F.: Diversity of virulence in Phytophthora parasitica on tobacco, as reflected by nuclear RFLPs. Phytopathology 88 :205-212, 1998.
- Colas, V.; Sandrine, C.; Venard, P.; Keller, H.; Ricci, P. y Panabieres, F. Elicitin gene expressed in vitro by certain tobacco isolates of Phytophthora parasitica are down regulated during compatible interactions. Mol. Plant. Microbe Interact. 14: 326-335, 2001.
- Cooke, D; Drenth, A.; Duncan, J.M.; Wagels, G. y Brasier, C.M.. A molecular phylogeny of Phytophthora and related Oomycetes. Fungal Genetics and Biology 30: 17-32, 2000.
- Cooke, D. y Duncan J. M. Phylogenetic analysis of Phytophthora species based on the ITS1 and ITS2 sequences of ribosomal DNA. Mycological Research 101, 667-677, 1997.
- Cornide, María T. y colaboradores. Marcadores Moleculares. Nuevos horizontes en la genética y selección de las plantas. Ed. Felix Varela, La Habana, Cuba, pp 367, 2002.
- Cristinzio, G.y Testa, A. Sensitivity to metalaxyl and dimethomorph of Phytophthora infestans isolates in Italy [ Solanum tuberrosum L. Lycopersicon esculentum Mill.]. Italian Phytopathological Society. Bienal meeting, Scicli, Ragusa (Italy). 3-7 May., p. 43. 1998.
- Csinos, A. S Tobacco Farmer, forty years of black shanck, Stated United, disponible en: http//www.tobaccofarmer.com/advertise/default.aps, consulta efectuada el: 27 de febrero 2004.
- Csinos, A. S. Relationship of isolate origin to pathogenicity of race 0 and 1 of Phytophthora parasitica var. nicotianae on tobacco cultivars. Plant Diseases, 89:332-337, 2005.
- Csinos, A. S. y Bertrand, P.F. Distribution of Phytophthora parasitica var. nicotianae races and their sensitivity to Metalaxyl in Georgia. Plant Diseases 78: 471-474, 1994.
- Dawn, E.; Fraser, P.; Shoemaker, B. y Ristaino, B. J. Characterization of isolates of Phytophthora infestans from tomato and potato in North Carolina from 1993 to 1995. Plant. Diseases 83: 633-638, 1999.
- Dellaporta, S.L; Word, J. y Hichs J.B. A plant molecular DNA minipreparation, versión II. Plant. Mol. Biol.1: 19–21, 1983.
- Días D.; Machado, M.A.; Penteado, M.L; Tragón, N y Furtado, E. Genotypic diversity among P. parasitica isolates revealed by ITS-5.8S rDNA nucleotide sequences, Summa Phytopathora. vol.32: 43-48, 2006.
- Drenth, A.; Irwin J.A.G. Rural Industries Research and Development Corporation. Development of routine DNA based diagnostic tests for Phytophthora.“disponible en http://www.rirdc.gov.au/reports/RAS/0136sum.html, consulta efectuada: 22 de marzo 2005”
- Erwin, D. C. y Ribeiro O. K.: Phytophthora Diseases Worldwide, St. Paul, Minnesota: The American Phytopathological Society, pp 568, 1996.
- Espino, E. Cuban’s Cigar Tobacco: T. F. H. Publication, Inc., 79 pp, 1996.
- Espino, E. Informe de las incidencias negativas en la fase agrícola del tabaco durante la temporada 2001-2002, Instituto de Investigaciones del Tabaco, Taba Cuba, 2002 a. (Informe interno, IIT)
- Espino, E. Origen y evolución del tabaco negro cubano En: Festival Internacional del Habano, La Habana, Cuba, Febrero, 2002 b.
- Espino, E. Informe de las incidencias negativas en la fase agrícola del tabaco durante la temporada 2002-2003, Instituto de Investigaciones del Tabaco, Taba Cuba, 2003 a, (Informe interno, IIT).
- Espino, E.: Resultados en los experimentos de regionalización de variedades (2001-2002), CUBA TABACO 4(1): 61-76, 2003 b
- Espino, E: Estrategia varietal para la campaña 2006-07, Informe a Taba Cuba 8 pp, 2006. (Informe interno, IIT)
- Espino E.; Rey X.; García V. y Peñalver N.. `Habana–92´ y `Habana-2000´ dos nuevas variedades de tabaco negro cubanas resistentes al moho azul (Peronospora tabacina), Rev. Cubana de Agricultura 1 (1): 15-24, 1997.
- Fernández, M. Ana. “Biología, epidemiología, nocividad y control de Phytophthora nicotianae (Phytophthora parasitica) en tabaco”. Tesis en opción al grado científico de Doctor en Ciencia Agrícolas, Instituto de Sanidad Vegetal (INISAV), La Habana, Cuba, 1998. 100 pp
- Flowers, R.A. y Hendrix H. A.: Host and nonthost effects on soil population of Phytophthora parasitica var. nicotianae. Phytopathology 64:718-720, 1975.
- Forster, H., Cummings, M y Coffey, M.: Phylogenetic relationships of Phytophthora species based on ribosomal ITS I DNA sequence analysis with emphasis on Waterhouse groups V and VI. Mycol. Res. 104:1055-1061, 2000.
- Forster, H.; Oudemans, P.; Coffey, M. Mitochondrial and nuclear DNA diversity within six species of Phytophthora. Experimental Mycology 14, 18-31, 1990.
- Gallup, C.A y Shew H.D. Race stability in Phytophthora nicotianae, the causal agent of black shank of tobacco. Phytopathology 96 S: 37, 2006.
- Gallup, C. A.; Sullivan, M. J.; Nesmith, W. C. y Shew, H. D. Occurrence of race 4 of Phytophthora nicotianae in tobacco. Southern Division Meeting Abstracts February 5-7, Orlando, Florida, 2006.
- García V.; Mena P. E.; Santana, F. N y. Hernández G. B. Nuevas variedades de tabaco negro, productoras de capas y capotes, resistentes a las principales enfermedades. CUBA TABACO 3: 48-53; 2002.
- Gómez, L. Diversidad genética de aislamientos de Phytophthora infestans en plantaciones de papa en Costa Rica con el uso de RAPDs, Agronomía Costarricense, January 1, (Resumen), 2005.
- Gisi U. y Cohen W.S.: Resistance to phenylamide fungicides: A Case Study with Phytophthora infestans Involving Mating Type and Race Structure. Annu. Rev. Phytopathology 34:549–572, 1996.
- Goins, R. B. y Apple, J. L.: Inheritance of phenotypic expression of a dominant factor for black shank resistance from Nicotiana plumbaginifolia in a Nicotiana tabacum milieu. Tobacco Science 14, 7-11, 1970.
- Hall, G. An integrated approach to the analysis of variation in Phytophthora nicotianae and a redescription of the species. Mycol. Res. 97: 559-574, 1993.
- Hendrix, J. W.; Flower R.A. Development races of Phytophthora parasitica var. nicotianae in Tennessee in 1966. Tabacco 167: 24-25, 1967.
- Ho, H. H. y Lu, J. Y. A synopsis of the occurrence and pathogenicity of Phytophthora species in mainland China. Mycopathologia 138:143-61, 1997.
- Ho, H. y Jong, H. Phytophthora nicotianae (Phytophthora parasitica). Mycotaxon 35: 243–276, 1989.
- Ilieva, E.; Arupappan, F. X y Pietes, R. Phytophthora root and crown rot of raspberry in Bulgaria. European Journal of Plant. Pathology 101: 623-626, 1995.
- Idosu G. O y Zentmmeyer G. A: Phytophthora palmivora: A comparative study of "tipical " and "atypical" isolates from cacao (Theobroma cacao). Trans. Br. Micol. Soc. 69: 329-332, 1977.
- Jackson, T. A.; Kirkpatrick, T. L. y Rupe, C. Races of Phytophthora sojae in Arkansas soybean fields and their effects on commonly grown soybean cultivars. Plant Diseases 88: 345-351, 2004.
- Johri, J. K., Singh, H. B. y Srivastava, M. Advances in Plant Disease Management (edited by: Udit. Narayan, Kumud Kumar and Mukesh Srivastava), Advance Publishing Concepts, New Delhi, pp. 175–183, 2000.
- Kamoun, S. Molecular Genetics of Pathogenic Oomycetes, Eukaryotic Cell 2 191-199, 2003.
- Kamoun, S.; Young, M. Forster, H. Coffey, M.D. y Tyler, B. M. Potencial role of elicitins in the interaction between Phytophthora species and tobacco. Appl. Environ. Microbiol. 60: 1593-1598, 1994.
- Kang, S.; Geiser, D. M.; Makalowska, I.; Coffey, M.; Ivors K. L; Martin,, F; y O’Donnell, K. L. Phytophthora database: A global resource for detecting, identifying, and monitoring Phytophthora En Phytophthora Molecular Genetics Network Workshop, Conference Grounds, Pacific Grove, CA, Asilomar, March 13-15, 2005.
- Kannwischer, M.E. y Mitchell D. I. The influence of a fungicide on the epidemiology of black shank of tobacco. (abstr.). Pro. Ann. Phytopathol. Soc.3: 338, 1978.
- Kong P., Hong C., Jeffers S. N. , Richardson P. A. Species-Specific Polymerase Chain Reaction assay for rapid detection of Phytophthora nicotianae in irrigation water. Phytopathology 93:822-83, 2003.
- Kucharek, T.: Tobacco disease losses (Black Shank). En: The proceeding of the tobacco worker’s Conference January 9-12, 36- Florida: Inn. Busch Gardens Tampa, 1995.
- Kuramae-Izioka, E. E.; Lopes, C. R.; Souza, N. L. y Machado, M. A. Morphological and molecular characterization of Colletotrichum spp. From citrus orchards affected by postbloom fruit drop in Brazil. European Journal Plant. Pathology 103: 323-329, 1997.
- Lacourt, I. Report of the Task force on the typology of black shank strains. CORESTA (3/4): 81-87, 1992.
- Lacourt, I.; Panabieres, A y Marais, P. Intraespecific polymorphism of Phytophthora parasitica revealed by analysis of mitochodrial DNA restriction fragment length polymorphism. Mycol. Res. 98 : 562-568, 1994.
- Lamour, K. H. y Daughtrey, M. L. ; Benson, D.; Hwang, M J. y Hausbeck, M. K.: Etiology of Phytophthora drechsleri and P. nicotianae (= P. parasitica) diseases affecting floriculture crops. Plant Diseases, 87:854-858, 2003.
- Lee S. B y Taylor J.W. Phylogeny of five fungus-like protoctistan Phytophthora species, inferred from the internal transcribed spacers of ribosomal DNA. Mol. Biol. Evol. 19: 636-53, 1992.
- Lherminier, N.; Benhamou; J. Larrue; M.-L. Milat, E.; Boudon-Padieu, M. y Blein,J.P: Cytological characterization of elicitin induced protection in tobacco plants infected by Phytophthora parasitica or Phytoplasma. Phytopathology 93:13081319,2003.
- Li, B. C; Bass, W. T. Resistance to tobacco Black Shank in Nicotiana species. Crop. Sci. 46:554-560, 2006.
- Lübeck, M.; Poulsen S. K.; Lübeck, P. S.; Funck Jensen D. y Thrane U. Identification of Trichoderma strains from building materials by ITS1 ribotyping, UP-PCR fingerprinting and UP-PCR cross hybridization. FEMS Microbiology Letters 185: 129-134, 2000.
- Lucas, G.B.: Black shank. En: Diseases of tobacco. Biological consulting associates. Raleigh, p. 115-141, 1975.
- Martín F., Tooley P. Phylogenetic relationships among Phytophthora species inferred from sequence analysis of mitochondrially encoded cytochrome oxidase I and II genes. Mycologia 95 (2) 269-284, 2003.
- Martín, R.R.; James D. y Lévesque C.A.: Impacts of molecular diagnostic technologies on plant disease management. Ann. Rev. Phytophatology 38: 207-239, 2000.
- McIntyre, J. L. y Taylor, G. S. Race 3 of Phytophthora parasitica var. nicotianae. Phytopathology 68:35-38, 1978.
- Melton, T. A. y Broadwell, A. Disease Management. En: Flue Cured tobacco information. North Carolina Coop. Ext. N. C. State University, Raleigh, p 119143,2003.
- Ministerio de la Agricultura, Cuba. Instructivo técnico para el cultivo del tabaco. 128 pp., Ed. Sedagri, Agrinfor, Ciudad de La Habana, 1998.
- Ministerio de la Agricultura, Cuba. Manual Práctico para el manejo de plagas en el cultivo del tabaco. 23 pp., Ed. Sedagri, Agrinfor, Ciudad de La Habana, 2002.
- Muiño, Berta Lina. Manejo de la resistencia a las fenilamidas en especies de Oomicetes en Cuba. Tesis en opción al grado científico de Doctor en Ciencia Agrícolas, Instituto de Sanidad Vegetal (INISAV), La Habana, Cuba, 1997. 100 pp
- Nesmith, W. Kentucky Pest News, Entomology C C Plant Pathology C C Weed, United States Science disponible en:http://www.uky.edu/agriculture/kpn/kpnhome.htm. consulta efectuada: 27 de febrero 2004”
- Nielsen, M. T. Collaborative Experiment on black shank. CORESTA 3/4. 74-78, 1992.
- Nielsen. M. T. Coresta Black skank collaboretive study. CORESTA (1): 36-41, 1995.
- Peñalver, N. Razas fisiológicas de Phytophthora parasitica var. nicotianae Ciencia y Técnica en la Agricultura Tabaco 6: 47-64, 1983.
- Peñalver, N. Variabilidad de la virulencia en tres aislados de Phytophthora parasitica var. nicotianae. Ciencia y Técnica de Agricultura Tabaco 8: 77-88, 1985.
- Peñalver, N y García, M. Influencia de las condiciones de cultivo sobre el crecimiento de Phytophthora parasitica var. nicotianae Rhizoctonia y Pythium. Ciencia y Técnica en la Agricultura Tabaco. 11:41-51, 1988.
- Pérez, M. Cristina. Biología, ecología y métodos de lucha contra Phytophthora nicotianae var. parasitica Waterhouse. Tesis en opción al grado científico de Doctor en Ciencia Agrícolas. Instituto Superior Agrícola, Ciego de Ávila, Cuba 1990. 100 pp
- Pérez, M. S. Variabilidad cultural, patogénica y genética del agente causal del tizón temprano (Alternaria solani Sor.) del tomate (Lycopersicon esculentum Mill.) en Cuba. Tesis en opción al grado científico de Doctor en Ciencias Agrícola, Universidad Agraria de La Habana, 2003. 94 pp
- Prinsloo, G. C. y Pauer, D. C. Die identikikasie van rasse van Phytophthora nicotianae B de Haan var. nicotianae wat in Suid-Afrika voorkom. Phytophylactica 6:217- 220, 1974.
- Ricci, P., F.; Trentin, P.; Bonnet, P.; Venard, F. y M. Bruneteau. Differential production of parasiticiein, in elicitor of necrosis and resistance in tobacco, by isolates of Phytophthora parasitica. Plant. Patholology (UK) 41: 298-307, 1992.
- Ristaino, J. B; Madritch, M; Trout, C. y Parra, P. PCR Amplification of ribosomal DNA for species identification in the plant pathogen genus Phytophthora. Applied and Environmental Microbiology, Mar. 948-954, 1998.
- Rivera, R.; Fernández, F.; Hernández, A.; Martin, J. R.; Fernández, Kalyanne. El manejo efectivo de la simbiosis micorrízica, una vía hacia una agricultura sostenible. Estudio caso: El Caribe. Ediciones INCA, La Habana, Cuba. 166 pp, 2003.
- Robin C. y Guest, D. Characterization of pathogenicity of isolates by stem and detached-leaf inoculations in four tobacco cultivars. New Zealand Journal of Crop and Horticultural Science, 22: 159-166, 1994.
- Sambrook, J.; Fritsch, E.F.; y Maniatis, T. Molecular cloning. Eds by: Cold Spring Hanbor Laboratory Press, 1989.
- S.C.P. Sistema para Comparación de Proporciones, ver. 2.1, CENSA, 1998.
- Shaw D. S. The Cytogenetics of Phytophthora En: Phytophthora: Its Biology, Taxonomy, Ecology and Pathology, Minnesota: American Phytopathological Society, 1983. 392 p, 1983.
- Shew H. D. Respons of Phytophtora parasitica var. nicotianae to metalaxyl exposure. Plant Diseases 69: 559-562,1985.
- Shew, H. D. y Lucas, G. B. Compendium of Tobacco Diseases. American Phytopathological Society / eds. H. D Shew and G. B. Lucas.-St. Paul, Minn., 90 p, 1991.
- Shew, H.D.; Sullivan, M.J. y Melton T.A.: Managing the population structure of Phytophthora nicotianae, CORESTA, Agro-Phyto Groups Meeting, Santa Cruz do Sul, 23-28 de Octubre, 2005. p. 78.
- Silvar, C.; Díaz, J. y Merino, F. Real-Time Polymerase Chain Reaction quantification of Phytophthora capsici in different pepper genotypes. Phytopathology, 95:1423-1429, 2005.
- Silvar, C.; Merino, F. y Díaz, J. Diversity of Phytophthora capsici in Northwest Spain: Analysis of virulence, metalaxyl response, and molecular characterization, Plant Dis. 90:1135-1142, 2006.
- SPSS, A. SPSS for Whindows. ver 6.0 Universidad autónoma de Madrid. Lincense 819225, 1993.
- Stamps, D. J..Waterhouse, G.M; Newhook, F.J. y Hall, G.S. Revised tubular key to the species of Phytophthora. 2nd ed. Mycologicial Paper 162. Commonwealth Agricultural Bureaux International Mycological Institute, Wallingford, Oxfordshire, England. 1990.
- Statistica plus for Windows, 1998 Disponible en: http//www.statsoft.com consulta efectuada :12 de marzo 2005”
- Staub, T. H.; Young, T. R. Fungi toxicity of metalaxyl against Phytophthora parasitica var nicotianae. Phytopathology 70: 797-801, 1980.
- Su, Ning y Zhang, X.G. Random amplified polymorphic DNA analysis of China isolates of Phytophthora parasitica var. nicotianae from different districts. Journal of Agricultural University of Hebei, Apr. 2001.
- Sullivan, M. J. Characterization and management of the race structure of Phytophthora parasitica var. nicotianae. Theses Ph. D. Phytopathology Department Plant Pathology, North Carolina State University, 2004. 95pp
- Sullivan, M. J.; Melton T. A y Shew, H. D.: The effect of variety rotation on races of Phytophthora parasitica var. nicotianae. En: Southern Division Meeting Abstracts, Tulsa, Oklahoma, February 15-17, 2004.
- Sullivan, M. J.; Melton, T.A y Shew, H. D. Fitness of Races 0 and 1 of Phytophthora parasitica var. nicotianae, Plant. Diseases 89 :1220-1228, 2005a.
- Sullivan, M. J., Melton, T. A y Shew, H. D. Managing the race structure of Phytophthora parasitica var. nicotianae with cultivar rotation, Plant. Diseases 89:1285-1294, 2005 b.
- Informe de la Estrategia Varietal del Tabaco Campaña 2000-2001, Dirección de supervisión y Control, Empresa Comercializadora de Tabaco en Rama Comercial la Vega, 2001. (Informe interno, Tabacuba)
- Informe de la Estrategia Varietal del Tabaco Campaña 2001-2002, Dirección de supervisión y Control, Empresa Comercializadora de Tabaco en Rama Comercial la Vega, 2002. (Informe interno, Tabacuba)
- Informe de la Estrategia Varietal del tabaco Campaña 2002-2003, Dirección de supervisión y Control, Empresa Comercializadora de Tabaco en Rama Comercial la Vega, 2003. (Informe interno, Tabacuba)
- Taylor, G. S.: Rapid production of Phytophthora parasitica var. nicotianae zoospores in vitro from infested cloth . Plant Dis. Rep. 62: 281-282, 1978.
- Thomidis, T y Llena, L. Effects of Metalaxyl, Fosetyl-Al, Dimethomorph and Cymoxanil on Phytophthora cactorum of peach. J. of Phytopathology 149: 97101,2001.
- Tooley, P. W.; Bunyard, B. A; Carras, M. M. y Hatziloukas, E. Development of PCR primers from internal transcribed spacer region 2 for detection of Phytophthora species infecting potatoes. Appl. Environ. Microbiol. 63:14671475,1997.
- Tooley, P. W.; Carras, M. M. y Falkenstein, K. F. Relationships among group IV Phytophthora species inferred by restriction analysis of ITS 2 region. J. of Phytopathology 144: 363-369, 1996.
- Tooley, P.W.; Martin, F.N.; Carras, M.M. y Fredirick, R.D. Real-Time Fluorescent Polymerase Chain Reaction detection of Phytophthora ramorum and Phytophthora pseudosyringae using mitochondrial gene regions. Phytopathology 96: 336-345, 2006.
- Tripathi, A. y col. Molecular identification of Phytophthora nicotianae isolates causing leaf rot of betelvine (Piper betle L.). Current Science 84:22-24, 2003.
- Truong L. R. Isolation and pathogenicity of Phytophthora sp. from tobacco and its distribution in tobacco areas. 27 Anniversary and Annual Scientific Meeting of the Philippine Phytopathological Society. Davao City (Philippines). 7-10 mayo, 1996.
- Tsao, P. H.; Sisemore D. J. Morphological variability in Phytophthora parasitica (P. nicotianae) isolates from citrus, tomato, and tobacco (Abstr.) Phytopathol. News. 12: 213, 1978.
- Vanderplank; J. E.: Genetic and molecular basis of plant pathogenesis. En: Advanced Series in Agricultural Sciences. Springer–Velag, Berlin, Heidelberg. New York, 1978. 167pp
- Van-Jaarsveld, E.; Lowveld, A. Effect of metalaxyl resistance and cultivars resistance on control of Phytophthora nicotianae in tobacco. Plant Diseases 86: 362-366, 2002.
- Van-Jaarsvels, E., Wingfield, M.J.; Drenth, A. Evaluation of tobacco cultivars for resistance to races of Phytophthora nicotianae in South Africa. J. of Phytopathology 150: 456-462, 2002.
- Van-Jaarsveld, E. , Wingfield, M., Drenth A. A rapid seedling based screening technique to assay tobacco for resistance to Phytophthora nicotianae J. of Phytopathology 151: 389-394, 2003.
- Wangsomboondee, T.; Ristaino, J.B. Optimization of sample size and DNA extraction methods to improve PCR detection of different propagules of Phytophthora infestans. Plant Diseases 86:247-253, 2002.
- Waterhouse, G. M: Key to species of Phytophthora de Bary. Mycol. Pap. (UK)92: 22, 1963.
- Webster, R. K. Recent advances in the genetic of plant pathogenic fungi. Annu. Rev. Phytopathol. 12: 331-353, 1994.
- Wernsman, E. A.; Matzinger, D. F. y Powell, N. T.: Genetics investigations of intraspecifico and interspecific sources of black shack resistance in tobacco. Tobacco Science 178 : 41-44, 1973.
- Wollgiehn, R.; Brautigam, E.; Schumann, B.; Erge, D. Effect of metalaxyl on the synthesis of RNA, DNA and protein in Phytophthora nicotianae. Z. Allg Mikrobiol. 24 :269-79, 1984.
- Yu, L. M. Elicitins from Phytophthora and basic resistance in tobacco. Proc Natl Acad Sci 92: 4088-94, 1995.
- Zentmeyer, G.A.; Leary, S.V.; Kluse, L.S. y Granthans, G.L. Variability in growth of Phytophthora cinnamomi in relation to temperature. Phytopathology 66: 982-986, 1976.
- Zhang, X. G.; Luo W. F.; Li, Y. y Zhang, T. Y. Genotypic and pathogenic variation among black shank of tobacco isolates of Phytophthora parasitica var. nicotianae from main tobacco regions of Yunnan province and tobacco regions of Shadong in China. J.of Phytopathology 5: 259-266, 2003
- Zhang X. G; .Zheng, G. S; Han H. Y; Han W.; Shi C. K. y Chang, C. J. RAPD PCR for diagnosis of Phytophthora parasitica var. nicotianae isolates which cause black shank on tobacco. J. of Phytopathology 149, 569-574, 2001.
- Zheng, F.S. y Warrd, E. Variation within and between Phytophthora species from rubber and citrus trees in China, determined by polymerase chain reaction using RAPDs. J. of Phytopathology 146: 103-109, 1998.