Sal (química)
| ||||||
Sales. Sustancias muy difundidas en la naturaleza. Las sales más conocida por el hombre son el cloruro de sodio (sal de cocina), NaCl; el carbonato de calcio (mármol), CaCO3 y los fertilizantes cloruro de potasio (KCl) y nitrato de potasio, KNO3.
Sumario
Definición
Las sales son compuestos resultantes de la combinación de un metal con otro elemento no metálico o con un radical ácido
Ejemplo:
- Sulfato de calcio, CaSO4
- Sulfuro de plomo (II), PbS
- Fosfato de calcio, Ca2(PO4)2
- Floruro de calcio, CaF2
- Sulfuro de cinc, ZnS
Clasificación
Atendiendo a su composición se clasifican en sales binarias y sales ternarias u oxísales. Existen otros tipos de sales que son compuestos cuaternarios, como el hidrogeno carbonato de sodio; NaHCO3.
Las binarias son compuestos formados por un elemento metálico y uno no metálico, excepto el oxígeno y el hidrógeno Ejemplo: El cloruro de sodio, NaCl y el sulfuro de plomo (II), PbS.
Las ternarias u oxísales son compuestos formados por un elemento metálico, uno no metálico y el oxígeno. Ejemplo: El carbonato de calcio, CaCO3 y el sulfato de cobre (II), CuSO4.
Propiedades de las sales
- A temperatura y presión ambiente las sales son sólidos cristalinos de relativamente elevadas temperaturas de fusión y ebullición. Esto se debe a la fuerte atracción electrostática que une a los iones que constituyen el cristal.
- Muchas se disuelven a temperatura ambiente con gran facilidad. Otras necesitan temperaturas altas para disolverse. Atendiendo a la masa de sal que se disuelve en una masa determinada de disolvente, generalmente agua, las sales se clasifican en solubles, poco solubles y prácticamente insoluble.
- En estado sólido no conducen la corriente eléctrica (aisladores).
- En estado líquido (fundidas) o disueltas en agua si permiten el paso de la corriente eléctrica.
- Al igual que todas las sustancias son eléctricamente neutras, por esta razón la suma de las cargas eléctricas de las cationes (+) y de los aniones (-) es igual a cero.
- En las sales ternarias iónicas los cristales están formados por cationes metálicos y por aniones constituidos por más de un elemento químico, uno de es el oxígeno. En estos aniones los enlaces entre los átomos de los elementos no metálicos y el oxígeno son covalentes.
- Las sales, a la temperatura ordinaria, son siempre sólidas, con la excepción del cloruro estánnico, el cual se asemeja en sus propiedades físicas a un cloruro de un no metal.
- Las sales, con pocas excepciones, están casi completamente disociadas en solución acuosa, por lo que se pueden considerar como electrólitos fuertes, independientemente de la fuerza del ácido y de la base de que derivan. Tanto en solución como fundidas son buenas conductoras de la electricidad.
- Las propiedades de las sales son, en general, aditivas, debido a su gran concentración iónica en solución.
Nomenclatura química y notación de las sales
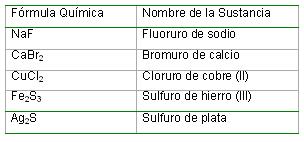
Nomenclatura química de las sales binarias: Para nombrar estos compuestos se escribe el nombre del elemento no metálico terminado en uro seguido de la preposición de y a continuación el nombre del elemento metálico. Si este último tiene más de un número de oxidación, entonces se aclara su valor con un número romano entre paréntesis.
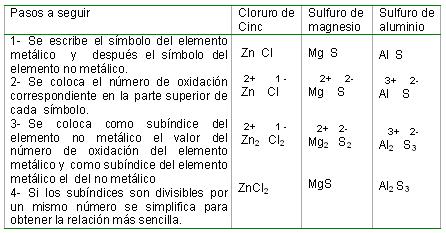
Notación química de las sales binarias: Para escribir la fórmula química de las sales binarias es necesario conocer el símbolo y el número de oxidación del elemento metálico y del no metálico que forman la sustancia en cuestión. Con estos datos puede procederse de la forma siguiente:
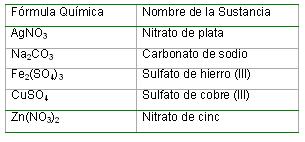
Nomenclatura química de las sales ternarias u oxisales. Para nombrar las oxisales se nombra el ión poliátomico seguido de la preposición de y a continuación el nombre del elemento metálico. Cuando este último tiene más de un número de oxidación se especifica el valor del mismo al igual que en las sales binarias.
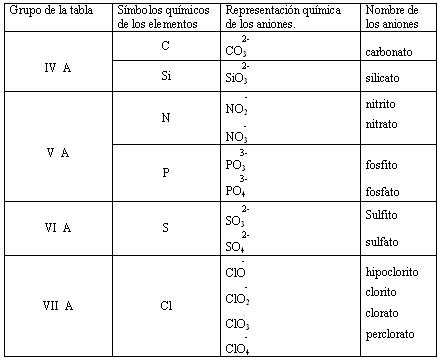
Principales aniones poliatómicos oxigenados
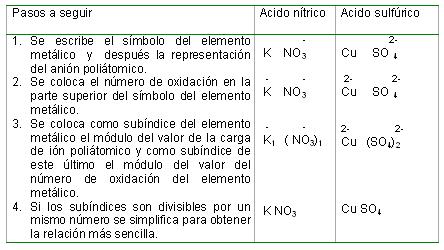
Notación química de las sales ternarias u oxisales:
Para escribir la fórmula química de las oxisales se procede de la forma siguiente:
Obtención de las Sales
La mayoría de las sales binarias pueden obtenerse por la reacción directa de un metal con un no metal bajo diferentes condiciones. Estas reacciones son de oxidación reducción donde el metal es el agente reductor y el no metal el agente oxidante.
Las oxisales pueden considerarse como el producto de la reacción entre óxidos metálicos y los óxidos no metálicos. Estas reacciones no son de oxidación reducción.
Otras formas de obtener sales.
Entre los Métodos generales de obtención de sales pueden citarse los siguientes:
- -La acción de los ácidos sobre los metales.
Ejemplo: SO4H2 + Zn = SO4Zn + H2 8 NO3H +3Cu = 3(NO3)2Cu+2 NO +4H2O
- -La neutralización de un ácido mediante un óxido o un hidróxido.
Ejemplo: NaOH+CIH = CINa + H2O.
- -La doble descomposición o intercambio iónico entre dos sales, distintas de la que se desea obtener, o entre sales y ácidos.
Ejemplo: SO4 Na2 + Cl2Ba = SO4Ba + 2CINa
NO3Ag+ClH = ClAg+NO3H.
Aplicaciones de las sales
- Las sales han sido utilizadas por el hombre desde épocas remotas. Es difícil encontrar una industria química actual o en un proceso productivo donde de una forma u otra no se utilice algunos de estos compuestos.
- Las sales son muy utilizadas en la agricultura, en la medicina y en la industria en general. Su aplicación se basa en sus propiedades
- Debido a la propiedad de algunas sales de ser higroscópicas (sustancias que absorben vapor de agua) como el cloruro de calcio, estas se utilizan como desecadores.
- El sulfato de magnesio en disolución acuosa tiene propiedad laxativa por lo que se utiliza como laxante.
- Los sueros fisiológicos son disoluciones de cloruro de sodio.
- Los iones sodio, potasio y cloruro, ayudan a mantener el correcto funcionamiento de las células del organismo.
- Los nitratos de potasio y calcio son utilizados como fertilizantes debido a su gran solubilidad..
- El sulfato de hierro (III) y el cloruro de sodio se utilizan como desinfectante.
- El sulfato de cobre (II) se emplea para combatir las plagas en las plantaciones
- En la técnica estas se utilizan en la obtención del vidrio, como colorante y en la fabricación de otros muchos productos.
- La piedra caliza, formada fundamentalmente por carbonato de calcio y carbonato de magnesio se utiliza como materia prima para la obtención de óxido de calcio o cal viva.
Véase también
Fuentes
- Libro de texto de Química. Secundaria Básica. Parte 2
- Sales I. Estudio General. Enciclopedia GER