Diferencia entre revisiones de «Buteno»
| (No se muestran 21 ediciones intermedias de 5 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | |||
{{Elemento_químico | {{Elemento_químico | ||
|nombre=Buteno | |nombre=Buteno | ||
| − | |imagen= | + | |imagen=Bute.jpeg |
| − | |nombre,simbolo,numero= | + | |nombre,simbolo,numero=C4, H, 8 |
| − | | | + | |serie_quimica= |
| − | <div | + | |grupo,periodo,bloque= |
| − | '''Buteno'''. | + | |densidad=2.72 kg/m3 gaseosa y 630 kg/m3 líquida |
| + | |apariencia= | ||
| + | |Propiedades_atomicas= | ||
| + | |radio_medio= | ||
| + | |radio_atomico= | ||
| + | |radio_covalente= | ||
| + | |radio_de_van_der_Walls= | ||
| + | |configuracion_electronica= | ||
| + | |electrones_por_nivel_de_energia= | ||
| + | |estado_de_oxidacion= | ||
| + | |estructura_cristalina= | ||
| + | |estado_ordinario= | ||
| + | |punto_de_fusion=–185,3 °C | ||
| + | |punto_de_ebullicion=–6,26 °C | ||
| + | |entalpia_de_vaporizacion= | ||
| + | |entalpia_de_fusion= | ||
| + | |presion_de_vapor= | ||
| + | |velocidad_del_sonido= | ||
| + | }}<div alig=justify>'''Buteno'''. Hidrocarburo gaseoso incoloro que se usa en síntesis química. Alqueno formado por 4 [[átomos]] de [[carbono]] y 8 átomos de [[hidrógeno]]. Nombre de los [[isomería|isómeros]] de [[olefina]] con la fórmula C<sub>4</sub>H<sub>8</sub> (1-buteno y 2-buteno). Fue encontrado por primera vez en [[1825]] por [[Michael Faraday]] en el aceite de gas. | ||
| − | == Propiedades | + | == Propiedades== |
| − | |||
* Fórmula: C<sub>4</sub>H<sub>8</sub> | * Fórmula: C<sub>4</sub>H<sub>8</sub> | ||
| + | * Fórmula desarrollada: CH<sub>2</sub>=CH-CH<sub>2</sub>-CH<sub>3</sub> | ||
* Masa molecular: 56,11 g/mol | * Masa molecular: 56,11 g/mol | ||
| − | * Límites de explosividad: 1,6 - 10 % Vol en aire | + | * Límites de [[explosividad]]: 1,6 - 10 % Vol en aire. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | == Isómeros de posición== | ||
| + | ===1-buteno=== | ||
| + | ====Propiedades físico-químicas==== | ||
* Fórmula: H<sub>2</sub>C=CH–CH<sub>2</sub>–CH<sub>3</sub> | * Fórmula: H<sub>2</sub>C=CH–CH<sub>2</sub>–CH<sub>3</sub> | ||
| − | |||
* Punto de fusión: –185,3 °C | * Punto de fusión: –185,3 °C | ||
| − | |||
* Punto de ebullición: –6,26 °C | * Punto de ebullición: –6,26 °C | ||
| − | |||
* Solubilidad en agua: 200 g/l | * Solubilidad en agua: 200 g/l | ||
| − | + | ====Síntesis==== | |
| + | De ser termólisis del petróleo se puede obtener el 1-Buteno por reacción de [[etileno]] con [[tris-etilaluminio]] a aproximadamente 100 °C y 100 bar. (Síntesis de 1-alquenos según [[Mülheimer]]). La reacción se parece a la síntesis del [[polietileno]] en catalizadores de Ziegler-Nata. | ||
| − | + | ====Aplicaciones==== | |
| + | * En la síntesis del butadieno para el [[caucho]] artificial. | ||
| + | * En la síntesis del 2-butanol por adición de [[agua]] en presencia de [[ácido]]. | ||
| − | + | ===2-buteno=== | |
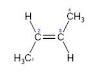
| − | + | De este compuesto existen a su vez dos isómeros geométricos: Cis-2-buteno y Trans-2-buteno. | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | ===Cis-2-buteno y Trans-2-buteno | ||
| − | |||
| − | |||
| − | |||
| + | ====Propiedades físicoquímicas==== | ||
{| class="wikitable" border="1" | {| class="wikitable" border="1" | ||
|- | |- | ||
| Línea 51: | Línea 57: | ||
|- | |- | ||
| Fórmula | | Fórmula | ||
| − | | | + | | H<sub>3</sub>C–CH=CH-CH<sub>3</sub> |
| − | | | + | | H<sub>3</sub>C–CH=CH-CH<sub>3</sub> |
|- | |- | ||
| Temp. Fusión | | Temp. Fusión | ||
| − | | | + | | –138,9 °C |
| − | | | + | | –105,5 °C |
| − | |||
| − | |||
|- | |- | ||
| − | | | + | | Temp. Ebullición |
| − | | | + | | 3,73 °C |
| − | + | | 0,96 °C | |
| − | |||
| − | | | ||
|- | |- | ||
| − | | | + | | Solub. en Agua |
| − | + | | 5 g/l | |
| − | | | + | | 5 g/l |
| − | |||
| − | |||
| − | |||
| − | |||
| − | | | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
|} | |} | ||
| − | |||
| + | ====Síntesis==== | ||
Los 2-butenos se pueden obtener por metátesis en presencia de un catalizador a partir de propeno: | Los 2-butenos se pueden obtener por metátesis en presencia de un catalizador a partir de propeno: | ||
2 H<sub>3</sub>C–CH=CH<sub>2</sub> → H<sub>3</sub>C–CH=CH–CH<sub>3</sub> + H<sub>2</sub>C=CH<sub>2</sub> | 2 H<sub>3</sub>C–CH=CH<sub>2</sub> → H<sub>3</sub>C–CH=CH–CH<sub>3</sub> + H<sub>2</sub>C=CH<sub>2</sub> | ||
| − | + | Además de por pirólisis del petróleo. La reacción de eliminación a partir del 2-butanol suele dar mezclas de productos que contienen también los 2-butenos. | |
| − | La reacción de eliminación a partir del | ||
| − | |||
| − | |||
| − | Tras halogenación con cloro y doble eliminación de HCl se obtiene butadieno que se utiliza en la síntesis de caucho artificial. | + | ====Aplicaciones==== |
| − | Como los demás butenos también puede ser polimerizado directamente. | + | Tras halogenación con cloro y doble eliminación de HCl se obtiene [[butadieno]] que se utiliza en la síntesis de caucho artificial. Como los demás butenos también puede ser polimerizado directamente. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Fuentes == | == Fuentes == | ||
| + | * Artículo [http://www.grupoprevenir.es/fichas-seguridad-sustancias-quimicas/0838.htm Buteno]. Disponible en "www.grupoprevenir.es". Consultado: 5 de agosto de 2011. | ||
| + | * Morrison, R. T. y Boyd, R. N.: Química Orgánica. Addison-Wesley Iberoamericana, S. A. Wilmington. Delaware, [[Estados Unidos]], [[1990]]. | ||
| + | * Requena, L. Vamos a Estudiar Química Orgánica. ([[2001]]). Ediciones Eneva. | ||
| + | * Soto, J. L. Química Orgánica. Vol. I. Conceptos básicos. Ed. Síntesis, 1996. | ||
| + | * Vollhardt, K. P. C.: Química Orgánica. Ed. Omega. [[Barcelona]], 1996. | ||
| − | + | [[Category: Gases]] | |
| − | + | [[Categoría:Hidrocarburos_alifáticos]][[Category:Elementos alcalinos]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | [[Category: | ||
última versión al 11:51 24 sep 2012
| ||||||||||||||||
Sumario
Propiedades
- Fórmula: C4H8
- Fórmula desarrollada: CH2=CH-CH2-CH3
- Masa molecular: 56,11 g/mol
- Límites de explosividad: 1,6 - 10 % Vol en aire.
Isómeros de posición
1-buteno
Propiedades físico-químicas
- Fórmula: H2C=CH–CH2–CH3
- Punto de fusión: –185,3 °C
- Punto de ebullición: –6,26 °C
- Solubilidad en agua: 200 g/l
Síntesis
De ser termólisis del petróleo se puede obtener el 1-Buteno por reacción de etileno con tris-etilaluminio a aproximadamente 100 °C y 100 bar. (Síntesis de 1-alquenos según Mülheimer). La reacción se parece a la síntesis del polietileno en catalizadores de Ziegler-Nata.
Aplicaciones
- En la síntesis del butadieno para el caucho artificial.
- En la síntesis del 2-butanol por adición de agua en presencia de ácido.
2-buteno
De este compuesto existen a su vez dos isómeros geométricos: Cis-2-buteno y Trans-2-buteno.
Propiedades físicoquímicas
| Propiedad | Cis-2-buteno | Trans-2-buteno |
|---|---|---|
| Fórmula | H3C–CH=CH-CH3 | H3C–CH=CH-CH3 |
| Temp. Fusión | –138,9 °C | –105,5 °C |
| Temp. Ebullición | 3,73 °C | 0,96 °C |
| Solub. en Agua | 5 g/l | 5 g/l |
Síntesis
Los 2-butenos se pueden obtener por metátesis en presencia de un catalizador a partir de propeno:
2 H3C–CH=CH2 → H3C–CH=CH–CH3 + H2C=CH2
Además de por pirólisis del petróleo. La reacción de eliminación a partir del 2-butanol suele dar mezclas de productos que contienen también los 2-butenos.
Aplicaciones
Tras halogenación con cloro y doble eliminación de HCl se obtiene butadieno que se utiliza en la síntesis de caucho artificial. Como los demás butenos también puede ser polimerizado directamente.
Fuentes
- Artículo Buteno. Disponible en "www.grupoprevenir.es". Consultado: 5 de agosto de 2011.
- Morrison, R. T. y Boyd, R. N.: Química Orgánica. Addison-Wesley Iberoamericana, S. A. Wilmington. Delaware, Estados Unidos, 1990.
- Requena, L. Vamos a Estudiar Química Orgánica. (2001). Ediciones Eneva.
- Soto, J. L. Química Orgánica. Vol. I. Conceptos básicos. Ed. Síntesis, 1996.
- Vollhardt, K. P. C.: Química Orgánica. Ed. Omega. Barcelona, 1996.