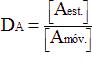Método cromatográfico
| ||||
Métodos cromatográficos. Método en el cual los componentes de una mezcla son separados en una columna adsorbente dentro de un sistema fluyente.
Sumario
Concepto
La cromatografía, según la definición dada por Keulemans, es un método de separación en el que los componentes a desglosar se distribuyen entre dos fases, una de las cuales constituye un lecho estacionario de amplio desarrollo superficial y la otra es un fluido que pasa a través o a lo largo del lecho estacionario.
Definición
En 1906 Tswett definió la cromatografía como el método en el cual los componentes de una mezcla son separados en una columna adsorbente dentro de un sistema fluyente.
Recientemente la I.U.P.A.C define la cromatografía de forma más amplia. Para ellos es un método usado principalmente para la separación de los componentes de una muestra, en el cual los componentes son distribuidos entre dos fases, una de las cuales es estacionaria, mientras que la otra es móvil.
La fase estacionaria puede ser un sólido o un líquido soportado en un sólido o en un gel (matriz). La fase estacionaria puede ser empaquetada en una columna, extendida en una capa, distribuida como una película, etc. Se utiliza el término general de lecho para definir las distintas formas en que puede encontrarse la fase estacionaria.
Las separaciones cromatográficas se consiguen mediante la distribución de los componentes de una mezcla entre la fase fija y la fase móvil. La separación entre dos sustancias empieza cuando una es retenida más fuertemente por la fase estacionaria que la otra, que tiende a desplazarse más rápidamente en la fase móvil. las retenciones mencionadas pueden tener su origen en dos fenómenos de interacción que se dan entre las dos fases y que pueden ser :
- La adsorción, que es la retención de una especie química por parte de los puntos activos de la superficie de un sólido quedando delimitado el fenómeno a la superficie que separa las fases o superficie interfacial.
- La absorción, que es la retención de una especie química por parte de una masa, y debido a la tendencia que esta tiene a formar mezcla con la primera, absorción pura, o a reaccionar químicamente con la misma, absorción con reacción química, considerando ambas como un fenómeno másico y no superficial.
Aspectos históricos de la cromatografía
La cromatografía se introduce en los métodos de separación en 1903 y su posterior desarrollo y evolución se produce hacia 1930. La primera persona que definió la cromatografía fue el botánico ruso Miguel Tswett (1872-1913) en 1906 y eligió el término cromatografía procedente de las palabras griegas khromatos (color) y graphos (escrito) ya que utilizó el término cromatografía para describir la separación de pigmentos vegetales en distintas zonas coloreadas. Aunque la mayor parte de las separaciones que se realizan actualmente son de compuestos incoloros, el término inicial cromatografía se ha mantenido.
Aunque procesos parecidos ocurren en la naturaleza cuando disoluciones pasan a través de arcilla, rocas, etc., la cromatografía como tal adquiere importancia cuando en 1850 el químico F.F.Runge, que trabajaba con tintas, descubrió que los cationes orgánicos se separaban por migración cuando se depositaba una disolución que los contenía sobre un material poroso, como papel.
En1906 el botánico ruso Tswett utilizó la cromatografía en columna para separar extractos vegetales coloreados, y a este proceso le dió el nombre de cromatografía. Pero el mayor desarrollo se produce en 1930 con Lederer cuando consigue separar los colorantes de la yema de huevo. Posteriormente los químicos Khun, Kamer y Ruzucca desarrollan la cromatografía en el campo de la química orgánica e inorgánica, y obtienen el Premio Nobel por sus trabajos en 1937, 1938, 1939 respectivamente.
A partir de 1940 los métodos cromatográficos adquieren extensión mundial de forma que en 1940, Tiselius divide los métodos cromatográficos en cromatografía por análisis frontal, desarrollo por elución y desarrollo por desplazamiento, obtuvo el Premio Nobel por sus trabajos en 1948.
Al mismo tiempo la cromatografía se aplicaba en el campo de la bioquímica, y así Martin consigue separar algunos aminoácidos acetilados.
Cromatografía en papel
La cromatografía en papel fue desarrolla por Martin. Tiene como soporte un papel de celulosa. Adquirió una gran extensión por su sencillez y presenta la ventaja de poder utilizar miligramos y microgramos. Además presenta la opción de utilizar tanto la técnica descendente ( en columna, etc.) como la técnica ascendente.
Cromatografía en capa fina
Fue originada por los trabajos de los investigadores rusos Izmailov y Schraiberen en 1938 al separar mezclas de tinturas farmacéuticas. En este tipo de cromatografía la fase estacionaria se extiende sobre un soporte inerte. La dificultad que presentaba el método era el crear una capa homogénea, sin ningún tipo de rugosidad. La cromatografía en capa fina tuvo valor limitado hasta que Stahl estandarizó el método para elaborar capas finas por métodos mecánicos.
Cromatografía de intercambio iónico
Esta técnica apareció durante la II Guerra Mundial y en principio tenía la finalidad de separar las tierras raras y los elementos de transición. En 1938 Taylor y Urey utilizan este método para separar isótopos de litio y potasio utilizando resinas de zeolita. En 1939 Samuel logra sintetizar resinas de intercambio iónico.
Cromatografía de gel-filtración
Fodin y Porta en 1958 descubren que usando como fase estacionaria geles, se consigue separar polímeros sintéticos de alto peso molecular.
Cromatografía de afinidad
Ideada por Porta en 1967, usa como fuente un péptido o proteína unida covalentemente a un ligando. Se utiliza para la separación de moléculas proteicas.
Cromatografía de gas
Es una de las técnicas más utilizadas e importantes, de forma que ha revolucionado el campo de la química analítica.
Clasificaciones
Según el procedimiento de separación
El principio básico de la separación de las sustancias que componen una mezcla se fundamenta en una serie de sucesivos equilibrios entre la fase estacionaria y la fase móvil. El equilibrio dependerá de la partición o diferente adsorción que tengan la fase estacionaria y los componentes de la mezcla.
La diferencia dependerá de las propiedades físicas y químicas de los componentes. El mayor o menor avance en el sistema cromatográfico dependerá de la afinidad del componente y la fase estacionaria. El componente con menor afinidad por la fase estacionaria en presencia de una fase móvil llamada eluyente será eluido en primer lugar, y por tanto se desplazará con mayor velocidad por el sistema cromatográfico.
Tabla de clasificación de métodos cromatográficos
| F. estacionaria | F. móvil | Soporte | Cromatografía | Siglas |
|---|---|---|---|---|
| sólido
(adsorción) |
gas
líquido |
columna
columna capa fina |
sólido-gas
líquida en papel y/o capa fina |
G.S.C / G.C
C.L / H.P.L.C T.L.C |
| líquido
(partición) |
gas
liquido |
columna
columna |
líquido-líquido
gas-líquido |
C.G.L
C.L.L / H.P.L.C |
| resina
(intercambio iónico) |
líquido | columna | intercambio iónico | |
| gel
(filtración en ) |
líquido | columna | filtración de gel |
- H.P.L.C : cromatografía líquida de alta presión.
Según el proceso de desarrollo
Según el procedimiento en que se desarrolla, se utiliza la clasificación usada por Tiselius en 1940.
- Desarrollo por elución.
- Desarrollo por desplazamiento.
- Análisis frontal.
Desarrollo por elusión
Representa el concepto básico de la separación cromatográfica y es la técnica más usada en los distintos métodos cromatográficos (gaseosa, líquido-gas, líquido-líquido, sólido-líquido).
Para describir esta técnica se considera una mezcla de solo dos componentes. Dicha mezcla se introduce en el extremo superior de una columna adsorbente y sus componentes se separan en zonas, al pasar uno o más eluyentes a través de la columna, debido a las distintas afinidades entre los componentes y ambas fases.
La fase móvil es adsorbida débilmente por la fase sólida estacionaria. Este ideal teórico de desarrollo por elución no siempre se consigue en la práctica. Es un método analítico esencial.
Desarrollo por desplazamiento
Consiste en desarrollar con un disolvente que sea adsorbido por la fase estacionaria con mayor fuerza con que adsorbe a los componentes de la mezcla, al contrario que el desarrollo por elución. A medida que el disolvente pasa a lo largo de la columna, desplaza a la mezcla, que al mismo tiempo se separa parcialmente.
Parte del material menos fuertemente adsorbido se recupera de forma pura, seguido por una mezcla (interfase) y seguido posteriormente del otro componente en forma pura. Es un método preparativo útil.
Análisis frontal
Consiste en la aplicación continua de una mezcla en el origen. En principio el componente menos fuertemente adsorbido fluye a lo largo de la columna, mientras que el más fuertemente adsorbido se acumula cerca del origen. Sin embargo existe un límite en la capacidad del adsorbente y, cuando este límite se alcanza, también el componente más fuertemente adsorbido empieza a desplazarse a lo largo de la columna. Por esto, las primeras fracciones contendrán el material menos fuertemente adsorbido; más tarde aparecerá una mezcla de ambos componentes. Es una técnica preparativa más que analítica.
Consideraciones teóricas y parámetros cromatográficos
La cromatografía es un sistema de separación dinámica, porque continuamente se producen equilibrios entre los componentes de la mezcla a separar y las fases móvil y estacionaria.
La fase estacionaria consiste en partículas, generalmente sólidas, pequeñas y con una superficie microporosa, de forma que presenta un amplio desarrollo superficial. Puede estar empaquetada en forma de columna o extendida en forma de capa. En ocasiones es necesario un tratamiento químico de la fase estacionaria para conseguir unas partículas de tamaño y poro adecuados.
La fase móvil puede ser un líquido o un gas, y su función es transportar a los componentes de la mezcla a través del sistema cromatográfico.
En el proceso de separación se produce una competición entre la fase móvil y la fase estacionaria por el componente, y a este proceso se le denomina partición del componente distribuido entre las dos fases. Es decir, se establece un equilibrio entre la concentración del componente presente en la fase móvil y la concentración presente en la fase estacionaria.
El coeficiente de distribución de un componente A se define como:
Donde DA es el coeficiente de distribución del componente A, y [Aest.] y [Amóv.] son respectivamente las concentraciones del componente A en la fase estacionaria y en la fase móvil. El valor del coeficiente de distribución es característico de un componente para una fase estacionaria y una fase móvil determinadas.
Los métodos cromatográficos actuales más modernos monitorizan la salida de los componentes y eluyentes, esto se consigue conectando a la salida del sistema cromatográfico unos aparatos electrónicos, denominados detectores, que perciben pequeñas cantidades de componentes.
Si se representan los valores de la concentración de esos componentes frente al tiempo o al volumen de eluyente se obtiene unas curvas Gaussianas denominadas cromatogramas.
Principales parámetros del cromatograma de picos
- Pico del aire: Es el que corresponde a la detección de una cantidad muy pequeña de aire que entra a la columna cuando se introduce la muestra en el cromatógrafo.
- La línea de base: Es la parte del registro que corresponde a la fase móvil pura (gas portador, etc.).
- Altura de pico (h): Es la distancia entre la cima del pico y la línea de base. En el caso de que el vértice sea redondeado se trazan rectas tangentes a los dos puntos de inflexión de las laderas; el punto de corte de las dos rectas determina la altura del pico.
- Anchura del pico (a). Es la longitud del tramo de la prolongación de la línea de base, comprendida entre las intersecciones con la misma de las laderas del pico o, en su caso, de las líneas tangentes antes mencionadas.
- Anchura del pico en la semialtura (ah/2): Es la distancia paralela a la línea de base, entre las dos laderas del pico, tomada a la mitad de la altura del pico.
- Área del pico (S): Es la comprendida entre el pico y la prolongación de la línea de base. Precisamente a obtener el valor de este parámetro, en los picos del cromatograma, se dedican los dispositivos integradores.
Principales parámetros cromatográficos
- Tiempo cero o tiempo de retención del componente inerte (t0): El tiempo cero (t0) o tiempo muerto (tm), es el tiempo de retención del componente inerte o gas portador.
- Tiempo de retención de un componente (tii): El tiempo de retención (ti o tR) es el tiempo transcurrido entre el instante en que se introduce la mezcla y el instante en que se detecta la señal propia del componente en su máxima intensidad. Los tiempos de retención no son reproducibles, ni siquiera en una misma columna cromatográfica.
- Tiempo de retención corregido de un componente (t'i): Es le tiempo que transcurre entre la aparición de la señal que corresponde a un componente inerte y a la del componente considerado:
t'i = ti - t0
- Tiempo de retención relativa (rip): Es la razón entre los tiempos de retención corregidos del componente considerado, i, y de otro, p, que se toma como patrón de referencia:
- Volumen de retención de un componente (VR): Es el volumen necesario de fase móvil para transportar el soluto de un extremo a otro del sistema cromatográfico. Se define como:
VR = tR - Fm, donde VR es el volumen de retención expresado como el producto del tiempo de retención de un componente (tR) y el flujo de la fase móvil (Fm). Y el flujo de fase móvil se define como:
, donde d es el diámetro interior del soporte utilizado y ε es la porosidad de la fase estacionaria, que suele tener un valor de 0,4 para empaquetamientos sólidos.
- Volumen cero o muerto (V0 o Vm). Es el volumen de eluyente que se consume sin que se detecte ningún componente. Se define igual que el volumen de retención pero el tiempo utilizado es el tiempo muerto:
Vm = tm x Fm
- Volumen de retención verdadero (V'R): El volumen de retención verdadero de un componente es la diferencia entre el volumen de retención del componente y el volumen muerto.
V'R = VR - Vm; o lo que es lo mismo:
V'R = (tR - t0) x Fm
- Coeficiente de partición o de reparto de un componente (K): Se define como el cociente entre la concentración de componente presente en la fase estacionaria y la concentreción de componente presente en la fase móvil:
, donde Cs y Cm son las concentraciones de componente presente en las fases estacionaria y móvil respectivamente. El valor de K representa el valor de la pendiente de la recta que se obtiene al representar Cs frente a Cm .
- Velocidad lineal media a lo largo de una columna (u): Es la velocidad lineal media a la que se desplazan las moléculas de soluto a lo largo de una columna. Viene dada por la expresión:
, donde u es la velocidad lineal media, L es la longitud de la columna y tm es el tiempo muerto.
- Factor de selectividad(α): Es la relación entre los tiempos de retención de dos componentes:
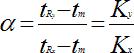
α > 2 se obtiene una mala separación ya que son necesarios períodos muy largos para realizarla.
1 < α < 2 se obtiene una buena separación cromatográfica.
- Factor de capacidad (K'): El factor de capacidad relaciona volúmenes o tiempos de retención de un componente respecto a la fase móvil. Se puede definir como:
Es el cociente entre las probabilidades de encontrar una molécula determinada de soluto en la fase estacionaria o en la fase móvil, o lo que es lo mismo, el cociente entre el tiempo de permanencia de dicha molécula en la fase estacionaria y en la fase móvil.
- Eficiencia: Para definir la eficacia se utiliza el concepto de piso teórico, y se define éste como la sección teórico-transversal en la cual se realiza el equilibrio de partición durante el flujo de fase móvil. Cuanto mayor es el número de platos teórico (N) mayor será la eficiencia de la columna.
El número de platos teóricos mide la capacidad de la columna para separar los componentes, no la retención de los mismos. La eficiencia o el número de platos se puede observa directamente a partir del cromatograma, observando la agudeza de los picos.
Donde N es el número de platos teóricos, L es la longitud de la columna, H es la altura de cada plato, t'R es el tiempo corregido de retención de un componente y ai es la anchura del pico cromatográfico. Y:
Si H tiene un valor pequeño, la distancia entre platos es menor y por tanto la eficiencia será mayor. Por el contrario, si H es grande la columna es poco eficiente para separar ese componente ya que sus moléculas estarán muy difundidas.
La velocidad de la fase móvil influye en la eficiencia del sistema cromatográfico, ya que si la velocidad es pequeña los componentes tendrán más tiempo parta que se pueda realizar el equilibrio de reparto, por lo que el número de platos será mayor y la altura de los platos menor.
- Resolución (R o Rs): Es el parámetro que expresa el grado de separación que se puede obtener en un sistema cromatográfico para dos componentes dados. Relaciona la capacidad separadora de un sistema cromatográfico para dos componentes. Se define como:
Donde Rs es la resolución, tRA y tRB son los tiempos de retención de los componentes A y B, y aA y aB son las anchuras de los picos del cromatograma de los anteriores componentes.
La resolución puede observarse directamente sobre el cromatograma de picos. Se tendrá una buena resolución si los picos no se solapan, y está perfectamente delimitado cada pico, sin que coincida el final de uno con el principio del siguiente.
Si el valor de la resolución está próximo a 0,7 se obtendrá una mala resolución quedando los picos solapados, de forma que se distinguen las crestas, pero no la base, y si el valor de la resolución está próximo a 1,5 se obtendrán unos picos bien delimitados por lo que se obtendrá una buena resolución.
Una pobre resolución es debido principalmente a:
- Hay demasiada muestra en la columna.
- La columna o placa es corta.
- La fase móvil no discrimina entre los componentes.
- La columna es demasiado gruesa.