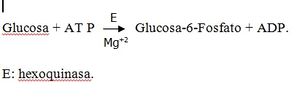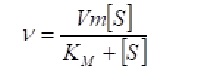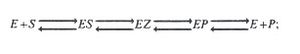Fundamentos bioquímicos de las enzimas
| ||||
Fundamentos bioquímicos de las enzimas. Las enzimas pueden definirse como catalizadores orgánicos producidos en los seres vivos y capaces de funcionar fuera de la célula u organismo que los producen.
Una parte importante del estudio de la bioquímica está, hoy día, dedicado a las enzimas, puesto que todas las funciones fisiológicas, como por ejemplo la contracción muscular, la conducción de los impulsos nerviosos, la excreción por el riñón, la respiración, entre otros, están íntimamente unidas a la acción de las enzimas.
Sumario
- 1 Antecedentes
- 2 Características generales
- 3 Propiedades de las enzimas
- 4 Clasificación y nomenclatura de las enzimas
- 5 Modo de acción
- 6 Cinética enzimática
- 7 Teoría cinética de Michaelis – Menten. Definición y representación gráfica de la KM y la Vmax.
- 8 Factores físico-químicos que afectan la actividad enzimática
- 9 Fuentes
Antecedentes
El reconocimiento inicial de los enzimas fue consecuencia de los estudios del mecanismo químico de la digestión y la fermentación. Van Helmont (siglo XVII), sugirió que la digestión consistía en la transformación química de los alimentos mediante la acción de los fermentos. Así coinciden en el tiempo, la definición de catálisis de Berzelius (1836) y el aislamiento de las primeras enzimas como la diastasa, obtenida de la malta por Payen y Person (1833), y la pepsina, por Schwann y Eberli (1836). Veinte años más tarde Convesant descubrió la tripsina, un componente proteolítico del jugo pancreático.
En la última mitad del siglo XIX, Pasteur afirmó que la fermentación era catalizada por las enzimas y postuló, en 1860, que éstas se hallaban ligadas de modo inseparable a la estructura y a la vida celular. Constituyó, por ello, un logro importante en la historia de la investigación enzimática, que en 1897 E. Büchner extrajera los enzimas que catalizan la transformación de la glucosa en alcohol y CO2, una de las fermentaciones más características de las células de levadura; esto demostró que las enzimas podían actuar independientemente de la estructura celular y con ello se sentaron las bases de la enzimología moderna, cuyo rápido desarrollo contribuyó decisivamente a impulsar el avance de la bioquímica. Sin embargo, no fue hasta muchos años después que se pudo aislar la primera enzima en forma cristalina; la ureasa, aislada por Summer en 1926, y ya entre 1930 y 1936 Northrop aisló la pepsina, la tripsina y la quimotripsina en forma cristalina, lo que permitió establecer la naturaleza y constitución química de las enzimas.
Características generales
Se ha demostrado que todas las enzimas son de naturaleza proteica. El análisis de los aminoácidos constituyentes de ellos no ha permitido apreciar ninguna característica que los diferencie de los aminoácidos que constituyen el resto de las proteínas; todos son œ -aminoácidos y se puede afirmar que todas las enzimas son proteínas, pero no todas las proteínas son enzimas.
Las proteínas que tienen acción enzimática poseen iguales propiedades químicas que el resto de las proteínas, pero además, las que tienen acción enzimática tiene otras propiedades que las diferencian del resto de las proteínas y que están relacionadas con su modo de acción. Estas propiedades son la especificidad, la eficiencia catalítica y la reversibilidad. Las enzimas pueden dividirse en enzimas simples y enzimas complejas.
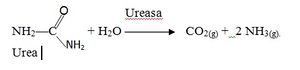
Enzimas simples. Son aquellas que para ejercer su acción sólo necesitan de la parte proteica. Esta puede estar constituida por una o varias cadenas, pero no necesita ningún factor adicional para llevar a cabo su acción sobre la molécula que va a transformar, la cual se denomina sustrato.
Un ejemplo de enzima simple es la ureasa, encargada de catalizar la transformación de la urea en CO2 y NH3. Para que la enzima actúe, sólo es necesario que esté presente el sustrato, en este caso específico es la urea, y la reacción que tiene lugar es la siguiente:
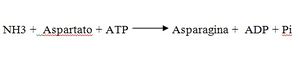
Enzimas complejas. Se denominan enzimas complejas aquellas que para ejercer su acción necesitan, además de la parte proteica, de otros factores adicionales que bien pueden ser de naturaleza orgánica o inorgánica, y que se agrupan bajo el nombre de cofactores enzimáticos. Por ejemplo, la hexoquinasa es una enzima compleja encargada de transformar la glucosa en su éster fosfato, y para poder realizar esta esterificación, además de la parte proteica, necesita del ATP, que es un cofactor de naturaleza orgánica.
La reacción puede representarse de la forma siguiente:
En el caso específico de las enzimas complejas, a la parte proteica se le denomina apoenzima y la unión de la apoenzima con los factores forma la holoenzima. La apoenzima libre no tiene actividad, o lo que es lo mismo, no lleva a efecto la transformación: cuando esta se halla unida a los cofactores (holoenzima) sí es activa y realiza la acción catalítica. A veces una enzima compleja puede necesitar más de un cofactor para llevar a efecto la reacción. Todos estos cofactores necesarios para que una enzima pueda efectuar su acción junto con la parte proteica o apoenzima y el sustrato, se agrupan bajo el nombre de complejo funcional enzimático, ellos son:
- Apoenzima.
- Sustrato.
- Cosustrato.
- Coenzima.
- Grupo prostético.
- Activadores.
La ''apoenzima'' como se explicó anteriormente, es la parte proteica de la enzima: en ella radica la especificidad de acción de las enzimas a causa de la presencia del centro activo, que es el sitio donde se coloca el sustrato para ser transformado y cuya estructura se explicará más adelante.
El ''Sustrato'' es la molécula sobre la cual la enzima va a ejercer su acción. Tanto la apoenzima como el sustrato tienen que estar obligatoriamente presentes para que pueda efectuarse la reacción.
El Cosustrato es una molécula diferente a la molécula de sustrato la cual acepta un grupo proveniente del mismo. Este tipo de componente es característico de las reacciones de transferencia, donde un grupo del sustrato es transferido a una molécula aceptora (cosustrato).
Las ''Coenzimas'' son compuestos orgánicos derivados, fundamentalmente de las vitaminas, donde abundan los derivados de las vitaminas B como la coenzima A(CoASH), el NAD, el TPP y otros, además de algunos nucleótidos importantes como el ATP, UTP, ADP, GTP, CDP, entre otras. Las coenzimas tienen la característica de regenerarse después de haber participado en la reacción mediante una reacción subsiguiente, y de forma general, pueden ser separadas de la enzima por diálisis, porque están débilmente unidas a la enzima.
Los Grupos prostéticos están constituidos generalmente por átomos de metales, como es el caso de las enzimas catalasas y peroxidasas, cuyo grupo prostético es un grupo hemo, el cual posee en su estructura un átomo de hierro, aunque algunas veces pueden estar constituidos por compuestos orgánicos como el FAD, que funciona como grupo prostético de algunas enzimas. A diferencia de las coenzimas, los grupos prostéticos se encuentran ligados fuertemente a la enzima y no pueden ser separados de ella por diálisis.
Algunos sistemas enzimáticos, para efectuar la transformación del sustrato necesitan la presencia de iones minerales conocidos como activadores, cuyo modo de acción no es bien conocido. El Mn+2 el Mg+2, el Cu+2 y otros, son ejemplos de activadores.
Todos los componentes del complejo funcional enzimático explicados anteriormente son indispensables para que se lleve a efecto la catálisis enzimática, sin que esto, signifique que deban estar todos presentes en una misma reacción. A veces sólo se necesita un componente, otras veces coinciden en una misma reacción más de un componente, teniendo siempre en cuenta que la apoenzima y el sustrato deben estar presentes obligatoriamente.
Propiedades de las enzimas
- Especificidad de la catálisis enzimática
Como propuso el químico sueco Jöns Jakob Berzelius, las enzimas son catalizadores típicos: son capaces de acelerar la velocidad de reacción sin ser consumidas en el proceso.
Uno de los primeros estudios importantes sobre la especificidad de las Enzimas fue efectuado por Fischer, quien descubrió que las enzimas que eran capaces de hidrolizar glucósidos podían distinguir entre formas estereoisómeras de los mismos. Esta observación lo condujo a enunciar el principio de que la molécula de sustrato se adapta al centro activo del enzima del mismo modo que la llave y la cerradura, es decir, que tienen una relación complementaria.
Aunque las enzimas en comparación con los catalizadores manufacturados son muy específicas, su grado de especificidad puede ser en general muy variado. Algunas enzimas poseen una especificidad casi absoluta respecto a un sustrato determinado y no atacarán a más moléculas aunque estén muy relacionadas, mientras que otros enzimas atacan toda una clase de moléculas con un común denominador estructural aunque lo hagan a diferentes velocidades.
Existen dos tipos de especificidad enzimática:
- Es absoluta cuando la enzima es estrictamente específica para un tipo de enlace correspondiente a un sustrato único; incluso la enzima no ataca a otro sustrato de estructura muy relacionada. Por ejemplo la ureasa, que cataliza la siguiente reacción:
- Es relativa cuando la enzima es capaz de catalizar la transformación de más de un sustrato, pero la actividad con respecto a cada uno de ellos es diferente. Entre los diferentes tipos de especificidad relativa se encuentran:
- Especificidad completa de grupo. En este caso, la enzima es específica para un determinado tipo de enlace y para uno de los grupos químicos que a él se unen. A este grupo pertenecen la β-glucosidasa, la aldehído oxidasa, etc., que sólo actúan sobre β-glucósidos o aldehídos alifáticos respectivamente.
- Especificidad relativa de grupo. Con esta designación se describen los casos en que un enzima actúa con preferencia sobre una clase de compuestos, pero puede atacar en cierta extensión a los miembros de otra clase. Por ejemplo, la quimotripsina hidroliza preferentemente los enlaces peptídico en los que participa el grupo carboxilo de un aminoácido aromático, pero puede actuar igual sobre amidas, ésteres y otros derivados en cuyo enlace participa el mismo tipo de aminoácidos.
- Especificidad genérica de clase. Corresponde al tipo de menor grado de especificidad, pues la enzima actúa sobre una serie muy amplia de sustratos naturales o sintéticos atendiendo sólo al tipo genérico de enlace, como por ejemplo las fosfatasas, que hidrolizan el enlace éster fosfato en cualquier sitio en que este se encuentre.
- Estereoespecificidad. Es una propiedad común de muchas enzimas comprendidas en los tres primeros grupos, los cuales sólo actúan sobre los derivados de un isómero óptico determinado; puede ser absoluta o relativa. Lo mismo se aplica a las formas cis- y trans-; por ejemplo, la succinato deshidrogenasa solo produce fumarato forma trans- y no su isómero cis-.
- La eficiencia catalítica de las enzimas
Es otra propiedad importante que las diferencia del resto de las proteínas; esta se manifiesta incluso en preparados muy impuros o en disoluciones muy diluidas de enzimas. Esta propiedad consiste en que una sola molécula de enzima puede transformar, en una unidad de tiempo, grandes cantidades de moléculas de sustrato. Su explicación se hace más evidente cuando se cuantifica.
Se ha calculado que una célula contiene 100 000 moléculas de enzimas para acelerar las 1 000 a 2 000 reacciones químicas que tienen lugar en su interior, lo que ofrece un promedio de 50 a 100 moléculas de enzima por cada proceso. Se ha calculado también, que una molécula de la enzima que transforma el H2O2 en H2O y O2 puede actuar sobre más de 5 000 000 de moléculas de peróxido por minuto. Otras enzimas transforman, en el mismo tiempo, de 1 000 a 500 000 moléculas. Estos valores aclaran por si mismos cuán eficaces son las enzimas.
La reversibilidad se explica porque de acuerdo con la Ley de acción de masas, una enzima, como cualquier catalizador, afecta por igual una reacción química en cualquier dirección en que se verifique, sin que cambie el punto de equilibrio de la reacción. En apariencia, muchas enzimas sólo parecen dirigir las transformaciones de los sustratos en un sentido. La causa de este hecho radica en la facilidad con que se encadenan en el medio celular unas reacciones con otras, de forma que el producto de una reacción es el sustrato de la siguiente. De este modo se origina una variación constante de las condiciones físicas del equilibrio al sustraer de la acción de la enzima los productos que se van formando. La reversibilidad de la acción de muchas enzimas resulta fácilmente demostrable in vitro, mediante un simple cambio de las condiciones de reacción.
Clasificación y nomenclatura de las enzimas
En un principio las Enzimas se nombraban añadiendo el sufijo –asa- al nombre del sustrato sobre la cual la enzima ejercía su acción catalítica. Por ejemplo, ureasa es la enzima que cataliza la hidrólisis de la urea con producción de amoniaco y CO2.
Esta nomenclatura, no siempre ha resultado práctica, lo cual ha ocasionado que muchas Enzimas reciban nombres que químicamente son poco informativos; por ejemplo, la pepsina, la tripsina y la catalasa. Por dicha razón y porque el número de Enzimas que se descubre se incrementa rápidamente, se ha adoptado una calificación sistemática de las Enzimas según recomendación de una comisión internacional de enzimas.
El nuevo sistema divide a las enzimas en 6 clases principales, cada una de las cuales se divide a su vez en subclases, de acuerdo con el tipo de reacción catalizada. Cada enzima es designada por un nombre recomendado, generalmente corto y apropiado para su uso habitual; por un nombre sistemático, que identifica la reacción que cataliza y por un número de clasificación, que se emplea cuando se precisa la identificación inequívoca de la enzima.
Por ejemplo, la enzima que cataliza la reacción:
El nombre recomendado para esta enzima, es creatín-quinasa y el nombre sistemático, que se basa en la reacción catalizada, es ATP cretaín-fosfotranferasa. Su número de clasificación es EC 2.7.3.2, en donde EC significa abreviadamente, comisión de enzimas; la primera cifra (2) significa el nombre de la clase (transferasas), la segunda cifra (7) representa la subclase (fosfotransferasas), la tercera cifra (3) la subsubclase y la cuarta cifra (2) designa a la creatín-quinasa.
Clasificación Internacional de las enzimas
Ej. Lactato deshidrogenasa.
- Tranferasas: Enzimas que catalizan que reacciones de transferencia de diversos grupos de un sustrato dador a otro aceptor. (8 subclases).
Ej. fosfotranferasa.
- Hidrolasas: Enzimas que efectúan la ruptura de diversos tipos de enlace, con la introducción de una molécula de agua (11 subclases). Ej. Dipeptidasas
- Ligasas: Enzimas que catalizan las reacciones de ruptura de diferentes enlaces en el sustrato sin la adición de una molécula de agua. (4 subclases).
Ej. : Piruvato descarboxilasa.
- Isomerasas: Enzimas que actúan produciendo reordenaciones intramoleculares, o transformaciones de radicales en el interior de la molécula (5 subclases).Ej. La triosa fosfato isomerasa.
- Ligasas: Enzimas que catalizan la unión de dos moléculas con la utilización de la energía del grupo fosfato (5 subclases).
Ej. Asparagin- sintetasa
Modo de acción
Todas las enzimas, además de poseer estructura primaria, secundaria, terciaria, y en algunos casos, cuaternaria, poseen un sitio específico dentro de la molécula denominado centro activo o cetro catalítico, este, por supuesto, está en la apoenzima y es la parte de la enzima que se combina con el sustrato. El centro activo está formado por una agrupación especial y específica de aminoácidos, constituyendo una parte muy pequeña de la enzima.
Los aminoácidos que constituyen el centro activo se agrupan en dos tipos: aminoácidos de contacto, que son los que participan en la fijación del sustrato a la enzima y aminoácidos auxiliares, encargados de transformar el sustrato en producto.
El resto de los aminoácidos que participan en el centro activo tienen la función de soportar la estructura espacial de este. El centro activo puede estar formado por aminoácidos de una sola cadena o por aminoácidos de varias cadenas, en dependencia de la estructura de la enzima en cuestión.
Teorías que explican la unión de la enzima con el sustrato.
Para que una enzima pueda ejercer su acción catalítica sobre determinado sustrato, es preciso que esta se una a la enzima por el centro activo. Existen algunas teorías que tratan de explicar esta unión, siendo la más conocida: La teoría de “la llave y la cerradura”, propuesta por Emil Fisher en 1894.
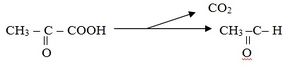
Esta teoría, trata de explicar de una forma muy simple cómo se lleva a efecto la unión de la enzima con el sustrato para que esta pueda transformarlo en producto, mediante un símil entre una llave y una cerradura. Fisher plantea que el centro activo de la enzima se disponía como un molde rígido al que podía fijarse el sustrato, el cual tenía que corresponder en tamaño y en forma con el centro activo, del mismo modo que una llave encaja en una cerradura. Esquemáticamente esta teoría puede representarse como se muestra en la figura a continuación.
Representación esquemática de la teoría de la llave y la cerradura” :
En la figura, el área sombreada representa a la enzima con su centro activo y el ácido acético es el sustrato de la enzima.
Como puede observarse en a, el ácido acético encaja perfectamente en el centro activo de la enzima, por lo que la catálisis que implica la transformación del sustrato en producto, debe producirse de una forma normal. En b, se observa que al sustituir un átomo de hidrógeno de la molécula del ácido por uno de flúor, donde la distancia entre los átomos C-F es mayor que la distancia C-H, el compuesto formado, flúor acetato, encaja lo suficientemente bien como para bloquear el centro con el ácido acético, que es su verdadero sustrato. En c, se observa que al remplazar el átomo de flúor por uno de cloro, donde la longitud del enlace C-Cl es aún mayor que la de C-F, el compuesto cloro acetato no consigue colocarse en el centro activo, motivado ya por una repulsión de tipo estérico. De aquí se puede inferir que la presencia del cloro acetato no interferiría la entrada del ácido acético al centro activo.
Por lo anteriormente expuesto se deduce que esta teoría explica el carácter específico de las reacciones catalizadas por enzimas, o sea, su especificidad, de modo tal que las enzimas no pueden reaccionar con cualquier sustrato, sino con aquel o aquellos que por su estructura tienen aceptación en el centro activo, por lo que se puede afirmar que la especficidad de acción de una enzima radica en el centro activo.
Cinética enzimática
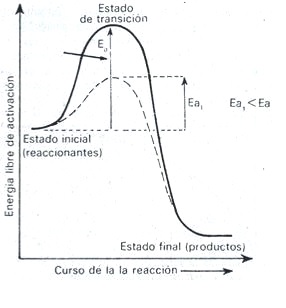
Las enzimas, al igual que otros catalizadores, aceleran la velocidad de las reacciones químicas donde ellos participan disminuyendo la energía de activación: de manera que se combinan con los reaccionantes (sustrato) para producir un estado de transición con menor energía potencial que el estado de transición de la reacción no catalizada, regenerándose estos cuando se forman los productos de la reacción.
El perfil energético de una reacción química no catalizada y otra catalizada, ha sido representado en la siguiente figura.
En la gráfica la curva con línea continua representa la reacción no catalizada y la curva con línea discontinua, la reacción catalizada enzirnáticamente; Ea la energía de activación de la reacción no catalizada y Ea1, la energía libre de activación de la reacción catalizada.
Figura: Perfil energético de una reacción catalizada enzimáticamente y una reacción no catalizada.
De modo que las enzimas aumentan la velocidad de reacción por lo que, el equilibrio se alcanza más rápidamente sin modificar ninguna de las propiedades termodinámicas de la reacción: tales como su constante de equilibrio (K), el orden de su acción se limita a disminuir la energía de activación Ea, la cual define la energía que se requiere para llevar las moléculas hasta un estado activo en el cual reaccionen con mayor facilidad.
Teoría cinética de Michaelis – Menten. Definición y representación gráfica de la KM y la Vmax.
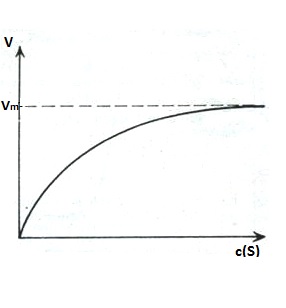
En una reacción enzimática, al aumentar la concentración del sustrato se observa el fenómeno denominado; saturación por el sustrato, que puede representarse del siguiente modo:
En la figura: v representa la velocidad, [s] la concentración de sustrato y Vm la velocidad máxima.
A bajas concentraciones de sustrato la velocidad de reacción y es proporcional a la concentración de sustrato y la reacción es por tanto, de primer orden con respecto al sustrato. Sin embargo, a medida que la concentración de sustrato aumenta, la velocidad de reacción disminuye y ya no es proporcional a la concentración de sustrato. Por un aumento ulterior de la concentración de sustrato, la velocidad se hace constante e independiente de la concentración del mismo, y la reacción se hace de orden cero con respecto al sustrato: se dice que la enzima se halla saturada por el sustrato, o sea, que en ese momento, todos los centros activos de las moléculas de enzimas que están presentes en el medio de reacción, se hallan ocupadas por el sustrato. En estas condiciones, el factor limitante de la velocidad es solo el grado de concentración de la enzima.
Todas las enzimas muestran este efecto de saturación y se debe a la presencia del centro activo en ellas. El efecto de saturación condujo a Michaelis-Menten (1913) a formular una teoría general de la acción de las enzimas y de su cinética, la cual fue ampliada posteriormente por Briggs y Haldane (1925).
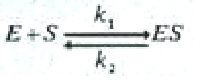
De acuerdo con esta teoría, que es fundamental para el análisis cuantitativo de todos los aspectos de la cinética y de la inhibición enzimática, la enzima E reacciona, en primer lugar, con el sustrato S y forma el complejo enzima-sustrato ES, que se escinde después en una segunda etapa para formar enzima libre E y los productos P.
(1)
(2)
Ambas reacciones son consideradas reversibles, donde k1, k2 k3 y k4 son constantes de velocidad específica para las reacciones indicadas. La constante de velocidad k4 es habitualmente pequeña y despreciable en comparación con k1, k2 y k3.
A partir de las consideraciones matemáticas pertinentes se obtiene la ecuación siguiente:
(Ecuación de Michaelis-Menten)
Esta ecuación define las relaciones cuantitativas entre la velocidad de reacción v y la concentración de sustrato [S] si se conocen la velocidad media Vm y la constante de Michaelis-Menten KM.
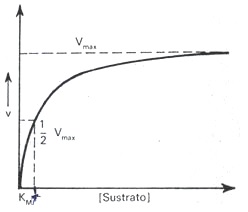
De la ecuación de Michaelis-Menten se deduce una relación numérica importante en el caso especial de que V= 1/2Vm, entonces KM =[S] y se llega a la conclusión de que KM es igual a aquella concentración de sustrato a la cual la velocidad de la reacción es la mitad de la velocidad máxima. Gráficamente la KM puede representarse como se muestra en la figura a continuación. La figura representación gráfica de la KM.
En la gráfica, v representa la velocidad de la reacción catalizada enzimáticamente, Vmax la velocidad máxima, [s] la concentración de sustrato y KM la constante de Michaelis.
La KM es uno de los valores más útiles para caracterizar una enzima, ya que es una constante característica de cada enzima y da una medida de la afinidad de este por el sustrato. Se expresa en moles/litro, sus valores oscilan entre l0-2 y l0-5 moles/litro y su magnitud es independiente de la concentración del enzima. Esta constante puede variar con la estructura del sustrato, con el pH y la temperatura. Aquellas enzimas que actúan sobre más de un sustrato, para cada uno posee una KM característica. Si el valor de la KM es mayor para uno de ellos, esto significa que se necesita mayor cantidad de sustrato para alcanzar la mitad de la velocidad máxima, y por tanto, la enzima tendrá menor afinidad por ese sustrato que por otro que tenga un valor de KM menor, es decir, que necesita menor cantidad de sustrato para alcanzar la mitad de la velocidad máxima, o lo que es lo mismo, que es más afín por ese sustrato.
De todo lo expresado se puede concluir que a menor KM mayor afinidad y viceversa. Algunas enzimas tienen un comportamiento cinético más complejo que el caso ideal para deducir la ecuación de Michaelis-Menten, ya que se ha supuesto que solo existe un sustrato y un complejo ES; sin embargo, es muy probable que en la mayor parte de las reacciones catalizadas enzimáticamente intervengan 2 o 3 complejos enzima-sustrato, según la siguiente ecuación:
EZ es el verdadero complejo activado y EP un complejo enzima-producto. Debe señalarse, además, que en muchas reacciones enzimáticas hay más de una molécula de sustrato y puede haber dos o más productos.
Factores físico-químicos que afectan la actividad enzimática
Existen factores que de una forma u otra pueden afectar la velocidad de una reacción enzimática; entre ellos tenemos: la concentración de sustrato, el pH, la temperatura la concentración de enzima.
a) Efecto del pH en la actividad enzimática
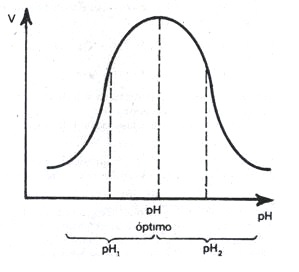
El pH ejerce una gran influencia en la velocidad de las reacciones enzimáticas. Todas las enzimas poseen un pH característico donde su actividad enzimática es máxima; por encima o por debajo de ese pH la actividad disminuye. Este pH al cual la enzima alcanza su actividad máxima, es conocido como pH óptimo y es característico de cada enzima. El perfil de las curvas de actividad enzimática en función del pH es, generalmente, como se muestra en la siguiente figura. Observe que el pH óptimo está en correspondencia con aquel pH donde la actividad de la enzima es mayor y que a pH superiores (pH2) y a pH inferiores (pH1) la actividad es menor.
Este comportamiento se debe a que las enzimas, como todas las proteínas, son anfolitos y poseen grupos ionizables provenientes de los diferentes aminoácidos que los constituyen. Estos grupos ionizables que pueden ser grupos -NH2, -OH, -COOH, etc., están presentes tanto en el centro activo como en el resto de la molécula proteica y son los que determinan la estructura terciaria de la enzima. Como el centro activo encargado de transformar el sustrato en producto, está determinado por la estructura terciaria de la proteína, se infiere que un cambio en la ionización de los grupos que lo constituyen, provocado por la disminución o aumento del pH, afectará la velocidad con que la enzima transforma al sustrato. Es posible que en vez de afectarse los grupos del centro activo se afecten los que están constituyendo el resto de la molécula; de igual forma se afecta la estructura tridimensional de este, manifestándose también una disminución de la actividad de la enzima.
b) Temperatura
En toda reacción química la temperatura aumenta la velocidad de reacción, y las reacciones catalizadas enzimáticamente no son una excepción. Al analizar el efecto de la temperatura sobre la velocidad de reacción hay que tener en cuenta dos aspectos:
- El aumento de la temperatura en una reacción enzimática aumenta la velocidad de la reacción, pues se incrementa la movilidad de las moléculas reaccionantes y con ello la facilidad de entrar en reacción.
- Las enzimas, como proteínas al fin, son termolábiles, o sea, que el aumento o disminución de la temperatura puede provocar la ruptura de enlaces puentes de hidrógeno u otros, que son los que mantienen la estructura secundaria y terciaria de las enzimas. Esta afectación de la estructura tridimensional de la enzima afecta, como habíamos señalado anteriormente, la estructura del centro activo, y por tanto, la actividad enzimática disminuye.
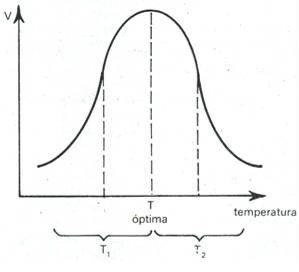
Existe una temperatura a la cual la actividad de la enzima es máxima: esta es conocida como temperatura óptima y es característica de cada enzima. Gráficamente se ha representado el efecto de la temperatura en la siguiente figura.
En la figura, v representa la velocidad o actividad relativa y T la temperatura.
Obsérvese que a la temperatura óptima, la enzima alcanza su mayor actividad, a temperaturas mayores (t2), o menores (t1), la actividad disminuye.
De forma similar al pH, los cambios bruscos de temperatura provocan desnaturalización irreversible de la enzima. Existen otros factores que también pueden afectar la actividad de las enzimas: entre ellos pueden citarse radiaciones como las UV, IR, rayos X, rayos y, las altas presiones, etc., que pueden provocar tanto ionización de algunos grupos químicos, indispensables para la actividad enzimática, como la ruptura de algunos enlaces que afectan la conformación de la enzima, implicando todo ello, como ya se ha explicado anteriormente, la disminución o la pérdida de la actividad enzimática.
c) Influencia de la concentración de enzima
La velocidad de una reacción química es directamente proporcional a la c (E).Esto puede explicarse de la siguiente forma: Al aumentar las cantidades de E, el número de moléculas de catalizador que se encuentra actuando aumenta, lo que trae como resultado que se produzca un incremento en la velocidad de la reacción, toda vez que las posibilidades de formación del complejo enzima – sustrato están aumentadas ante el exceso de sustrato con que se realiza el experimento.
Fuentes
- Lehninger, A. “Biochemistry”. Cap. 6 págs. 191-225. Versión digital en pdf. Revisado 2008.
- Villar- Palasí. “Tratado de Bioquímica”. Editorial Pueblo y Educación. 1980.
- Ramos, A. Bioquímica para estudiantes de Ciencias Agropecuarias. Ed. Félix Varela. La Habana 2004.
- Cascales Angosto, M., Espinós, D., García Barreno, P. Bioquímica y Fisiopatología de la Nutrición. Instituto de España. Versión digital. 2005.
- Cardellá-Hernández. Bioquímica médica. Tomo I. sección III.1999
- Lehninger, A. “Principios de Bioquímica”. Cap. 8, págs. 198-234. 1992. Versión digital en pdf.