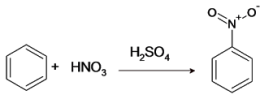Nitración
| ||||||
Nitración. Es el proceso por el cual se efectúa la unión del grupo nitro (NO2) a un átomo de carbono, lo que generalmente tiene efecto por sustitución de un átomo de hidrógeno. Es una de las reacciones químicas comercialmente más importantes. Se trata de la reacción entre un compuesto orgánico y un agente nitrante (por ejemplo el ácido nítrico) que introduce un grupo nitro en el hidrocarburo produciendo un éster.
Sumario
Tipos de nitración
Las nitraciones simples son la conversión de glicerina en nitroglicerina con ácido nítrico y sulfúrico, la de la cianhidrina de acetona con ácido nítrico en anhídrido acético para obtener nitrato de acetocianhidrina y la conversión de α-bromobutirato de etilo en α-nitrobutirato de etilo con nitrito sódico. De acuerdo a la estructura química del producto nitrado, ejemplo:
R - H + HO - NO2 → R - NO2 + H2O
La nitración puede clasificarse como:
En cada uno de los ejemplos indicados, un grupo nitro reemplaza a un átomo de hidrógeno. Sin embargo el grupo nitro puede reemplazar a otros átomos o grupos de átomos, la reacción de Víctor Meyer es un ejemplo típico, donde un átomo halógeno (especialmente bromo o iodo) es reemplazado por un grupo nitro usando nitrito de plata (o nitrito de sodio).
Los compuestos nitrados pueden ser producidos por determinadas reacciones de adición como ser ácido nítrico, o bióxido de nitrógeno con compuestos orgánicos no saturados.Por ejemplo Olefinas o Acetilenos.
Características de la Nitración
- El proceso de nitración es altamente exotérmico, entregando al medio más de 30 Kcal/mol.
- El calor de reacción, no obstante, varía con el hidrocarburo a nitrar.
- El mecanismo de nitración depende de los reactivos y las condiciones de operación.
- Las reacciones pueden ser del tipo iónico ó del tipo radicales libres.
- El tipo iónico se usan comúnmente en la nitración de hidrocarburos aromáticos, alcoholes simples glicoles, gliceroles, celulosas y aminas.
- El tipo radical libre se da en nitración de parafinas, cicloparafinas y olefinas, los compuestos aromáticos y algunos hidrocarburos pueden algunas veces ser nitrados reaccionando con radicales libres, pero generalmente con menos éxito.
- Para estas reacciones de nitración frecuentemente son usados catalizadores sólidos.
Productos principales que se obtienen de la nitración
- Derivados de celulosa
- Explosivos
- Nitrobenceno
- Nitrotolueno
- Nitrofuranos
- Nitroparafinas
- Nitrofenoles.
- Nitrocelulosa
Algunos agentes que generan el grupo nitro
Ácido nítrico
El método industrial más importarte para producirlo es el proceso Ostwald, con amoniaco y oxígeno molecular, y se calienta en presencia del catalizador platino - radio a 800ºC. El ácido nítrico es un agente de nitración débil puesto que su constitución se altera durante el proceso por la presencia del agua producida. Para superar esto es necesario recurrir a procedimientos de separación del agua resultante en la nitración, a fin de mantener una concentración relativamente constante y satisfactoria de HNO3 o emplear un exceso de ácido nítrico.
El ácido nítrico no existe como líquido puro porque en reposo se descompone en:
4HNO3 → 4NO2 + 2H2O + O2
La reacción generalizada de nitración con ácido nítrico es:
R - H + HNO3 → R - NO2 + H2O
El ácido nítrico necesario para la nitración puede preparase ahí mismo mezclando nitratos alcalinos y ácido sulfúrico.
NaNO3 + NaHSO4 → HNO3 + Na2SO4
Mezclas nitrantes de ácido sulfúrico
Las mezclas nitrantes están formadas por la sustancia a nitrar, el agente nitrante y un agente deshidratante para eliminar el agua. La mayor ventaja es que las mezclas sulfonítricas atan sólo ligeramente los depósitos y aparatos de nitración.
La nitración se realiza con el anhídrido mixto HOSO2 - O - NO2 que se obtiene así:
HONO2 + H2SO4 → HOSO2 - O - NO2 + H2O
La reacción generalizada de nitración con el ácido nitrosulfúrico es:
HOSO2 - O - NO2 + RH → R - NO2 + H2SO4
Nitratos alcalinos y ácido sulfúrico
El ácido nítrico necesario para la nitración se obtiene de mezclar un nitrato alcalino y ácido sulfúrico como se vio en la obtención del HNO3 anteriormente. Se utiliza como agente la sal alcalina siendo el puente el ácido sulfúrico que ataca al metal para regenerarse.
Nitratos orgánicos (nitrato de acetilo de benzoilo)
El anhídrido acético y el nítrico se combinan para forma nitrato de acetilo:
CH3 - CO NO2O + O2CH3 → COO - NO2 → CH3 - CO NO2
( nitrato de acetilo )
Donde lo que se nitra es el anhídrido acético, que sirve de puente, siendo el CH3 - CO el agente deshidratante y el agente nitrante el NO2
Nitratos metálicos
Sirven como agentes nitrantes algunos metálicos disueltos en anhídrido acético como los nitratos cúprico, férrico y de aluminio. Cuando se hacen reaccionar aminas se obtiene su acetilación y su nitración.
M - (NO2)3 + 3R - H 3R → NO2 + M3H
(nitrato metálico) (hidruro)
Se utilizan metales de las familias I, II y III. === Tetróxido de nitrógeno ===(N2O4) El tetróxido de nitrógeno muestra una pequeña reactividad con el benceno, clorobenceno y el tolueno. Con éste agente se da la unión de dos grupos nitro. La reacción generalizada es:
R - H + NO2 - NO2 → R - NO2 + HNO2
El ácido nitroso obtenido es un reductor que se debe oxidar para dar ácido nítrico y debe manejarse con precaución para que no reaccione con el producto nitrado.
Anhídrido nítrico
Es uno de los agentes más vigorosos.
La reacción generalizada es:
N2O5 + R - H → R - NO2 + HNO3
Dióxido de nitrógeno
Se utiliza para la nitración catalítica de las parafinas.
La nitración fotoquímica con NO2 con el benceno y nitrobenceno en fase líquida o vapor da lugar a la formación de nitrobenceno y dinitrobenceno respectivamente. El NO2 es un gas amarillento sumamente tóxico con olor sofocante.
Cu + 4HNO3 Cu → ( NO3 )2 + 2H2O + 2NO2
La reacción generalizada es:
R - H + 2NO2 → R - NO2 + HNO2
La luz empleada es generalmente luz ultravioleta. Éste proceso es peligroso con compuestos aromáticos porque se puede llegar a dar una polinitración.
Nitroderivados
Nitroparafinas
Las materias primas para la preparación de nitroparafinas son el gas natural, el petróleo, ácido nítrico diluido o dióxido de nitrógeno. Para nitrar en fase vapor las parafinas de bajo peso molecular (metano a decano) se utilizan altas temperaturas ( 300º a 500ºC ) y ácido nítrico relativamente diluido. Cuando se nitra una parafina en fase vapor entre 350º y 500ºC son posibles todos los derivados monosustituidos que pueden resultar de la sustitución por el grupo nitro de cualquiera de los átomos de hidrógeno o radicales alquílicos presentes.
La elección del agente (sustancia que nos genera el grupo nitro) nitrante y la técnica de nitración se determinan por factores como la constitución química y propiedades físicas del compuesto orgánico a nitrar y las características económicas del proceso. Los agente nitrantes son complejos ya que poseen valencia residual muy pronunciada, es decir, aceptan electrones por nitrógeno y electrones compartidos por los átomos de oxígeno, en la estabilización después de la nitración se separa un ácido, que contiene el grupo NO2 formando parte del complejo lábil activo. Un compuesto lábil es aquél que se puede transformar en otro compuesto de mayor estabilidad
Ácido nítrico
- Mezclas nitrantes, por ejemplo, ácido nítrico mezclado con un agente deshidratante como el óleum, ácido sulfúrico, anhídrido acético, pentóxido de fósforo.
- Nitratos alcalinos en presencia de ácido sulfúrico.
- Nitratos orgánicos como nitratos de acetilo de benzoilo.
- Nitratos metálicos con ácido acético.
- Tetróxido de nitrógeno.
- Anhídrido nítrico.
- Dióxido de nitrógeno
Nitración aromática
Ocurre con compuestos aromáticos gracias a un mecanismo de sustitución electrófila aromática que incluye el ataque de un anillo bencénico rico en electrones por parte del ion nitronio.
Nitración del benceno
La anexión de un grupo nitro a un compuesto orgánico puede ser llevada a cabo de dos modos distintos: nitración electrofílica y nitración radicalaria. La primera se lleva a cabo con la especie NO2+ ion nitronio, que es un electrófilo potente. El benceno resulta nitrado gracias al reflujo de ácido sulfúrico concentrado y ácido nítrico concentrado a 50 °C.
La nitración electrofílica es el método de elección en la preparación de hidrocarburos aromáticos nitrados en el anillo, debido a la tendencia de dicha familia a reaccionar por sustitución electrofílica. En el caso de hidrocarburos no aromáticos, se prefiere la nitración radicalaria, aunque los rendimientos son bajos y se obtienen mezclas complejas. Aproximadamente el 40% del ácido nítrico que pasa a través del reactor forma nitroparafinas que se pueden separar por rectificación. El 60% del ácido restante actúa como agente oxidante que se reduce preferentemente a óxido nítrico. Del proceso se forman alcoholes, ácidos carboxílicos, aldehídos, cetonas, óxidos de carbono y agua.
Industrialmente se lleva a cabo la nitración en forma continua; el óxido nítrico se separa de los demás productos de la reacción y del exceso de hidrocarburo sin transformar, y se reoxida a ácido nítrico. Así se pueden obtener más de 90 moles de parafina por cada 100 moles de ácido nítrico consumido.
Factores que influyen en la nitración
La temperatura no tiene una influencia directa sobre la orientación de los grupos -NO2, sin embargo, influye notablemente en la pureza del producto de reacción. Al elevar la temperatura se aumenta el grado de nitración. Cuando se han de nitrar compuestos fácilmente oxidabas, es muy importante mantener la temperatura lo suficientemente baja para evitar oxidaciones. En los compuestos aromáticos la temperatura interviene en la oxidación del nitrógeno.
- Agitación.
La reacción de nitración puede verificarse en fase ácida como en fase orgánica. Por emulsión puede conseguirse que cada fase esté siempre saturada de la otra y, en estas condiciones, la velocidad de reacción en cada fase es constante, aunque en la fase ácida es varias veces mayor que en la fase orgánica. La velocidad de reacción decrece rápidamente cuando la superficie de contacto entre las fases se reduce.
Este factor nos indica la solubilidad de los nitroderivados en el ácido sulfúrico. A medida que aumenta la temperatura crece la solubilidad; ésta disminuye con la dilución del ácido. Puesto que los nitroderivados se disuelven mejor en el ácido sulfúrico más concentrado, empleando mezclas sulfonítricas con gran concentración de H2S04 se podrá llegar antes a un determinado grado de nitración.
Datos térmicos referentes a la preparación y empleo de los nitroderivados.
- La reacción esencial en la nitración se desarrolla con un gran desprendimiento de calor.
- El calor de nitración disminuye a medida que aumenta el número de grupos nitro introducido.
- El calor de formación tiende a un máximo para el segundo o tercer miembro de la serie, y luego disminuye.
- Cuanto más próximos están los grupos nitro en el anillo del benceno, mayor es la tensión intramolecular y más bajo el calor de formación.
- Aparatos para la nitración
Las nitraciones se llevan acabo en calderas cerradas, provistas con mecanismo de agitación y dispositivos para poder regular la temperatura de reacción. Los nitradores se construyen ordinariamente de acero y fundiciones resistentes a los ácidos. En algunos casos se necesita emplear aleaciones más resistentes, como son los aceros al níquel - cromo. Los dos atributos esenciales de todo nitrador seguro y eficaz son la transmisión de calor y agitación.
Fuentes
- Bonner WA, Castro AJ. Química Orgánica Básica. 2 ed. La Habana; Editorial Pueblo y Revolución. 1979.
- http://www.monografías.com Monografías.com
- http://www.quimicaorganica.net/ Química Orgánica