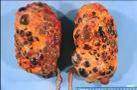
Síndrome de riñón poliquístico juvenil
Síndrome de riñón poliquístico juvenil. O enfermedad renal poliquística autosómica dominante (EPAD), es una enfermedad hereditaria frecuente y es la causa del 10 % de las insuficiencias renales crónicas terminales en pacientes con tratamiento dialítico. Es 20 veces más frecuente que la enfermedad de Huntington, 15 veces más frecuente que la fibrosis quística del páncreas y 10 veces más frecuente que la anemia drepanocítica. La prevalencia citada en la literatura es de 1 por 1000 habitantes y cada descendiente de un sujeto afectado tiene 50 % de probabilidad teórica de heredar la enfermedad.
Sumario
Historia del síndrome o la enfermedad
Algunos refieren que esta enfermedad fue reportada por primera vez en Francia a comienzos del siglo XVII y otros la sitúan a finales del siglo XIX. La naturaleza hereditaria de esta enfermedad fue reconocida desde principios del siglo XX. Los estudios de Dalgaard en 1957 establecieron el patrón de herencia autosómico dominante de la enfermedad, pero no fue hasta 1985 que se localizó un gen asociado con el riñón poliquístico autosómico dominante en el brazo corto del cromosoma 16.
Posteriormente se observó que en algunas familias no se detectan marcadores en el brazo corto del cromosoma 16, lo cual indicó que existía un segundo gen. Al primer grupo se le denominó riñón poliquístico autosómico dominante de tipo 1 (siglas en ingles: ADPKD1 ‘autosomic dominant polycystic kidney disease’) y al segundo, riñón poliquístico autosómico dominante de tipo 2 (ADPKD2). El tipo 1 es la causa de la enfermedad en cerca del 90 % o más de las familias que la padecen. Hasta ahora se han identificado por lo menos 3 locus diferentes como causantes de la enfermedad: PKD1, PKD2 y PKD3. El gen del tipo 2 se localiza en el brazo largo del cromosoma 4 y el locus del PKD3, aunque es probable que comprenda más de un gen, está localizado en el cromosoma 1q a nivel de HRPT2. El tipo PKD3 sólo aparece en aisladas familias.
Esta enfermedad es una de las primeras causas de insuficiencia renal crónica en el adulto y ha ganado importancia en pediatría desde que se describieron los primeros casos en niños. Desde hace más de 20 años es posible su diagnóstico prenatal en determinados casos, y el reporte más temprano es a las 16 semanas del embarazo. Se estima que aproximadamente el 2 % de los portadores del gen se presenta con manifestaciones graves en los niños. La insuficiencia renal puede presentarse desde los 2 hasta los 80 años.
Examen físico
- Abdomen: abultado con riñones papables, generalmente grandes.
- Hígado: si está quístico hay hepatomegalia (a veces también esplenomegalia si hay hipertensión portal por fibrosis). Tendencia a la deshidratación hiponatrémica, con poliuria.
Puede asociarse con aneurismas de las arterias cerebrales (10%) y anomalías cardiovasculares: coartación de la aorta y esclerosis endocárdica.
Exámenes paraclínicos
- Orina: Disminuida la concentración.
- Radiología: Urografía descendente (si la función renal es superior a un 50%): anomalías de los cálices, con dilatación y alargamiento.
- Ultrasonido renal.
Sindromogénesis y etiología
Se observan riñones engrosados hasta 2-5 veces el tamaño normal, con quistes intercomunicantes de 3-5 cm. de diámetro, de contenido líquido, en número variable. En el 40% de los casos en el hígado coexisten quistes asintomáticos hasta que ocurre fibrosis periportal. Se considera que pueda haber una acción metabólica tóxica, que sea la que origine lesiones renales secundarias.
Se ha referido una gran heterogeneidad fenotípica en las manifestaciones clínicas. El comienzo de la afección o de los quistes renales es variable interfamiliar. Existen casos de familias que fueron diagnosticados como portadores de PKD1 a través de un ultrasonido fetal.
El locus PKD1 se ha localizado en el cromosoma 16, específicamente en p. El defecto básico parece estar relacionado con proteínas de la estructura de las membranas celulares.
La hipertensión que puede acompañar a este síndrome se debe a la liberación incrementada de renina, probablemente causada por isquemia secundaria a la expansión renal de los quistes.
El dolor abdominal, en la espalda o en el flanco es uno de los síntomas frecuentes de la enfermedad; el 60 % de los pacientes lo padece. Se plantea que el dolor es debido a los riñones grandes, impresión que es apoyada por la observación de que el 80 % de los pacientes esté libre de síntomas durante 1 año y el 60 %, 2 años, si se le descomprimen los quistes. El drenaje de los quistes sólo debe hacerse cuando interfiere con las actividades normales del paciente, porque aunque el dolor puede producirse por la acumulación de líquido en los quistes con aumento de la presión intraluminal, la causa no está totalmente aclarada.
La infección urinaria se presenta en más de la tercera parte de los casos en algún momento de la vida, siendo más frecuente en las mujeres (72 %) que en los hombres (28 %). Por su localización, la infección puede dividirse en pionefrosis (infección de pelvis y cálices), infección renal parenquimatosa (infección bacteriana intersticial aguda) y piocisto (infección del quiste). La instrumentación es el mayor riesgo de infección y se presenta posteriormente a ésta en el 40 % de los casos, si no se utiliza el antibiótico adecuado. La infección quística puede ser difícil de diferenciar de la infección renal, aunque en la infección quística es más frecuente el dolor lumbar; en la infección renal es más frecuente el hemocultivo positivo y en la pionefrosis es más frecuente la leucocituria y la cilindruria. Estas diferencias son importantes para decidir el tratamiento. La infección perinefrítica tiene alta mortalidad.
La hematuria es el signo de presentación en el 35 % de los casos y en el 50 % de los pacientes se observa hematuria macroscópica o microscópica. El riesgo de hematuria parece asociarse a la hipertensión y el aumento del tamaño de los quistes. Aunque la mayoría de los pacientes señalan causas precipitantes como traumas y ejercicios violentos, no se ha demostrado una asociación precisa.
La nefrolitiasis se señala en el 15 a 20 % de los casos y ésta puede producir dolor y hematuria. Los cálculos están constituidos principalmente de urato y oxalato de calcio y están asociados con pH urinario bajo, descenso de la excreción urinaria de citrato y aumento de la excreción de ácido úrico. Se presenta proteinuria en aproximadamente un tercio de los pacientes, pero ésta es casi siempre ligera (< 1 g en 24 h). Los casos con proteinuria de rango nefrótico a los que se les ha realizado biopsia renal, tenían sobreañadida una enfermedad glomerular. La agregación familiar de formas clínicas precoces está sugerida por las modificaciones genéticas. La etiología es genética.
Complicaciones
- Hipertensión.
- Anemia.
- Infección urinaria recurrente.
- Infección renal recurrente.
- Cálculos en el riñón.
- Insuficiencia renal de leve a severa.
- Enfermedad renal en estado terminal.
- Sangrado o ruptura de quistes.
- Infección de los quistes del hígado.
- Insuficiencia hepática de leve a severa.
Prevención
Actualmente, ningún tratamiento puede evitar la formación o agrandamiento de los quistes.
Tratamiento
El objetivo del tratamiento es controlar los síntomas y prevenir las complicaciones. La hipertensión arterial puede ser difícil de controlar, pero su control es el aspecto más importante del tratamiento. Los tratamientos pueden abarcar:
- Medicamentos para la presión arterial
- Diuréticos
- Dieta baja en sal
- Cualquier infección urinaria se debe tratar oportunamente con los antibióticos apropiados.
- Es posible que los quistes que son dolorosos, que estén infectados, que estén sangrando o causen obstrucción necesiten ser drenados. (Por lo general hay demasiados quistes como para hacer de su extirpación una alternativa factible).
- Es probable que se requiera la extirpación quirúrgica de uno o ambos riñones. El tratamiento de la enfermedad renal en estado terminal puede incluir diálisis o trasplante de riñón.
Fuentes
- Chapman, A.B. et al.: ¨The renin-angiotensin-aldosterone system and autosomal dominant polycystic kidney disease¨. New. Eng. J. Med., 323: 1091-1096, 1970.