Diferencia entre revisiones de «Halógeno»
(Página creada con '<div align="justify"> {{Definición|Nombre=Halógenos|imagen=GrupoII.JPG|concepto=Nombre dado a los elementos de la familia del cloro (flúor, cloro, bromo y yodo) que combinado...') |
m (Texto reemplazado: «<div align="justify">» por «») |
||
| (No se muestran 30 ediciones intermedias de 8 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | + | ||
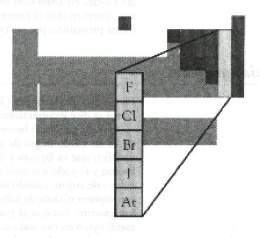
| − | {{Definición|Nombre=Halógenos|imagen= | + | {{Definición|Nombre=Halógenos|imagen=Image38.jpg|concepto=Nombre dado a los elementos del grupo VIIA de la Tabla Priódica de 18 columnas}} |
| + | '''Halógeno.''' Del griego ''halos'', (sal y ''genes'', engendrar), esto es, formadores de sales. La razón de tal denominación radica en que sus [[átomos]] tienen siete electrones en el último nivel y por tanto gran [[electronegatividad]]. | ||
== Estado natural == | == Estado natural == | ||
| + | Los halógenos, que ocupan el grupo VIIA de la [[Tabla Periódica de 18 columnas]] pueden encontrarse en la naturaleza, ya sea libres o formando numerosos compuestos. | ||
| − | + | ===Flúor=== | |
| + | La palabra [[flúor]] se deriva de ''fluere'', fundir, por emplearse el espato flúor como fundente. Su abundancia en la naturaleza viene a ser la mitad de la del [[cloro]]. Principalmente se presenta en los minerales espato flúor, CaF<sub>2</sub>, criolita, Na<sub>3</sub>AlF<sub>6</sub> y flourapatito Ca<sub>5</sub>F(PO<sub>4</sub>)<sub>3</sub>, además forma parte de muchas aguas minerales en pequeña proporción, así como también existe en los tallos de las [[gramínea]]s, esmalte de los dientes, en los huesos, en la [[leche]], [[orina]], [[ sangre]], etc. Generalmente los fluoruros no se encuentran disueltos, sino formando minerales como el apatito,CaF<sub>2</sub>, 3Ca<sub>3</sub>(PO<sub>4</sub>)<sub>2</sub>, y la criolita, AlF<sub>3</sub>. 3NaF. Esta última es esencial en la obtención del [[aluminio]]. | ||
| − | + | ===Cloro=== | |
| − | + | No existe libre en la naturaleza, pero es el más abundante de los halógenos (0,2 %) en estado de combinación y se presenta como anión cloruro en el agua del mar, pozos salinos, y yacimientos de sales, combinado con los cationes Na<sup>+</sup>, K<sup>+</sup>, Mg<sup>2+</sup> y Ca<sup>2+</sup>.También se encuentran grandes yacimientos de cloruro en algunos lugares de la corteza terrestre, los cuales se originan al secarse ciertos mares interiores. | |
| − | + | ===Bromo=== | |
| + | Del griego ''bromos'', hedor; el [[bromo]] se presenta como anión bromuro en el agua marina, en los pozos de agua salada y en los yacimientos salinos, también las cenizas de las algas de mar, en combinación con la plata se encuentra en algunos puntos, formando el mineral bromuro de plata, su abundancia no llega a la céntesima parte del [[cloro]]. | ||
| − | + | ===Yodo=== | |
| − | [[ | + | El [[yodo]] es el único de los halógenos que se presenta naturalmente en un estado de oxidación positivo. Aparte de los compuestos, en los que forma aniones I<sup>-</sup> (en el agua del mar y pozos salinos), se halla también como yodato de sodio, NaIO<sub>3</sub>, mezclado en pequeñas cantidades con la nitratina, NaNO<sub>3</sub>, en el nitro de [[Chile]] y [[Perú]], en el [[Aceite de hígado de bacalao]] y en forma de yoduro argéntico. |
| − | |||
== Propiedades == | == Propiedades == | ||
| + | A pesar de pertenecer al mismo grupo de la tabla periódica y por ello tener propiedades comunes, también poseen otras propiedades que los diferencian. | ||
| + | [[Image:Flúor.JPG|border|left|150px|Flúor.JPG]] | ||
| + | ===Flúor=== | ||
| + | Es un gas de color amarillo verdoso, de olor picante, pasa a estado líquido bajo presión ordinaria a 185<sup>º</sup> y tiene peso específico 1,26 con relación al aire. Las afinidades químicas de este cuerpo son extraordinariamente enérgicas. Con el [[hidrógeno]] se combina aún en la oscuridad con desprendimiento de calor. El [[yodo|diyodo]], [[azufre|octazufre]], [[fósforo|tetrafósforo]], [[arsénico]] y otras sustancias arden en atmósfera de flúor. | ||
| − | + | Se combina a la temperatura ordinaria en frío, desprendiéndose [[Ácido fluorhídrico]] y [[ozono]], siendo transformadas también las materias orgánicas, por la tendencia a formar dicho ácido. El [[vidrio]] es atacado por el flúor si está húmedo, lo cual no se verifica si el elemento se halla puro y seco. | |
| − | + | ===Cloro=== | |
| − | + | [[Image:Cloro1.JPG|border|right|150px|Cloro1.JPG]] | |
| − | + | El [[cloro]] es una gas de color amarillo verdoso, de olor penetrante característico, muy nocivo, que produce tos y en casos graves hemoptisis. Su densidad con relación al aire es 2,48. Sometido a 35<sup>º</sup> ó a 0<sup>º</sup> y presión de 6 atmósferas se líquida. Es bastante soluble en [[agua]], a 0<sup>º</sup> se disuelve vez y media su volumen de cloro, y a 8<sup>º</sup>, que presenta su máximo de solubilidad, un litro de agua puede mantener en disolución cerca de cuatro y medio litros de cloro. | |
| − | |||
| − | |||
| − | == | + | Se combina directamente con casi todos los [[metales]] y no metales. Sus afinidades no son tan enérgicas como las del flúor. Se combina con el [[hidrógeno]] lentamente a la luz difusa y violentamente con explosión por la acción de los rayos solares por la chispa eléctrica ó á la temperatura de 300<sup>º</sup>. El [[fósforo]], [[arsénico]] y [[antimonio]] proyectados en un frasco que contenga cloro, se inflaman al combinarse con él. El flúor, [[oxígeno]], [[nitrógeno]], [[argón]] y [[carbono]] no se combinan directamente por cuya razón los compuestos de cloro y oxígeno y de áquel y nitrógeno resultan sumamente explosivos. |
| + | ===Bromo=== | ||
| + | [[Image:Electron_shell_035_bromine.png|border|left|150px|Bromine.jpg]] | ||
| + | El [[bromo]] es un líquido rojo, de olor irritante, su acción bastante corrosiva y sus vapores irritan extraordinariamente la conjuntiva, por lo que son peligrosos para la vista. Su densidad es de 3,187 á 0<sup>º</sup>, se solidifica á 7<sup>º</sup> cuando está húmedo y á 25<sup>º</sup> cuando puro. Es muy volátil a la temperatura ordinaria, hierve a 63<sup>º</sup> y la densidad de sus vapores a 445<sup>º</sup> es 5,24. Es poco soluble en agua. | ||
| − | En el | + | Las propiedades químicas del bromo son análogas a las del cloro, pero menos enérgicas. Con el [[hidrógeno]] se combina formando [[Ácido bromhídrico]] bajo la influencia de la luz. Con el oxígeno lo hace indirectamente lo mismo que con el nitrógeno y directamente con la mayor parte de los restantes no metales y [[metales]]. En presencia de un cuerpo oxidable, el agua de bromo actúa como oxidante. Descompone al hidrógeno sulfurado, dando ácido bromhídrico y [[azufre]]. Por esta afinidad con el hidrógeno actúa sobre las materias orgánicas como el cloro, pero con menos intensidad. Es también decolorante y desinfectante. Sobre la [[piel]] produce úlceras de difícil curación. |
| + | ===Yodo=== | ||
| + | [[Image:Yodo1.jpg|border|right|150px|Yodo1.jpg]] | ||
| + | El [[yodo]] es un cuerpo sólido de color gris oscuro, con brillo metálico, de olor parecido al del bromo y de sabor amargo. Su densidad es de 4,95. Funde a 114<sup>º</sup> y hierve a 200<sup>º</sup>, emitiendo a la temperatura ordinaria vapores de color violáceo. El yodo se presenta en láminas con forma de rombos y puede cristalizar en forma octoédrica. Es poco soluble en el agua, pero su solubilidad aumenta si contiene ácido yodhídrico o yoduros alcalinos, se disuelve en el [[alcohol]] (formando la tintura de yodo), en [[Eteres|éter]], bencina, sulfuro de carbono, etc. | ||
| − | + | Sus propiedades químicas son las mismas que las del cloro y bromo, pero menos acentuadas. Con el hidrógeno no se combina el yodo directamente. Con el cloro y bromo se combina y con el fósforo, reacciona violentamente. Lo mismo sucede con el [[potasio]] y el [[cobre]] previamente calentados. En presencia de un oxidante enérgico, actúa de reductor en contacto del agua pasando a ácido yódico. Con el [[amoníaco]] forma el yoduro de nitrógeno, sustancia muy explosiva. | |
| − | + | == Obtención == | |
| − | El [[ | + | El [[flúor]] se obtiene por oxidación electrolítica de los fluoruros fundidos como por ejemplo una mezcla de fluoruros de potasio e hidrógeno. |
| − | + | El [[cloro]] en pequeña escala se puede obtener por oxidación del anión cloruro con agentes químicos por ejemplo con dióxido de manganeso: | |
| + | MnO<sub>3</sub>(s) + 2Cl<sup>-</sup> + 4H<sup>+</sup> = Mn<sup>2+</sup> + Cl<sub>2</sub>(g) + 2H<sub>2</sub>O. | ||
| − | + | En escala comercial es más económico prepararlo por oxidación electrolítica del cloruro sódico fundido o disuelto en agua. El [[bromo]] se suele preparar oxidando con cloro las soluciones de los bromuros (un método consiste en hacer pasar cloro gaseoso a través de agua marina). Puesto que el cloro es más oxidante que el bromo, la reacción: | |
| + | Cl<sub>2</sub>(g) + 2Br<sup>-</sup> = Br<sub>2</sub> + 2Cl<sup>-</sup>" | ||
| + | tendrá lugar en el sentido indicado. El bromo formado se separa de la solución aireando esta, ya que es sumamente volátil. La mayor parte se obtiene oxidando los yoduros de los pozos de agua salina por medio del cloro. | ||
| − | + | == Aplicaciones == | |
| + | Los derivados del flúor tienen una notable importancia en el ámbito de la industria. Entre ellos destacan los hidrocarburos fluorados, como el anticongelante freón y la resina teflón, lubricante de notables propiedades mecánicas. Los fluoruros son útiles como insecticidas. Además, pequeñísimas cantidades de flúor añadidas al agua potable previenen la [[Caries dental]]. | ||
| − | El | + | El cloro encuentra su principal aplicación como agente de blanqueo en las industrias papelera y textil. Asimismo se emplea en la esterilización del agua potable y de las piscinas, y en las industrias de colorantes, medicamentos y desinfectantes. |
| − | Los | + | Los bromuros actúan médicamente como sedantes, y el bromuro de plata se utiliza como un elemento fundamental en las placas fotográficas. |
| − | + | El [[yodo]], cuya presencia en el organismo humano resulta esencial y cuyo defecto produce [[bocio]], se emplea como [[antisépticos|antiséptico]] en caso de [[herida]]s y quemaduras. | |
| − | |||
| − | |||
| − | |||
| − | El | ||
| − | |||
| − | |||
| − | |||
| − | |||
== Véase también == | == Véase también == | ||
| − | + | *[[Cloro]] | |
| − | *[[ | + | *[[Flúor]] |
| − | + | *[[Bromo]] | |
| + | *[[Yodo]] | ||
== Enlaces externos == | == Enlaces externos == | ||
| − | + | *[http://quimicaparatodos.blogcindario.com/2009/08/00044-grupo-vii-grupo-de-los-halogenos.html GRUPO VII. Grupo de los Halógenos] | |
| − | *[http:// | + | *[http://www.monografias.com/trabajos/tabperio/tabperio.shtml Análisis de los elementos de la Tabla Periódica] |
| − | *[http:// | + | *[http://2aquimica.blogspot.com/ Los HaLogenos] |
| + | *[http://www.textoscientificos.com/quimica/inorganica/halogenos Los Halógenos] | ||
== Fuentes == | == Fuentes == | ||
| − | |||
*Babor, Joseph A. y Aznárez, José Ibarz. Química General Moderna. La Habana: [[Instituto Cubano del Libro]], [[1969]]. | *Babor, Joseph A. y Aznárez, José Ibarz. Química General Moderna. La Habana: [[Instituto Cubano del Libro]], [[1969]]. | ||
| + | *Dr. D Luis Bermejo Vida.Elementos de Química General y Descriptiva. Valencia, 1909. | ||
| + | *De Galiano Mingot, Tomás.Pequeño Larousse de Ciencias Técnicas | ||
*Plane, Robert A. y Sienko, Michel J. Química. Colección de Ciencia-Técnica Aguiar. | *Plane, Robert A. y Sienko, Michel J. Química. Colección de Ciencia-Técnica Aguiar. | ||
| − | + | [[Category:Halógenos]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
última versión al 09:42 22 ago 2019
| ||||||
Halógeno. Del griego halos, (sal y genes, engendrar), esto es, formadores de sales. La razón de tal denominación radica en que sus átomos tienen siete electrones en el último nivel y por tanto gran electronegatividad.
Sumario
Estado natural
Los halógenos, que ocupan el grupo VIIA de la Tabla Periódica de 18 columnas pueden encontrarse en la naturaleza, ya sea libres o formando numerosos compuestos.
Flúor
La palabra flúor se deriva de fluere, fundir, por emplearse el espato flúor como fundente. Su abundancia en la naturaleza viene a ser la mitad de la del cloro. Principalmente se presenta en los minerales espato flúor, CaF2, criolita, Na3AlF6 y flourapatito Ca5F(PO4)3, además forma parte de muchas aguas minerales en pequeña proporción, así como también existe en los tallos de las gramíneas, esmalte de los dientes, en los huesos, en la leche, orina, sangre, etc. Generalmente los fluoruros no se encuentran disueltos, sino formando minerales como el apatito,CaF2, 3Ca3(PO4)2, y la criolita, AlF3. 3NaF. Esta última es esencial en la obtención del aluminio.
Cloro
No existe libre en la naturaleza, pero es el más abundante de los halógenos (0,2 %) en estado de combinación y se presenta como anión cloruro en el agua del mar, pozos salinos, y yacimientos de sales, combinado con los cationes Na+, K+, Mg2+ y Ca2+.También se encuentran grandes yacimientos de cloruro en algunos lugares de la corteza terrestre, los cuales se originan al secarse ciertos mares interiores.
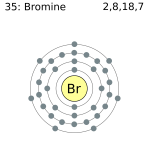
Bromo
Del griego bromos, hedor; el bromo se presenta como anión bromuro en el agua marina, en los pozos de agua salada y en los yacimientos salinos, también las cenizas de las algas de mar, en combinación con la plata se encuentra en algunos puntos, formando el mineral bromuro de plata, su abundancia no llega a la céntesima parte del cloro.
Yodo
El yodo es el único de los halógenos que se presenta naturalmente en un estado de oxidación positivo. Aparte de los compuestos, en los que forma aniones I- (en el agua del mar y pozos salinos), se halla también como yodato de sodio, NaIO3, mezclado en pequeñas cantidades con la nitratina, NaNO3, en el nitro de Chile y Perú, en el Aceite de hígado de bacalao y en forma de yoduro argéntico.
Propiedades
A pesar de pertenecer al mismo grupo de la tabla periódica y por ello tener propiedades comunes, también poseen otras propiedades que los diferencian.
Flúor
Es un gas de color amarillo verdoso, de olor picante, pasa a estado líquido bajo presión ordinaria a 185º y tiene peso específico 1,26 con relación al aire. Las afinidades químicas de este cuerpo son extraordinariamente enérgicas. Con el hidrógeno se combina aún en la oscuridad con desprendimiento de calor. El diyodo, octazufre, tetrafósforo, arsénico y otras sustancias arden en atmósfera de flúor.
Se combina a la temperatura ordinaria en frío, desprendiéndose Ácido fluorhídrico y ozono, siendo transformadas también las materias orgánicas, por la tendencia a formar dicho ácido. El vidrio es atacado por el flúor si está húmedo, lo cual no se verifica si el elemento se halla puro y seco.
Cloro
El cloro es una gas de color amarillo verdoso, de olor penetrante característico, muy nocivo, que produce tos y en casos graves hemoptisis. Su densidad con relación al aire es 2,48. Sometido a 35º ó a 0º y presión de 6 atmósferas se líquida. Es bastante soluble en agua, a 0º se disuelve vez y media su volumen de cloro, y a 8º, que presenta su máximo de solubilidad, un litro de agua puede mantener en disolución cerca de cuatro y medio litros de cloro.
Se combina directamente con casi todos los metales y no metales. Sus afinidades no son tan enérgicas como las del flúor. Se combina con el hidrógeno lentamente a la luz difusa y violentamente con explosión por la acción de los rayos solares por la chispa eléctrica ó á la temperatura de 300º. El fósforo, arsénico y antimonio proyectados en un frasco que contenga cloro, se inflaman al combinarse con él. El flúor, oxígeno, nitrógeno, argón y carbono no se combinan directamente por cuya razón los compuestos de cloro y oxígeno y de áquel y nitrógeno resultan sumamente explosivos.
Bromo
El bromo es un líquido rojo, de olor irritante, su acción bastante corrosiva y sus vapores irritan extraordinariamente la conjuntiva, por lo que son peligrosos para la vista. Su densidad es de 3,187 á 0º, se solidifica á 7º cuando está húmedo y á 25º cuando puro. Es muy volátil a la temperatura ordinaria, hierve a 63º y la densidad de sus vapores a 445º es 5,24. Es poco soluble en agua.
Las propiedades químicas del bromo son análogas a las del cloro, pero menos enérgicas. Con el hidrógeno se combina formando Ácido bromhídrico bajo la influencia de la luz. Con el oxígeno lo hace indirectamente lo mismo que con el nitrógeno y directamente con la mayor parte de los restantes no metales y metales. En presencia de un cuerpo oxidable, el agua de bromo actúa como oxidante. Descompone al hidrógeno sulfurado, dando ácido bromhídrico y azufre. Por esta afinidad con el hidrógeno actúa sobre las materias orgánicas como el cloro, pero con menos intensidad. Es también decolorante y desinfectante. Sobre la piel produce úlceras de difícil curación.
Yodo
El yodo es un cuerpo sólido de color gris oscuro, con brillo metálico, de olor parecido al del bromo y de sabor amargo. Su densidad es de 4,95. Funde a 114º y hierve a 200º, emitiendo a la temperatura ordinaria vapores de color violáceo. El yodo se presenta en láminas con forma de rombos y puede cristalizar en forma octoédrica. Es poco soluble en el agua, pero su solubilidad aumenta si contiene ácido yodhídrico o yoduros alcalinos, se disuelve en el alcohol (formando la tintura de yodo), en éter, bencina, sulfuro de carbono, etc.
Sus propiedades químicas son las mismas que las del cloro y bromo, pero menos acentuadas. Con el hidrógeno no se combina el yodo directamente. Con el cloro y bromo se combina y con el fósforo, reacciona violentamente. Lo mismo sucede con el potasio y el cobre previamente calentados. En presencia de un oxidante enérgico, actúa de reductor en contacto del agua pasando a ácido yódico. Con el amoníaco forma el yoduro de nitrógeno, sustancia muy explosiva.
Obtención
El flúor se obtiene por oxidación electrolítica de los fluoruros fundidos como por ejemplo una mezcla de fluoruros de potasio e hidrógeno.
El cloro en pequeña escala se puede obtener por oxidación del anión cloruro con agentes químicos por ejemplo con dióxido de manganeso: MnO3(s) + 2Cl- + 4H+ = Mn2+ + Cl2(g) + 2H2O.
En escala comercial es más económico prepararlo por oxidación electrolítica del cloruro sódico fundido o disuelto en agua. El bromo se suele preparar oxidando con cloro las soluciones de los bromuros (un método consiste en hacer pasar cloro gaseoso a través de agua marina). Puesto que el cloro es más oxidante que el bromo, la reacción: Cl2(g) + 2Br- = Br2 + 2Cl-" tendrá lugar en el sentido indicado. El bromo formado se separa de la solución aireando esta, ya que es sumamente volátil. La mayor parte se obtiene oxidando los yoduros de los pozos de agua salina por medio del cloro.
Aplicaciones
Los derivados del flúor tienen una notable importancia en el ámbito de la industria. Entre ellos destacan los hidrocarburos fluorados, como el anticongelante freón y la resina teflón, lubricante de notables propiedades mecánicas. Los fluoruros son útiles como insecticidas. Además, pequeñísimas cantidades de flúor añadidas al agua potable previenen la Caries dental.
El cloro encuentra su principal aplicación como agente de blanqueo en las industrias papelera y textil. Asimismo se emplea en la esterilización del agua potable y de las piscinas, y en las industrias de colorantes, medicamentos y desinfectantes.
Los bromuros actúan médicamente como sedantes, y el bromuro de plata se utiliza como un elemento fundamental en las placas fotográficas.
El yodo, cuya presencia en el organismo humano resulta esencial y cuyo defecto produce bocio, se emplea como antiséptico en caso de heridas y quemaduras.
Véase también
Enlaces externos
- GRUPO VII. Grupo de los Halógenos
- Análisis de los elementos de la Tabla Periódica
- Los HaLogenos
- Los Halógenos
Fuentes
- Babor, Joseph A. y Aznárez, José Ibarz. Química General Moderna. La Habana: Instituto Cubano del Libro, 1969.
- Dr. D Luis Bermejo Vida.Elementos de Química General y Descriptiva. Valencia, 1909.
- De Galiano Mingot, Tomás.Pequeño Larousse de Ciencias Técnicas
- Plane, Robert A. y Sienko, Michel J. Química. Colección de Ciencia-Técnica Aguiar.