Cyclospora cayetanensis
| ||||
Cyclospora cayetanensis (C.cayetanensis) es un protozoo patógeno emergente causante de enfermedad diarreica. Esta coccidia era referida, por desconocerse su ubicación taxonómica, como cuerpos similares a cyanobacteria o formas grandes de Cryptosporidium. Fue después de los estudios realizados por Ortega et al. que se conoció su clasificación taxonómica. Estos investigadores después de inducir la esporulación con solución de dicrómato de potasio a los conocidos como “cuerpos similares a cyanobacterias” procedentes de casos clínicos, demostraron que el microorganismo contenía por cada ooquiste, dos esporoquistes y dentro de cada uno de ellos dos esporozoítos. Las características de los esporozoítos observadas al microscopio electrónico mostraron organelos característicos de los protozoos coccidias (Phylum Apicomplexa). Fue así como después de identificar que pertenecían al género Cyclospora.
Sumario
Ciclo de vida de la Cyclospora
Es un género en el Phylum Apicomplexa, de esta manera el parásito se relaciona íntimamente con otros cuatro agentes biológicos dentro del grupo coccidias: Cryptosporidium, Isospora, Toxoplasma y Sarcocystis.
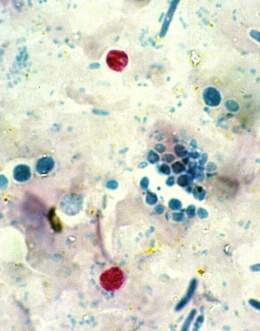
Se puede distinguir de otras coccidias por su tamaño, forma y número de esporoquistes y esporozoítos. Los ooquistes de C. cayetanensis, hasta el presente la única especie que se reporta en el humano, son esféricos, con doble pared y miden de 8 a 10 μm de diámetro; son algo más pequeños que los quistes de Cyclospora descritos en hospederos no humanos. Al examinar las heces en fresco que contienen quistes de C. cayetanensis, estos se ven como esferas hialinas (figura). En su interior presentan una mórula de color verdoso con varios glóbulos refringentes que se disponen a modo de racimo o roseta. Cuando esporula, en su interior se encuentran dos esporoquistes, cada uno con dos esporozoítos. En heces viejas o preservadas, se ven pocos glóbulos en su interior.
Como los quistes de Cryptosporidium e Isospora, son ácido-alcohol resistentes.
El ciclo de vida de Cyclospora cayetanensis no ha sido totalmente dilucidado. La presencia de quistes en heces sugiere que el ciclo sexual y el asexual pueden desarrollarse en el hospedero humano. Su localización es intracitoplasmática, dentro de una vacuola parasitófora en la región apical supranuclear de las células epiteliales del intestino delgado; allí se reproduce y se multiplica. Al salir al exterior con las heces los ooquistes no están esporulados. Requieren de tiempo fuera del hospedero para su esporulación y convertirse en infecciosos, por tanto la transmisión de persona a persona no es probable. El tiempo requerido para la esporulación en la naturaleza no es conocido. En el laboratorio los microorganismos en condiciones óptimas de laboratorio esporulan dentro de las primeras dos semanas de excretados. Se plantea que la forma infectante llega a un nuevo hospedero susceptible a través del agua y los alimentos contaminados.
Epidemiología
La incidencia y prevalencia de la infección por Cyclospora cayetanensis se desconocen, en parte por la pobre asistencia a las consultas médicas de las personas con cuadros diarreicos, la poca sensibilidad de las técnicas diagnósticas disponibles, el número reducido de ooquistes que aparece en las heces del paciente, unido al poco uso de técnicas de concentración para protozoos en los laboratorios, así como la poca indicación de realización de la técnica de Ziehl-Neelsen y la inexperiencia de muchos de los laboratoristas para identificar los quistes de Cyclospora. Sin embargo, esta infección está siendo reportada en forma creciente en numerosos países a escala mundial, incluyendo Guatemala, Venezuela, Nueva Guinea, Cuba, Brasil, EUA, Canadá, Haití, Colombia y Turquía, Perú, Vietnam, Nepal, Egipto, entre otros. Esta información, en la mayor parte de las notificaciones, proviene de estudios realizados en viajeros internacionales, inmunodeprimidos y escolares. En el continente americano se han realizado múltiples reportes de esta infección Cyclospora es transmitida por la ingestión de quistes esporulados, los cuales aparecen como resultado de la contaminación fecal de las aguas y los alimentos.
Los brotes de transmisión por alimentos resaltan la necesidad de fortalecer las medidas de control y de prevención para asegurar que los productos alimentarios que se comen crudos estén libres de Cyclospora cayetanensis, además de la necesidad de continuar investigando sobre la biología y la epidemiología de esta coccidia. También se ha reportado la presencia de portadores sanos, especialmente en países donde la infección es endémica.
La influencia del clima en la infección ha sido vista en muchos países, a pesar de los diferentes tipos de climas. Aunque se desconocen las causas, se piensa guarde relación, en parte, a la fluctuación de temperatura y humedad.
Patogenia
Después de la exquistación del ooquiste de Cyclospora cayetanensis, los esporozoítos invaden los entericitos del intestino delgado (porción distal del duodeno y el yeyuno), dentro de los cuales se reproducen sexual y asexualmente. Las formas asexuales del parásito han sido encontradas en posición supranuclear dentro del citoplasma, en las vacuolas parasitóforas. Ortega et al. en un estudio realizado en 17 pacientes observaron los gametocitos de este parásito por medio de microscopía óptica y electrónica.
Investigadores como Connor et al. han encontrado que en casos asintomáticos la estructura histológica suele estar conservada. En casos sintomáticos, junto a la presencia de diferentes estadios del parásito dentro del enterocito, existen anomalías histológicas como el acortamiento de las vellosidades intestinales y alteraciones celulares de los enterocitos, los que adquieren forma columnar o cuboide; hay hiperplasia de las criptas y presencia de un infiltrado inflamatorio de leucocitos polimorfonucleares, linfocitos y células plasmáticas en la lámina propia. Muchos de los cambios inflamatorios pueden persistir, aún después de que la infección cura.
Manifestaciones clínicas
Después de un corto período de incubación, aparece diarrea líquida acompañada de astenia importante, pérdida de peso (70-90% de los casos) y, en ocasiones, otros síntomas, como eructos, náuseas, vómitos, flatulencia, dolor abdominal y fiebre. La enfermedad tiene una duración variable (media, 39 días) y suele ser intermitente.
Diagnóstico
El diagnóstico de la infección por Cyclospora se sustenta al demostrar los ooquistes en muestras de heces y ocasionalmente en aspirados duodenales. Los ooquistes se ven como esferas de 8 a 10 μm de diámetro que contienen numerosos glóbulos encerrados en su interior. Los ooquistes de Cyclospora autoflorescen como círculos azules cuando se examinan con un microscopio de fluorescencia ultravioleta ajustado con un filtro de excitación de 365nm.
Esta propiedad no es específica para Cyclospora y disminuye con el tiempo de la muestra.
El examen de las heces frescas por el método directo con Solución de Lugol parasitológico pone al descubierto la presencia de esta infección. En muchos pacientes en los que sólo aparece un número reducido de microorganismos, se impone entonces hacer uso de las técnicas de concentración como la de Ritchie y la de Sheater.
Al igual que los quistes de Cryptosporidium e Isospora, los quistes de Cyclospora son ácidoalcohol resistente; por ello la técnica de Ziehl-Neelsen modificada y la coloración de Kinyoun son de utilidad para revelar la presencia. Con estas coloraciones permanentes es posible distinguir mejor los quistes al verlos con mayor aumento.
- El diagnóstico diferencial con Cryptosporidium se facilita al ser diferente la forma en que Cyclospora toma la coloración, algunos quistes de esta última no se colorean y otros toman una coloración que puede transitar desde el rosado hasta un rojo oscuro, a diferencia de Cryptosporidium que se visualiza rojo oscuro. Si se usa una lente calibrada permite con facilidad medir los quistes de Cryptosporidium que miden entre 3-5 μm, diferenciándolos de los de Cyclospora cayetanensis que son dos veces el diámetro de estos, entre 8 –10 μm; además tienen la ventaja de poder corroborarse el diagnóstico por otro microscopista, a la vez que la lámina puede quedar para el examen posterior en la historia clínica del paciente.
Tratamiento
En la actualidad, la única droga que se muestra como tratamiento de elección para la infección por C. cayetanensis es el trimetoprim-sulfametoxazol (TMP-SMX), el que provoca la mejoría clínica y la erradicación del parásito en un alto por ciento de los casos.(16,40,56) La dosificación propuesta para los adultos ha sido (160/800mg) tomado 2 veces al día durante 7 a 10 días. Evaluar el equilibrio hidromineral y ácido básico del paciente también debe considerarse en casos de diarrea por Cyclospora cayetanensis.
En pacientes que viven con el HIV o que tienen SIDA, cuando toman TMP-SMX para la profilaxis o tratamiento de la Toxoplasmosis o la Neumonía por Pneumocystis jirocecci reciben el beneficio adicional de poder evitar las infecciones por Isospora y Cyclospora.
Para aquellos que padecen cyclosporosis, Pape et al., han dado evidencias de que el TMP-SMX (160/800 mg)4 veces al día durante 10 días es efectivo, seguido de la profilaxis secundaria con este medicamento 3 veces a la semana es eficaz para prevenir las recurrencias. Otros estudios reportan que con esta droga desaparecen los síntomas y los parásitos en un alto por ciento de los tratados. Fármacos como la norfloxacina, el tinidazol, la quinacrina, el ácido nalidíxico, el furoato de diloxanida.
El metronidazol, la azitromicina y el albendazol han sido evaluados y no parecen ser efectivos.
Se ha propuesto el uso de la ciprofloxacina a partir de un pequeño estudio aleatorio controlado que comparaba a esta droga con el TMP-SMX en el tratamiento de la profilaxis secundaria para esta parasitosis en pacientes infectados por el HIV.
La ciprofloxacina es menos efectiva, pero resulta útil en aquellos pacientes que no toleran el TMP-SMX. A la dosis de 500 mg 2 veces al día durante 7 días como terapia y 3 veces a la semana por 10 semanas como profilaxis secundaria, resultó ser moderadamente eficaz. Se propone también la nitazoxanida por algunos autores.
Prevención y control
Las medidas de prevención
- La filtración parece ser un método útil, al permitir eliminar los quistes del agua, basándose en su tamaño;
- Hervir el agua para beber, se sabe que este parásito es resistente a la cloración.
- En cuanto a los alimentos que se consumen crudos, en Perú, en un estudio en el que se tomaron muestras de vegetales en algunos mercados durante las estaciones de alta incidencia, al final de esta estación y durante la estación de baja incidencia, se demostró
que aún lavando los vegetales los ooquistes de Cyclospora no eran posibles de eliminar por completo.(61) Se recomienda a personas que viajan a países donde esta coccidia ha sido reportada que se tomen estos aspectos en consideración, especialmente en los finales de la primavera e inicios del verano. En los pacientes con SIDA el tratamiento con TMPSMX como profilaxis de la neumonía por Pneumocystis jiroveci y la toxoplasmosis parece ser de gran valor en la prevención de cyclosporosis.
Fuente
- Santiago Valdés Martín,Anabel Gómes Vasallo. Temas de Pediatría, La Habana 2006 ;393:e159-e160.
- Ministerio de Salud Pública; Cuba(1997):Controles de foco en la atención primaria de salud.