Infarto del miocardio no complicado
| ||||
Infarto del miocardio no complicado.
Sumario
Etiología y definición
Criterios de clasificación de IAM
Los criterios de la WHO para el diagnóstico de IAM han sido modificados. En la actualidad el diagnóstico de IAM se hace en base a:
- Elevación y posterior caída de los niveles de enzimas cardíacas específicas (troponinas con un descenso más lento y CPK-MB más rápido), compañado de al menos uno de los siguientes:
1. Dolor de características compatibles con etiología isquémica. 2. Cambios en el ECG compatibles con isquemia aguda (ascenso o descenso del segmento ST). 3. Desarrollo de nuevas ondas Q. 4. Intervención coronaria (por ejemplo angioplastia).
- Hallazgos en la anatomía patológica compatibles con necrosis cardíaca (MIR 00-01F, 56; MIR 99-00F, 45).
Causas más frecuentes de infarto de miocardio
1) Trombosis coronaria. Es la causa más frecuente, y ocurre generalmente por rotura de una placa, que generalmente es pequeña, pero con gran contenido en grasa. 2) Otras causas:
- Embolia coronaria.
- Vasoespasmo: por cocaína, ergotamina, estrés emocional, etc.
- Disección espontánea de una arteria coronaria.
- Yatrogénico (cirugía cardíaca e intervencionismo coronario).
- Hipoxemia profunda, enfermedad del suero, anemia de células falciformes, envenenamiento por CO, estados de hipercoagulabilidad.
Clínica
Dolor. Lo típico es que sea opresivo y de localización retroesternal, pudiendo irradiarse a otras zonas, como brazo y antebrazo izquierdos (y raramente derechos), cuello, mandíbula y espalda. A veces se localiza en el epigastrio o en la extremidad superior izquierda, abdomen, etc. El dolor puede acompañarse de síntomas vegetativos, como sudoración fría, náuseas, vómitos, etc., así como de ansiedad y sensación de muerte inminente.
El dolor es generalmente más intenso y duradero que el de la angina, aunque también puede faltar, como ocurre frecuentemente en ancianos y diabéticos.
El dolor del infarto aparece generalmente en reposo, aunque también puede hacerlo durante o después del ejercicio; es más frecuente que aparezca por las mañanas (en las primeras horas tras levantarse).
Gran parte de los pacientes que tienen un IAM han tenido previamente historia de angina de pecho. Otros síntomas de presentación, son disnea, debilidad, arritmias, embolismos sistémicos, hipotensión o puede también presentarse como una de las complicaciones del IAM.
Exploración física
Puede haber alguno de los siguientes:
- Hiperactividad simpática (taquicardia e hipertensión arterial) o hiperactividad parasimpática (bradicardia e hipotensión arterial). En el IAM generalmente disminuye algo la presión arterial, pero puede subir.
- Signos de disfunción ventricular:
- Presencia de 3R y/o 4R.
- Impulso apical anormal.
- Disminución de la intensidad de los ruidos cardíacos.
- Desdoblamiento de 2R.
Pruebas complementarias
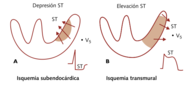
1. Electrocardiograma. Puede haber cambios en: a. La onda T. Imagen de isquemia miocárdica:
- T positivas e isoeléctricas: isquemia subendocárdica.
- T negativas: isquemia subepicárdica.
b. El segmento ST. Imagen de lesión miocárdica.
- ST descendido: lesión subendocárdica.
- ST elevado: lesión subepicárdica.
c. El complejo QRS. La aparición de ondas Q es índice de necrosis miocárdica. Hay infartos con ondas Q (que generalmente son transmurales) e infartos sin onda Q (que generalmente son subendocárdicos o no transmurales).
Evolución electrocardiográfica de un IAM
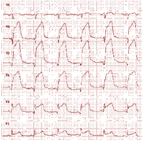
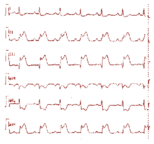
Las alteraciones en el ECG en el contexto del IAM tienen una importancia extraordinaria. De hecho, la actitud terapéutica ante un paciente con dolor que sugiere un síndrome coronario agudo viene determinada por los hallazgos iniciales en el ECG. Por ello, en todo paciente con esta sospecha hay que obtener un ECG completo con la mayor rapidez posible. En el IAM con oclusión completa de una arteria epicárdica se producen alteraciones evolutivas que siguen un patrón muy típico:
- Inicialmente se producen ondas T altas y picudas (isquemia hiperaguda), que se siguen de elevación del segmento ST. La elevación del ST nos sirve para localizar la zona que está sufriendo isquemia (ver figuras 41 y 42). Posteriormente, el segmento ST tiende a volver a la línea isoeléctrica y la onda T se hace negativa (inversión profunda y simétrica de la onda T). Asimismo se desarrollan ondas Q en las derivaciones en las que se produjo elevación del segmento ST. La cronología y extensión de estos cambios depende del tratamiento y del tiempo de evolución de la isquemia hasta el mismo (por ejemplo, si un IAM se trata en una fase muy temprana, con recanalización de la arteria afectada, pueden no desarrollarse ondas de necrosis). La inversión de la onda T puede posteriormente persistir o normalizarse tras semanas o meses. La persistencia de elevación del ST en derivaciones en las que se han desarrollado ondas de necrosis puede indicar la presencia de un aneurisma ventricular o de segmentos con movimientos anómalos (disquinesia). En algunos casos (aunque muy raramente), se puede producir una normalización completa del ECG.
Las alteraciones de la onda T generalmente ocupan más derivaciones que los del ST, y éstas más que los de la onda Q (isquemia>lesión>necrosis).
En las zonas opuestas a donde se localiza el IAM, ocurren alteraciones electrocardiográficas que son recíprocas u opuestas a las que aparecen en las derivaciones que localizan el IAM. Así, por ejemplo, en un infarto de localización inferior aparece elevación del ST en II, III y aVF, pero puede aparecer también descenso del ST en las derivaciones precordiales (aunque los cambios recíprocos pueden también corresponder a isquemia concomitante en otras zonas por compromiso de otras ramas coronarias, además de la responsable del IAM).
- Aunque existen excepciones a esta regla, generalmente los IAM con oclusión completa de una arteria epicárdica producen una zona de necrosis transmural y generan ondas Q, mientras que si la oclusión no ha sido completa o la afectación no ocupa el espesor de la pared pueden no generarse ondas Q. Sin embargo, dado que existen excepciones, se recomienda la denominación de IAM con o sin ondas Q en vez de IAM transmural o no transmural. En los IAM sin onda Q, existe con más frecuencia territorio miocárdico en riesgo (sería, por así decir, una necrosis incompleta), por lo que en ellos es más frecuente la angina post-IAM y el reinfarto. El pronóstico inicial es más favorable en los IAM sin onda Q al ser de menor extensión, pero posteriormente se igualan si no cambiamos su historia natural por ser frecuente la angina pos-IAM y el reinfarto. (MIR 97-98F, 15; MIR 95-96, 180).
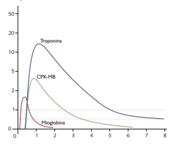
== Datos de laboratorio==. Tradicionalmente, las enzimas utilizadas en el diagnóstico del IAM eran la CPK y su fracción CPK-MB y las enzimas GOT y LDH. El patrón temporal de las mismas tiene valor diagnóstico (MIR 00-01, 55).
Actualmente, si se dispone de determinación de enzimas específicas (troponinas y CPK-MB masa), no se recomienda la determinación de LDH y GOT.
1. CPK: es una enzima presente en el músculo. Se eleva en el IAM, pero también en otras situaciones que producen daño muscular. Comienza a elevarse a las 4-8 horas, tiene un pico a las 24 horas y desaparece aproximadamente a las 48-72 horas. Dada su inespecifidad, se han desarrollado mediciones de fracciones más específicas (isoenzimas). Así, la fracción MB de la CPK, sobre todo la medida por enzimoinmunoensayo (la denominada CPK-MB masa), tiene una mayor especificidad que la primera.
La isoforma CPK-MB2 aporta una mayor especificidad, aunque su uso está mucho menos generalizado. Valores de la CPK-MB mayores del 8-10% del total de la CPK plasmática apoyan el rigen cardíaco de esta elevación.
Causas de elevación de CPK diferentes del IAM:
- Algunas enfermedades musculares: traumatismos, distrofias, miotonías, polimiositis, etc.
- Cardioversión eléctrica (ésta también eleva la CPK-MB).
- Hipotiroidismo.
- Ictus.
- Cirugía cardíaca (también puede elevar la CPK-MB).
- Pericarditis y miocarditis (también puede elevar la MB).
- En algunas neoplasias malignas puede elevarse la MB. (MIR 99-00, 98).
2. Troponinas: La troponina T e I son fracciones de la troponina, el complejo proteico que regula la unión de la actina a la miosina en la contracción muscular. Sin embargo, las troponinas cardíacas están codificadas por genes diferentes a las musculares, lo cual hace posible la determinación específica. Actualmente son los marcadores de necrosis cardíaca más sensibles y específicos, por lo que se han convertido en la determinación de referencia para el diagnóstico de daño cardíaco (recordad que son marcadores de daño de cualquier etiología, pudiendo elevarse también en las miocarditis, en la ICC, en el daño ventricular derecho secundario a TEP cardioversión, etc.). Se elevan a las 4-6 horas del IAM, pero permanecen elevadas durante muchos días (7-10 la troponina I y 10-14 la troponina T). Por ello, son también el marcador de referencia para el diagnóstico del IAM evolucionado (MIR 99-00F 50).
3. Mioglobina: La mioglobina se eleva muy precozmente en el infarto, pero carece de especificidad cardíaca. Se eleva a partir de las 2-4 horas y se normaliza en las primeras 24 horas.
Tratamiento de la fase aguda del IAM no complicado
Manejo inicial
El tratamiento de los pacientes con IAM debe ir encaminado a conseguir dos objetivos fundamentales:
- Identificar a los pacientes candidatos de un posible tratamiento de reperfusión. El beneficio es máximo en las primeras horas (en las tres primeras horas), pero existe hasta las 12 horas, por lo que se puede afirmar que cada minuto cuenta en la mejoría del pronóstico del paciente (MIR 05-06, 28).
- Mantener una adecuada y temprana monitorización para evitar las muertes por arritmias ventriculares (la principal causa de muerte extrahospitalaria), con acceso a desfibriladores tanto en los servicios de atención extrahospitalaria como en las salas de urgencias de los hospitales y unidades coronarias.
- Otras medidas iniciales son:
1. Control de las constantes hemodinámicas: tratamiento de la hiper o hipotensión, arritmias, etc. En el tratamiento de la hipertensión inicial tienen un papel muy importante la NTG y los betabloqueantes. Si existe hipotensión en ausencia de congestión pulmonar, se intentará corregir con infusión de líquidos. Los fármacos inotropos se reservarán para la hipotensión refractaria o la asociada a insuficiencia cardíaca. 2. Tratamiento del dolor: NTG, morfina. 3. Antiagregación: Se deben administrar 160-325 mg de AAS. (MIR 95-96F, 28).
Tratamiento de reperfusión en el IAM: Apertura de la arteria y prevención de la reoclusión. Al repermeabilizar la arteria, se consigue que la cantidad de miocardio necrosado sea menor, y esto hace que la disfunción ventricular sea menos importante. El efecto beneficioso de la revascularización se obtiene sobre todo en las primeras 3-6 horas del comienzo del dolor, pero existe beneficio siempre que el paciente continúe con dolor y/o elevación del ST, pues esto significa que hay miocardio que sigue necrosándose, y que por lo tanto todavía se puede salvar.
El retraso mayor en el inicio del tratamiento del infarto ocurre entre el inicio del dolor y la decisión del paciente de acudir al hospital.
Trombolisis
- Trombolisis: reduce el tamaño del IAM, mejora la supervivencia y disminuye las complicaciones: menos incidencia de fallo de bomba y de arritmias.
El mayor beneficio del tratamiento trombolítico se obtiene cuando el paciente lleve menos de 6 horas con dolor. Entre las 6 y 12 horas, también se produce beneficio, pero menos importante. Administrado más allá de 12 horas, desde el comienzo de los síntomas, este tratamiento no parece aportar beneficio.
Los pacientes que más se benefician del tratamiento trombolítico, en comparación con su no administración, son lógicamente los de mayor riesgo como los pacientes con infarto de localización anterior o que presenten bloqueo de rama izquierda de reciente aparición, en aquellos con compromiso hemodinámico y en pacientes con infarto extenso en el electrocardiograma. En cuanto a la edad, aunque la reducción de la mortalidad en términos relativos es superior en pacientes inferiores de 65 años, la reducción absoluta de la mortalidad es similar, independientemente de la edad del paciente.
Tipos de trombolíticos
- Estreptoquinasa (SK): es barata y efectiva, pero es antigénica, y por lo tanto puede dar lugar a reacciones alérgicas.
- rtPA: reduce ligeramente la mortalidad en comparación con la estreptoquinasa.
- Tenecteplase (TNK): es igual de efectivo que el rtPA pero de fácil administración ya que se pauta en un único bolo, tratándose del fibrinolítico más empleado en nuestro medio.
Junto con el TNK o el rtPA es obligado el uso de heparina (no fraccionada o de bajo peso molecular) para prevenir el riesgo de reoclusión de la arteria responsable del infarto. Por el contrario con la SK no se aconseja el uso concomitante de heparina.
- Los efectos secundarios más frecuentes son las hemorragias, siendo el más temido la hemorragia intracraneal. Esta se produce en alrededor del 1% de los pacientes, siendo los ancianos de bajo peso, las mujeres y los pacientes con hipertensión arterial los subgrupos más predispuestos. La estreptoquinasa produce hipotensión arterial en el 4-10%, y reacciones alérgicas en cerca del 2% (MIR 00-01, 47).
ACTP primaria
Consiste en la repermeabilización de la arteria coronaria responsable del infarto que está teniendo lugar, considerándose más eficaz que la fibrinolisis. Su problema es que precisa de una infraestructura adecuada y pocos centros cuentan con su disponibilidad durante las 24 horas del día.
La realización precoz de coronariografía y angioplastia rutinarias tras el tratamiento trombolítico no está indicada. Sí están indicadas si se sospecha que el tratamiento trombolítico no ha sido eficaz (no cede el dolor, no aparecen RIVAS y no se normaliza el ST a los 90 minutos), en cuyo caso puede estar indicada una angioplastia urgente (angioplastia de rescate), o si se produce una nueva reoclusión arterial tras la administración del trombolítico (nueva aparición de dolor con reelevación del ST).
- Suele preferirse fibrinolisis si la presentación es muy temprana (tres horas o menos desde el comienzo de los síntomas) y existe demora para la realización de ACTP primaria. Por el contrario se prefiere ACTP primaria en las contraindicaciones de la fibrinolisis, en los infartos de alto riesgo (localización anterior, KIII, shock cardiogénico, infarto previo) y en la presentación tardía (inicio de los síntomas más de tres horas antes) siempre y cuando se disponga de un laboratorio de hemodinámica experimentado.
Fármacos con eficacia probada en el IAM.
- Antiagregación y anticoagulación.
1. La AAS reduce la tasa de reinfarto y mejora la supervivencia en los pacientes con IAM (24 muertes menos por cada 1000 pacientes tratados). Debe administrarse lo más precozmente posible, incluso ambulatoriamente. Posteriormente se mantiene de por vida. Si el paciente es alérgico a la AAS, se administra clopidogrel. Si se opta por la estrategia de reperfusión con uso de stent, está indicada la doble antiagregación con AAS y clopidogrel durante un año en pacientes que no presenten un alto riesgo de si hemorragia, especialmente si se trata de los stents de nueva generación recubiertos.
Posteriormente se continúa con AAS (MIR 98-99, 20; MIR 97-98F, 92). 2. El clopidogrel es un antiagregante de la familia de las tienopiridinas, cuyo mecanismo de acción se basa en la inhibición de la agregación plaquetaria mediada por ADP. En el contexto del IAM se utiliza en los pacientes con alergia o intolerancia a la AAS y cuando se utilizan stents. La principal ventaja con respecto a la ticlopidina (otro fármaco de la misma familia previamente muy utilizado), es la menor cantidad de efectos adversos. En un reciente ensayo clínico se demostró un aumento de supervivencia aplicando doble antiagregación (aspirina más clopidogrel) en la fase aguda del infarto. 3. Heparinas, su empleo está indicado en las siguientes situaciones:
- Si existe un trombo intraventricular con alto riesgo embolígeno (en este caso, puede estar indicada la anticoagulación durante 3-6 meses).
- Si se sospecha TEP.
- Si hay FA además del IAM.
- Si hay insuficiencia cardíaca severa o IAM anterior extenso (controvertido).
- Si se ha administrado rtPA o TNK como fibrinolítico.
El tiempo de tromboplastina debe encontrarse entre 1,5 y 2 veces el control. 4. Anti Iib-IIIa. Su uso sólo parece justificado en el contexto del IAM en aquellos pacientes en los que se va a realizar intervencionismo. Su principal beneficio radica en la disminución de la necesidad de nuevos procedimientos de revascularización (no se ha demostrado que aumenten la supervivencia).
Betabloqueantes: disminuyen la mortalidad intrahospitalaria, al reducir el tamaño del infarto, así como el riesgo de fibrilación ventricular primaria y de rotura de la pared del ventrículo izquierdo. En la fase aguda del IAM, se pueden administrar siempre que no haya insuficiencia cardíaca (Killip III-IV), o cualquiera de las contraindicaciones de los betabloqueantes. Al contrario que los betabloqueantes, los antagonistas del calcio están contraindicados en la fase aguda del infarto.
IECAs: reducen la mortalidad en el IAM. Este efecto es aditivo al conseguido por los betabloqueantes y la AAS. Su mayor beneficio se concentra en los pacientes de alto riesgo (IAM anterior o con disfunción ventricular severa, ICC). También existe un beneficio, aunque menor, en los pacientes con menor riesgo, por lo que actualmente se recomienda su uso en todos los pacientes, salvo contraindicaciones.
Nitroglicerina: se emplea cuando hay insuficiencia cardíaca, o hipertensión arterial. Está contraindicada (al igual que los diuréticos) si hay IAM del ventrículo derecho, si hay hipotensión arterial, o si el paciente tiene un glaucoma. Puede producir hipotensión arterial y bradicardia, que revierten fácilmente con atropina.
Diuréticos: se utilizan si existe ICC. Sin embargo, su uso debe ser cuidadoso, ya que una disminución marcada de la volemia puede producir o agravar la hipotensión (sobre todo en IAM que afectan al ventrículo derecho, en cuyo caso están contraindicados).
Otras medidas
- Antiarrítmicos: no se recomienda su uso rutinario. (MIR 96-97, 171).
- Magnesio: se recomienda su uso en caso de que se detecte hipomagnesemia o en pacientes con taquicardia ventricular en torsión de puntas (MIR 05-06, 30).
Estratificación del riesgo y tratamiento después de la fase aguda del infarto.
Los factores que se asocian a peor pronóstico a largo plazo tras un infarto son la existencia de isquemia persistente (bien angina postinfarto, o bien una prueba de esfuerzo positiva o incluso isquemia silente), fracción de eyección del ventrículo izquierdo inferior al 40% (determinante más importante de la supervivencia a largo plazo) (MIR 96-97F, 51), signos de insuficiencia cardíaca, arritmias ventriculares, falta de permeabilidad de la arteria del infarto, y anomalías de la conducción cardíaca.
El manejo tras el infarto agudo de miocardio incluye: 1. Ecocardiograma para valorar la función ventricular. Si el paciente tiene datos de mal pronóstico como disfunción ventricular, angor postIAM o arritmias ventriculares secundarias se deberá conocer la anatomía coronaria realizando una coronariografía. Si no existen a priori datos de pronóstico adverso se realizará una prueba de detección de isquemia a los 4-5 días en el IAM no complicado. Si se ha utilizado la angioplastia primaria con revascularización completa como técnica de reperfusión, no suele ser necesaria la realización de ergometría. 2. Control estricto de los factores de riesgo. 3. Fármacos que han demostrado aumentar la supervivencia y que por tanto hay que administrar o justificar el motivo por el que no se emplean.
- Aspirina: debe administrarse siempre como prevención de nuevos episodios isquémicos coronarios. Su dosis habitual son 100 mg diarios. En pacientes con intolerancia gástrica o alergia se deberá utilizar clopidogrel.
- IECAs: reducen la mortalidad tras un IAM. Su efecto beneficioso es especialmente importante en pacientes de alto riesgo (fracción de eyección ventricular izquierda inferior al 40%, antecedentes de infarto previo, localización anterior y ancianos), aunque pueden administrarse también en el resto de los pacientes. Previene el remodelado adverso del ventrículo tras el infarto (MIR 95-96, 187).
- Epleronona: es un antagonista de los receptores de la aldosterona y se emplea en pacientes con FEVI inferior al 40% que tengan diabetes o insuficiencia cardíaca sintomática siempre y cuando la creatinina sérica sea igual o inferior a 2,5 mg y la concentración sérica de potasio igual o inferior a 5 mEq/l.
- Betabloqueantes: existe evidencia abrumadora en cuanto a sus beneficios y están especialmente indicados si hay isquemia residual, disfunción del ventrículo izquierdo o hipertensión arterial (MIR 99-00F, 52; MIR 97-98F, 95; MIR 96-97F, 54).
- Estatinas: el objetivo en prevención secundaria es lograr un colesterol por debajo del normal. Es deseable conseguir unos niveles de colesterol total < 200 mg/dl y de LDL <100mg/dl y en pacientes de alto riesgo un LDL de 70 mg/dl (MIR 96-97, 171).
5. En los pacientes que han sufrido un IAM con disfunción ventricular residual es muy importante la estratificación de riesgo de muerte súbita. Deberían recibir un desfibrilador:
- Prevención primaria:
- Pacientes que presentan disfunción ventricular no achacable a isquemia residual tratable con episodios de taquicardias ventriculares no sostenidas con inducibilidad de TV en el estudio electrofisiológico deben recibir un DAI.
- Si la FEVI está reducida (30% o menos) como mínimo un mes después del infarto es razonable implantar un DAI incluso sin objetivar ninguna arritmia ventricular ya que aumenta la superviviencia. De todas formas está última indicación no se emplea universalmente por el coste económico que supondría.
- Prevención secundaria:
- En pacientes con cardiopatía isquémica y muerte súbita recuperada.
- Taquicardia ventricular sostenida con compromiso hemodinámico.
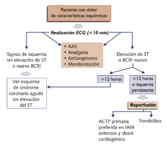
En resumen, podemos sintetizar el manejo de los pacientes con IAM como sigue:
- Identificación precoz de los pacientes con IAM y ubicación en un medio donde se disponga de medidas para el tratamiento de la fibrilación ventricular.
- Uso precoz del tratamiento de reperfusión en todos los pacientes en los que esté indicado.
- Tratamiento con beta-bloqueantes, inhibidores del ECA y antiagregantes (AAS y/o clopidogrel) a todos los pacientes, salvo contraindicaciones.
- Estratificación de riesgo isquémico y arrítmico previo al alta y tratamiento según los resultados de estas pruebas.
- Iniciar prevención secundaria mediante el tratamiento de los factores de riesgo cardiovascular, modificación de hábitos de vida y rehabilitación cardíaca.
Fuentes
- Cardiología y Cirugía Cardiovascular/ Colectivo de autores. T3. La Habana: Editorial Ciencias Médicas; 2006.
- [www.cibercuba.com/foro/salud/que-es-la-cardiopatia-isquemica Ciber Cuba]