Modelo atómico
Modelo atómico.El estudio de la estructura atómica data de 500 años antes de nuestra era, con los trabajos de filósofos como Demócrito, Aristóteles y Epicuro, los cuales valoraban la constitución de las sustancias formadas por partículas más pequeñas denominadas por Demócrito "átomo".
Entre los primeros estudios sobre las sustancias con alto valor científico se destacan los realizados en el siglo XVIII, por los científicos A. L. Lavoisier y el científico ruso M. V. Lomonosov, reconocidos como iniciadores de un nuevo período en el desarrollo histórico de la ciencia química.
Sumario
Evolución histórica del modelo atómico
En el siglo XIX se realiza un aporte muy valioso en este campo, por el inglés John Dalton que culminaron con la formulación de la conocida "Teoría atómica de Dalton".A mediados de este siglo la teoría tiene un gran impulso con los trabajos de investigación del físico inglés Michael Faraday. Faraday demostró con sus experimentos sobre la electrólisis, la naturaleza eléctrica de los átomos y la relación entre los fenómenos eléctricos y los químicos.
El conocimiento sobre la estructura atómica adquiere su máximo desarrollo a partir del surgimiento de la mecánica cuántica, se destacan los científicos Louis de Brooglie, Heinsember y Shodinger, entre los descubrimientos y experimentos de mayor trascendencia se encuentran:
- Las descargas eléctricas a través de tubos de gases enrarecidos: los rayos anódicos y catódicos.
- Los rayos X.
- El descubrimiento de los isótopos.
- El descubrimiento del electrón.
- La radioactividad.
- El descubrimiento del Núcleo Atómico.
- Las reacciones nucleares.
- El descubrimiento de los espectros discontinuos.
La concepción del átomo que se ha tenido a lo largo de la historia ha variado de acuerdo a los descubrimientos realizados en el campo de la física y la química. A continuación se hará una exposición de los modelos atómicos propuestos por los científicos de diferentes épocas. Algunos de ellos son completamente obsoletos para explicar los fenómenos observados actualmente, pero se incluyen a manera de reseña histórica.
Modelo de Dalton
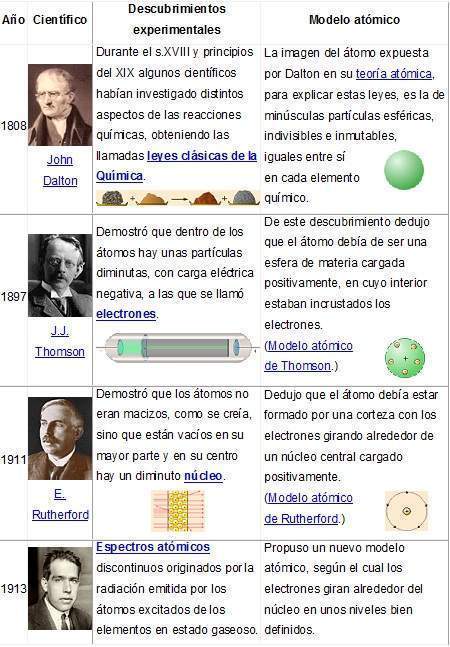
Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton, quien imaginaba a los átomos como diminutas esferas. Este primer modelo atómico postulaba:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
El modelo permitió aclarar por primera vez por que las sustancias químicas reaccionaban en proporciones estequiométrícas fijas y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros. Además el modelo aclaraba que aún existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos. En esencia, el modelo explicaba la mayor parte de la química de fines del siglo XVIII y principios del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple.
Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radioactividad ni la presencia de los electrones (e-) o protones (p+).
Insuficiencias del modelo de Dalton
La hipótesis de John Dalton que afirmaba los elementos en estado gaseoso eran monoatómicos y que los átomos de los elementos para formar átomos de los compuestos, lo que hoy llamamos molécula, se combinaban la menor proporción posible, generó algunas dificultades. Por ejemplo, Dalton pensó que la fórmula del agua era HO. En consecuencia de esto se realizaron cálculos erróneos sobre la masa y peso de algunos compuestos básicos.
En 1805, Gay-Lussac y Von Humboldt mostraron que el agua estaba formada por dos hidrógenos y un oxígeno. En 1811, Amedeo Avogadro concretó la exacta composición del agua, basándose en lo que hoy se conoce como Ley de Avogadro y la evidencia de la existencia de moléculas diatómicas homonucleares. No obstante, estos resultados fueron ignorados en su mayor parte hasta 1860. Esto fue, en parte, por la creencia de que los átomos de un elemento no tenían ninguna afinidad química hacia átomos del mismo elemento. Además, algunos conceptos de la disociación de moléculas no estaban explicados en la Ley de Avogadro.
En 1860, en el Congreso de Karlsruhe sobre masas y pesos atómicos, Cannizzaro revivió las ideas de Avogadro y las usó para realizar una tabla periódica de pesos atómicos, que tenían bastante similitud con los actuales valores. Estos pesos fueron un importante prerrequisito para el descubrimiento de la Tabla periódica de Dmitri Mendeléyev y Lothar Meyer.
Hasta la segunda mitad del siglo XIX no aparecieron evidencias de que los átomos fueran divisibles o estuvieran a su vez constituidos por partes más elementales. Por esa razón el modelo de Dalton no fue cuestionado durante décadas, ya que explicaba adecuadamente los hechos.
Si bien el modelo usualmente nacido para explicar los compuestos químicos y las regularidades estequiométricas, no podía explicar las regularidades periódicas en las propiedades de los elementos químicos tal como aparecieron en la tabla periódica de los elementos de Mendeleiev (esto sólo sería explicado por los modelos que suponían el átomo estaba formado por electrones dispuestos en capas). El modelo de Dalton tampoco podía dar cuenta de las investigaciones realizadas sobre rayos catódicos que sugirieron que los átomos no eran indivisibles sino que contenían partículas más pequeñas cargadas eléctricamente.
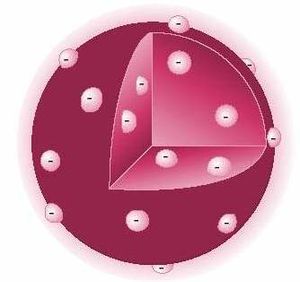
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, este propuso un modelo atómico que tomaba en cuenta la existencia de dicha partícula subatómica. Se determinó además que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model) o uvas en gelatina. Posteriormente Jean Perrin propuso un modelo modificado a partir del de Thomson donde las "pasas" (electrones) se situaban en la parte exterior del "pastel" (la carga positiva).
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas. Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva. En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
Pensaba que los electrones, distribuidos uniformemente alrededor del átomo, en distintas ocasiones, en vez de una sopa de las cargas positivas, se postulaba con una nube de carga positiva, en 1906 Thomson fue premiado con el novel de física por este descubrimiento.
Éxitos del modelo de Thomson
El nuevo modelo atómico usó la amplia evidencia obtenida gracias al estudio de los rayos catódicos a lo largo de la segunda mitad del siglo XIX. Si bien el modelo atómico de Dalton daba debida cuenta de la formación de los procesos químicos, postulando átomos indivisibles, la evidencia adicional suministrada por los rayos catódicos sugería que esos átomos contenían partículas eléctricas de carga negativa. El modelo de Dalton ignoraba la estructura interna, pero el modelo de Thomson aunaba las virtudes del modelo de Dalton y simultáneamente podía explicar los hechos de los rayos catódicos.
Insuficiencias del modelo de Thomson
Si bien el modelo de Thomson explicaba adecuadamente muchos de los hechos observados de la química y los rayos catódicos, hacía predicciones incorrectas sobre la distribución de la carga positiva en el interior de los átomos. Las predicciones del modelo de Thomson resultaban incompatibles con los resultados del experimento de Rutherford, que sugería que la carga positiva estaba concentrada en una pequeña región en el centro del átomo, que es lo que se conoció como núcleo atómico. El modelo siguiente fue el modelo atómico de Rutherford.
Otro hecho que el modelo de Thomson había dejado por explicar era la regularidad de la tabla periódica de Mendeleiev. Los modelos de Bohr, Sommerfeld y Schrödinger finalmente explicarían las regularidades periódicas en las propiedades de los elementos químicos de la tabla, como resultado de una disposición más estructurada de los electrones en el átomo, que ni el modelo de Thomson ni el modelo de Rutherford habían considerado.
Modelo de Rutherford
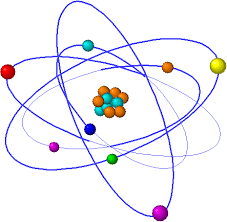
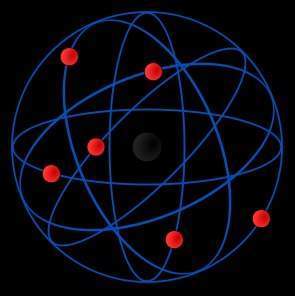
Este modelo fue desarrollado por el físicoErnest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Es un modelo atómico o teoría sobre la estructura interna del átomo. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico.
El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo", muy pequeño, que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.
Predijo además la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de éste.
Incongruencias del modelo atómico de Rutherford
- Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente.
- No explicaba los espectros atómicos.
Éxitos y limitaciones del modelo de Rutherford
La importancia del modelo de Rutherford residió en proponer por primera vez la existencia de un núcleo en el átomo (término que, paradójicamente, no aparece en sus escritos). Lo que Rutherford consideró esencial, para explicar los resultados experimentales, fue "una concentración de carga" en el centro del átomo, ya que sin ella, no podía explicarse que algunas partículas fueran rebotadas en dirección casi opuesta a la incidente. Este fue un paso crucial en la comprensión de la materia, ya que implicaba la existencia de un núcleo atómico donde se concentraba toda la carga positiva y más del 99,9% de la masa. Las estimaciones del núcleo revelaban que el átomo en su mayor parte estaba vacío.
Rutherford propuso que los electrones orbitarían en ese espacio vacío alrededor de un minúsculo núcleo atómico, situado en el centro del átomo. Además se abrían varios problemas nuevos que llevarían al descubrimiento de nuevos hechos y teorías al tratar de explicarlos:
- Por un lado se planteó el problema de cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño, hecho que llevó posteriormente a la postulación y descubrimiento de la fuerza nuclear fuerte, que es una de las cuatro interacciones fundamentales.
- Por otro lado existía otra dificultad proveniente de la electrodinámica clásica que predice que una partícula cargada y acelerada, como sería el caso de los electrones orbitando alrededor del núcleo, produciría radiación electromagnética, perdiendo energía y finalmente cayendo sobre el núcleo. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10 -10 s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo. Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica.
Según Rutherford, las órbitas de los electrones no están muy bien definidas y forman una estructura compleja alrededor del núcleo, dándole un tamaño y forma algo indefinidas. Los resultados de su experimento le permitieron calcular que el radio atómico era diez mil veces mayor que el núcleo mismo, y en consecuencia, que el interior de un átomo está prácticamente vacío.
Modelo de Bohr
El modelo atómico de Bohr o de Bohr-Rutherford es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados.
Fue propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905.
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
- El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en órbitas bien definidas". Las órbitas están cuantizadas (los e- pueden estar solo en ciertas órbitas)
- Cada órbita tiene una energía asociada. La más externa es la de mayor energía.
- Los electrones no radian energía (luz) mientras permanezcan en órbitas estables.
- Los electrones pueden saltar de una a otra órbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada órbita. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz).
El mayor éxito de Bohr fue dar la explicación al espectro de emisión del hidrógeno. Pero solo la luz de este elemento. Proporciona una base para el carácter cuántico de la luz, el fotón es emitido cuando un electrón cae de una órbita a otra, siendo un pulso de energía radiada.
Bohr no pudo explicar la existencia de órbitas estables y para la condición de cuantización.
Bohr encontró que el momento angular del electrón es h/2π por un método que no puede justificar.
Limitaciones del modelo de Bohr
Böhr creó su modelo basándose en el átomo de hidrógeno; pero surgieron complicaciones. En consecuencia, Sommerfeld perfeccionó este modelo considerando que las órbitas podían ser también elípticas.
El modelo atómico de Böhr no explicaba por qué la energía en las órbitas atómicas estaba cuantizada, ni por qué algunas propiedades de los elementos se repetían periódicamente. Es decir, no explicaban bien los espectros de emisión.
Además, se aventuraba a colocar a los electrones con exactitud en unas órbitas fijas.
Modelo de Schrödinger
Después de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en 1924, la cual fue generalizada por Erwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno.
Insuficiencias del modelo de Schrödinger
Si bien el modelo de Schrödinger describe adecuadamente la estructura electrónica de los átomos, resulta incompleto en otros aspectos:
El modelo de Schrödinger en su formulación original no tiene en cuenta el espín de los electrones, esta deficiencia es corregida por el modelo de Schrödinger-Pauli.
El modelo de Schrödinger ignora los efectos relativistas de los electrones rápidos, esta deficiencia es corregida por la ecuación de Dirac que además incorpora la descripción del espín electrónico.
El modelo de Schrödinger si bien predice razonablemente bien los niveles energéticos, por sí mismo no explica por qué un electrón en un estado cuántico excitado decae hacia un nivel inferior si existe alguno libre. Esto fue explicado por primera vez por la electrodinámica cuántica y es un efecto de la energía del punto cero del vacío cuántico.
Cuando se considera un átomo de hidrógeno los dos dos primeros aspectos pueden corregirse añadiendo términos correctivos al hamiltoniano atómico.
Modelos posteriores
Tras el establecimiento de la ecuación de Dirac, la teoría cuántica evolucionó hasta convertirse propiamente en una teoría cuántica de campos. Los modelos surgidos a partir de los años 1960 y 1970 permitieron construir teorías de las interacciones de los nucleones. La vieja teoría atómica quedó confinada a la explicación de la estructura electrónica que sigue siendo explicada de manera adecuada mediante el modelo de Dirac complementado con correcciones surgidas de la electrodinámica cuántica. Debido a la complicación de las interacciones fuertes sólo existen modelos aproximados de la estructura del núcleo atómico. Entre los modelos que tratan de dar cuenta de la estructura del núcleo atómico están el modelo de la gota líquida y el modelo de capas.
Posteriormente, a partir de los años 1960 y 1970, aparecieron evidencias experimentales y modelos teóricos que sugerían que los propios nucleones (neutrones, protones) y mesones (piones) que constituyen el núcleo atómico estarían formados por constituyentes fermiónicos más elementales denominados quarks. La interacción fuerte entre quarks entraña problemas matemáticos complicados, algunos aún no resueltos de manera exacta. En cualquier caso lo que se conoce hoy en día deja claro que la estructura del núcleo atómico y de las propias partículas que forman el núcleo son mucho más complicadas que la estructura electrónica de los átomos. Dado que las propiedades químicas dependen exclusivamente de las propiedades de la estructura electrónica, se considera que las teorías actuales explican satisfactoriamente las propiedades químicas de la materia, cuyo estudio fue el origen del estudio de la estructura atómica.
Bibliografía
- Blanco Prieto, J. (2001). Química Inorgánica 1, segunda edición. La Habana: Pueblo y Educación.
- Cartmell; Fowles. (1978). Valencia y estructura molécular . Madrid: Reverté, S.A.
- Drakin., K. M. (1974). Estructura de las sustancias. Moscú: Mir.
- Química Inorgánica, tomos I, A. Ponjuán, J. Novoa y J. Blanco. Editorial Pueblo y Educación. La Habana.1979.