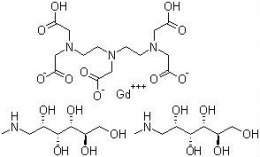
Gadopentetato de meglumina (Gadolinio)
| ||||||||||
Gadopentetato de meglumina (Gadolinio). Es un medio de contraste paramagnético con el objetivo de emplearse en resonancia magnética. El efecto intensificador de contraste es debido a la sal di-N-metilglucamínica del ácido gadopentético (Gd-DTPA; gadopentetato), complejo de gadolinio del ácido pentético (dietilentriaminopentaacético = DTPA). Mediante una secuencia adecuada (ejemplo, técnica espín-eco potenciada en T1) en la resonancia magnética de protones, el acortamiento del tiempo de relajación espínred de los núcleos atómicos excitados, inducido por el gadolinio, da lugar a un aumento de la intensidad de señal y, por tanto, a un incremento del contraste de la imagen de algunos tejidos. El gadopentetato es un compuesto fuertemente paramagnético que reduce de manera notable el tiempo de relajación, incluso a bajas concentraciones. La efectividad paramagnética, conocida como relaxividad, determinada por la influencia sobre el tiempo de relajación espínred de los protones en agua, es aproximadamente 3,8 L/mmol/seg, a pH 7 y a temperatura de 39 ºC, y depende solo débilmente de la intensidad del campo magnético. El ion paramagnético gadolinio forma con DTPA un complejo extraordinariamente estable tanto in vivo como in vitro (log k = 22-23). El gadopentetato de dimeglumina es un compuesto extremadamente hidrofílico, muy soluble en agua, cuyo coeficiente de reparto entre n-butanol y tampón a pH = 7,6 es más o menos de 0,0001. La sustancia no se une a proteínas en cantidad apreciable ni muestra interacción inhibitoria con enzimas como las ATPasas de Na+ y K+ del miocardio. Tampoco activa el sistema de complemento y, por tanto, tiene muy escaso riesgo para provocar una reacción anafilactoide. No se ha observado deterioro de la función renal. In vitro, la morfología eritrocitaria solo se afectó, en grado ligero, tras incubación durante tiempo prolongado con altas concentraciones de gadopentetato. Tras la administración IV en humanos, el proceso reversible puede causar una leve hemólisis intravascular, lo que explicaría el ligero incremento de bilirrubina y hierro séricos que se ha observado, ocasionalmente, en las primeras horas posadministración.
Sumario
- 1 Denominación común internacional
- 2 Composición
- 3 Farmacocinética
- 4 Indicaciones
- 5 Contraindicaciones
- 6 Precauciones
- 7 Reacciones adversas
- 8 Interacciones
- 9 Posología
- 10 Tratamiento de la sobredosis aguda y efectos adversos graves
- 11 Información básica al paciente
- 12 Nivel de distribución
- 13 Regulación a la prescripción
- 14 Clasificación VEN
- 15 Laboratorio productor
- 16 Código ATC
- 17 Fuente
Denominación común internacional
Gadopentetato de dimeglumina.
Composición
Cada 1 mL de solución acuosa contiene 469 mg (0,5 mmol) de gadopentetato de dimeglumina.
Farmacocinética
El gadopentetato se comporta en el organismo como otros compuestos altamente hidrófilos, biológicamente inertes (ejemplo, manitol o inulina). Después de la administración IV, el compuesto difunde rápido en el espacio extracelular y se elimina inalterado en la orina, por filtración glomerular. La porción eliminada de forma extrarrenal es extremadamente pequeña. Siete días después de la administración IV de gadopentetato marcado de manera radioactiva, las concentraciones relativamente más altas se encontraron en los riñones, en forma de Gd-DTPA inalterado. El compuesto no atraviesa la barrera hematoencefálica intacta ni la hematoseminal. La escasa cantidad que atraviesa la barrera placentaria es rápidamente eliminada por el feto. Los parámetros farmacocinéticos observados en el hombre fueron independientes de la dosis. Hasta 0,25 mmoL de gadopentetato/kg de peso corporal (= 0,5 mL del producto/kg p.c.), los niveles plasmáticos, después de una primera fase de distribución de pocos minutos de duración, declinaron con una vida media aproximadamente de 90 min, idéntica a la velocidad de eliminación renal. Una media de 83 % de la dosis se elimina por vía renal a las 6 h, y aproximadamente 91 % de la dosis se elimina por la orina dentro de las primeras 24 h. Al quinto día después de la inyección, la porción de dosis eliminada por heces fue menor de 1 %. No se detectó ruptura ni degradación metabólica del complejo. El gadopentetato se elimina casi de manera completa por vía renal, aún en presencia de función renal alterada (aclaramiento de creatinina mayor que 20 mL/min); la vida media en plasma aumenta en relación con el grado de insuficiencia renal, pero no se observa incremento de la eliminación extrarrenal. Puesto que la vida media plasmática en el suero se prolonga (hasta 30 h) en presencia de la función renal severamente restringida (aclaramiento de creatinina menor que 20 mL/min), el gadopentetato debería eliminarse mediante hemodiálisis extracorpórea. Se ha observado un incremento de la vida media de eliminación en neonatos debido a la inmadurez de la función renal.
Indicaciones
- Es para uso diagnóstico por resonancia magnética (RM) craneal y espinal para la detección de tumores y el ulterior diagnóstico diferencial en los casos de sospecha de meningiomas, neurinomas (del acústico), tumores invasivos (ejemplo, gliomas) y metástasis; para la demostración de la existencia de tumores pequeños y/o isointensos; en la sospecha de recurrencia después de cirugía o radioterapia; para la representación diferencial de neoplasias raras, como hemangioblastomas, ependimomas y adenomas pequeños de la hipófisis; para la mejor evaluación de la extensión de tumores que no sean de origen cerebral.
- De manera adicional en la resonancia magnética de la médula espinal: diferenciación de tumores intramedulares y extramedulares; demostración de zonas tumorales sólidas en siringomielia establecida; determinación de la extensión tumoral intramedular.
- Resonania magnética en otras regiones corporales: incluyen la región otorrinofaríngea, cavidad torácica y abdominal, mamas, pelvis y el sistema músculo-esquelético.
- En particular, suministra información diagnóstica para: demostración o exclusión de tumores, inflamaciones y lesiones vasculares, la determinación de su extensión, demarcación y la diferenciación de su estructura interna; evaluación del flujo sanguíneo en tejidos normales y patológicos; diferenciación entre tumor y tejido cicatricial después de la terapia; diagnóstico del prolapso recurrente del disco intervertebral después de cirugía; evaluación semicuantitativa de la función renal en combinación con el diagnóstico anatómico del órgano.
Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes. Pacientes con insuficiencia renal grave (tasa TFG menor que 30 mL/min/1,73 m2).
Precauciones
- E y LM: datos no disponibles.
- Niños: neonatos y niños hasta 1 año de edad, solo debería usarse tras una evaluación cuidadosa debido a la inmadurez de su función renal.
- DR: precaución en pacientes con insuficiencia renal moderada (TFG 30-59 mL/min/1,73 m2).
- Usar previa evaluación de la relación beneficio/riesgo en pacientes con insuficiencia renal aguda de cualquier intensidad o en el período preoperatorio de un trasplante de hígado. Ajustar dosis, no emplear mayores que 0,1 mmoL/kg de peso corporal (= 0,2 mL/kg de peso corporal).
- Se debe asegurar un período suficiente para la eliminación del agente de contraste.
- Adulto mayor: evaluar posible disfunción renal a partir de su historia clínica o mediante pruebas de laboratorio. Dosificación igual que en adultos.
- Usar con cautela en pacientes con antecedentes a reacciones de hipersensibilidad previa a los medios de contrastes, asma bronquial y otros trastornos alérgicos. Antecedentes de trastornos convulsivos y lesiones intracraneales.
Reacciones adversas
Son de naturaleza de leve a moderada y transitorias.
Frecuentes
Náusea, vómito, cefalea, mareos y reacciones en el lugar de inyección (ejemplo, dolor, enfriamento, calor).
Ocasionales
Disgeusia.
Raras
Convulsiones, parestesia, sensación de ardor, temblor, conjuntivitis, taquicardia, arritmia, tromboflebitis, rubores, vasodilatación; disnea, irritación de la garganta, estrechamiento de la garganta, dolor faringolaríngeo, molestias de la faringe, tos, estornudos, sibilancias; dolor abdominal, molestias estomacales, diarrea, odontalgia, sequedad de la boca, dolor en los tejidos blandos bucales y parestesia. Urticaria, prurito, erupción, eritema, dolor en las extremidades, edema facial, dolor del tórax, pirexia, edema periférico, malestar general, fatiga, sed y astenia.
Interacciones
No se conocen interacciones con otros medicamentos.
Posología
- Para resonancia magnética craneal y espinal, adulto y niños: la administración de 0,2 mL (0,1 mmoL)/kg de peso corporal es suficiente.
- Ante sospecha clínica de la existencia de lesión, suele incrementarse el valor diagnóstico de la exploración, volviendo a administrar otra inyección de la misma dosis original en el intervalo de 30 min y repitiendo a continuación la resonancia magnética.
- Resonancias magnéticas en otras regiones corporales: administrar 0,2 mL (0,1 mmoL)/kg de peso corporal. En casos especiales, ejemplo, en lesiones con escasa vascularización y/o poco espacio extracelular, puede ser necesario administrar 0,4 mL (0,2 mmoL)/kg de peso corporal para obtener un contraste adecuado.
Tratamiento de la sobredosis aguda y efectos adversos graves
Puede ser eliminado del organismo mediante hemodiálisis extracorpórea.
Información básica al paciente
Nada a señalar.
Nivel de distribución
Uso exclusivo de hospitales
Regulación a la prescripción
No posee.
Clasificación VEN
Medicamento especial
Laboratorio productor
Internacional
Código ATC
V08CA01