|
|
| (No se muestran 43 ediciones intermedias de 15 usuarios) |
| Línea 1: |
Línea 1: |
| − | En [[biología]], se denomina '''cromosoma''' (del [[Griego antiguo|griego]] χρώμα, -τος ''chroma'', color y σώμα, -τος ''soma'', cuerpo o elemento) a cada uno de los pequeños cuerpos en forma de bastoncillos en que se organiza la [[cromatina]] del [[núcleo celular]] durante las divisiones celulares ([[mitosis]] y [[meiosis]]). La cromatina es un material microscópico que lleva la información genética de los organismos eucariotas y está constituida por [[ADN]] asociado a [[proteína]]s especiales llamadas [[histona]]s. Este material se encuentra en el núcleo de las [[célula]]s [[eucariota]]s y se visualiza como una maraña de hilos delgados. Cuando el núcleo celular comienza el proceso de división ([[cariocinesis]]), esa maraña de hilos inicia un fenómeno de condensación progresivo que finaliza en la formación de entidades discretas e independientes: los cromosomas. Por lo tanto, cromatina y cromosoma son dos aspectos morfológicamente distintos de una misma entidad celular.<ref name="Piqueras">Piqueras, J.F., Fernández Peralta, A.M., Hernández, J.S., González Aguilera, J.J. 2002. ''Genética''. Ariel Ciencia, España, 474 pp. ISBN: 84-344-8056-5</ref>
| + | {{Definición |
| | + | |nombre=Cromosoma |
| | + | |imagen=Cromosoma.gif |
| | + | |tamaño= |
| | + | |concepto= |
| | + | }} |
| | | | |
| − | Cuando se examinan con detalle durante la mitosis, se observa que los cromosomas presentan una forma y un tamaño característicos. Cada cromosoma tiene una región condensada, o constreñida, llamada [[centrómero]], que confiere la apariencia general de cada cromosoma y que permite clasificarlos según la posición del centrómero a lo largo del cromosoma. Otra observación que se puede realizar es que el número de cromosomas de los individuos de la misma especie es constante. Esta cantidad de cromosomas se denomina número [[diploide]] y se simboliza como ''2n''. Cuando se examina la longitud de tales cromosomas y la situación del centrómero surge el segundo rasgo general: para cada cromosoma con una longitud y una posición del centrómero determinada existe otro cromosoma con rasgos idénticos, o sea, casi todos los cromosomas se encuentran formando parejas. Los miembros de cada par se denominan [[cromosoma homólogo|cromosomas homólogos]].
| |
| | | | |
| − | Una excepción importante en el concepto de parejas de cromosomas homólogos es que en muchas especies los miembros de una pareja, los cromosomas que determinan el sexo o [[cromosomas sexuales]], no tienen usualmente el mismo tamaño, igual situación del centrómero, la misma proporción entre los brazos o, incluso, los mismos ''loci''.<ref name="Piqueras" /><ref name = "UNCOR" />
| |
| | | | |
| − | == Historia y definiciones ==
| + | '''Cromosomas'''. Los cromosomas son los portadores de la mayor parte del material genético y condicionan la organización de la vida y las características hereditarias de cada especie. Los experimentos de Mendel pusieron de manifiesto que muchos de los caracteres del guisante dependen de dos factores, después llamados [[Gen|genes]], de los que cada individuo recibe una copia procedente del padre y otra procedente de la madre. |
| − | Desde un punto de vista etimológico, la palabra ''cromosoma'' procede del [[griego]] y significa "cuerpo que se tiñe"; mientras que la palabra [[cromatina]] significa "sustancia que se tiñe".
| |
| − | Los cromosomas fueron observados en células de plantas por el botánico suizo [[Karl Wilhelm von Nägeli]] en 1842 e, independientemente, por el científico belga [[Edouard Van Beneden]] en lombrices del género ''[[Ascaris]]''.<ref name="nageli">Nägeli, Carl, "Memoir on the nuclei, formation, and growth of vegetable cells (A. Henfrey, trans.), in C. and J. Adlard, eds, Reports and Papers on Botany. London: The Ray Society, 1846.</ref><ref name="sc"> Daintith, John, et al., (eds), Biographical Encyclopedia of Scientists, second edition. Bristol, UK: Institute of Physics Publishing, 1994.</ref> | |
| | | | |
| − | El uso de drogas basofílicas (p.ej. las anilinas) como técnica citológica para observar el material nuclear fue fundamental para los descubrimientos posteriores. Así, el citólogo alemán [[Walther Flemming]] en 1882 definió inicialmente la cromatina como "la sustancia que constituye los [[núcleo celular|núcleos]] interfásicos y que muestra determinadas propiedades de tinción".<ref name="Flemming"> Flemming, W. 1882. ''Zell-substanz, Kern und Zelltheilung '' ("Citoplasma, núcelo y división celular").</ref>
| + | == Introducción == |
| − | Por tanto, las definiciones iniciales de cromosoma y cromatina son puramente citológicas. La definición biológica sólo se alcanzó a principios del [[siglo XX]], con el redescubrimiento de las [[Leyes de Mendel]]: tanto la cromatina como el cromosoma constituyen el material genético organizado. Para ello, fueron fundamentales los trabajos del holandés [[Hugo de Vries]] (1848-1935), del alemán [[Carl Correns]] (1894-1933) y del austríaco [[Erich von Tschermak-Seysenegg]] (1871-1962), cuyos grupos de investigación redescubrieron independientemente las leyes de Mendel y asociaron los factores genéticos o genes a los cromosomas. Un breve resumen de los acontecimientos asociados a la historia del concepto de cromosoma se provee a continuación.<ref name=Olins2003>
| |
| − | [[http://academic.bowdoin.edu/faculty/A/aolins/dissemination/Nature_rev.pdf]]
| |
| − | </ref>
| |
| | | | |
| − | El primer investigador que aisló [[ADN]] fue el suizo [[Friedrich Miescher]], entre 1868 y 1869, cuando realizaba sus estudios postdoctorales en el laboratorio de [[Ernst Felix Hoppe-Seyler]] (uno de los fundadores de la [[bioquímica]], la [[fisiología]] y la [[biología molecular]]) en [[Tübingen]]. Miescher estaba analizando la composición química del [[pus]] de los vendajes usados del hospital, para lo cual aisló núcleos y comprobó que estaban formados por una única sustancia química muy homogénea, no proteica, a la que denominó ''nucleína''. Sin embargo, fue [[Richard Altmann]] en 1889 quien acuñó el término [[ácido nucleico]], cuando se demostró que la nucleína tenía propiedades ácidas. En 1881, [[E. Zacharias]] demostró que los cromosomas estaban químicamente formados por ''nucleína'', estableciendo la primera asociación entre los datos citológicos y bioquímicos.
| + | Cuando el núcleo celular comienza el proceso de división (cariocinesis), esa maraña de hilos inicia un fenómeno de condensación progresivo que finaliza en la formación de entidades discretas e independientes: los cromosomas. Por lo tanto, cromatina y cromosoma son dos aspectos morfológicamente distintos de una misma entidad celular.<ref name="Piqueras">Piqueras, J.F., Fernández Peralta, A.M., Hernández, J.S., González Aguilera, J.J. 2002. ''Genética''. Ariel Ciencia, [[España]], 474 pp. ISBN: 84-344-8056-5</ref> |
| | | | |
| − | Las primeras observaciones de la división celular (la [[mitosis]], durante la cual la célula madre reparte sus cromosomas entre las dos células hijas), se realizaron entre 1879 y 1882 por Walther Flemming y [[Robert Feulgen]], de forma independiente, gracias al desarrollo de nuevas técnicas de tinción. La asociación entre [[herencia]] y los cromosomas se realiza poco después (1889) por [[August Weismann]], de manera teórica, casi intuitiva. Pero los primeros datos experimentales que permitieron a [[Walter Sutton]]<ref name=Crow2002>100 Years Ago: Walter Sutton and the Chromosome Theory of Heredity , Genetics,| volume 160,pages = 1–4,[[http://www.genetics.org/cgi/content/full/160/1/1]]
| + | Cuando se examinan con detalle durante la mitosis, se observa que los cromosomas presentan una forma y un tamaño característicos. Cada cromosoma tiene una región condensada, o constreñida, llamada centrómero, que confiere la apariencia general de cada cromosoma y que permite clasificarlos según la posición del centrómero a lo largo del cromosoma. Otra observación que se puede realizar es que el número de cromosomas de los individuos de la misma especie es constante. |
| − | </ref> y [[Theodor Boveri]]<ref name=Satzinger2008>Satzinger , Helga,2008, Theodor and Marcella Boveri: chromosomes and cytoplasm in heredity and development, Nature Reviews Genetics,volume 9,[[ http://www.ncbi.nlm.nih.gov/pubmed/18268510]]</ref> proponer que los "factores" de [[Mendel]] eran unidades físicas que se localizan en los cromosomas (lo que se denomina a menudo la [[teoría cromosómica de Sutton y Boveri]]) datan de 1902. Estas ideas permanecieron controvertidas hasta que [[Thomas Hunt Morgan]] realizó los experimentos que hoy se consideran clásicos sobre los rasgos genéticos ligados al sexo, publicados en 1910, lo que le valió el [[Premio Nobel]] en 1933.<ref name="Morgan">Morgan, Thomas Hunt, "Chromosomes and Heredity," The American Naturalist, 44(524):449-496, 1910.</ref>
| |
| | | | |
| − | La demostración de que los genes están en los cromosomas se realizó por [[Calvin Bridges]] y [[Nettie Stevens]] en 1912 y fue [[Alfred Henry Sturtevant]] quien probó que los genes se hallan dispuestos linealmente a lo largo del cromosoma, elaborando el primer [[mapa genético]] de un organismo, ''[[Drosophila melanogaster]]''. Las bases fundamentales de la herencia quedaron definitivamente establecidas en 1915, cuando apareció el libro "''El mecanismo de la herencia mendeliana''" escrito por Thomas H. Morgan, Alfred Strurtevant, Hermann Muller y Calvin Bridges.<ref name="Gonzalo Claros">Gonzalo Claros, M. [http://www.encuentros.uma.es/encuentros86/histbioq5.htm Historia de la Biologìa (V): La naturaleza química del DNA (hasta el primer tercio del siglo XX)]. Edición para Internet de la revista ''Encuentros en la Biología'', editada en la Facultad de Ciencias de la Universidad de Málaga. ISSN 1134-8496</ref> En 1919 [[Phoebus Levene]] identificó que un nucleótido está formado por una [[base nitrogenada|base]], un [[azúcar]] y un [[fosfato]],<ref> Levene P, The structure of yeast nucleic acid , http://www.jbc.org/cgi/reprint/40/2/415 , J Biol Chem </ref> iniciando así el análisis molecular del ADN, que llevaría a la comprensión de los mecanismos moleculares de la herencia (véase también [[ADN#Historia|Historia del ADN]]). | + | Más o menos en la época en la que Mendel llevaba a cabo sus experimentos, se consiguió ver los cromosomas al microscopio mediante tinciones especiales, descubriéndose una serie de propiedades: |
| | + | |
| | + | *Todos los individuos de una misma especie tienen el mismo número de cromosomas |
| | + | *Los cromosomas se duplican durante la división celular y, una vez completada, recuperan el estado original |
| | + | *Los cromosomas de una célula difieren en tamaño y forma, y de cada tipo se encuentran dos ejemplares, de modo que el número de cromosomas es de 2N (esta propiedad se denomina diploidía) |
| | + | *Durante la formación de células sexuales (meiosis) el número de cromosomas baja a N. La fertilización del óvulo por el espermatozoide, restaura el número de cromosomas a 2N, de los cuales N proceden del padre y N de la madre |
| | + | *Además de los cromosomas usuales que forman parejas, existen los cromosomas X e Y que condicionan el sexo. El cromosoma X está presente en dos copias en las hembras, mientras que los varones tienen un cromosoma X y un cromosoma Y. La asignación del sexo a un solo par de cromosomas explica la proporción aproximadamente igual de varones y hembras. |
| | + | *Los cromosomas se observan mejor al microscopio durante la metafase, cuando el DNA se ha duplicado y la cromatina está muy condensada, formando las cromátidas (las dos hebras de DNA todavía unidas por un solo centrómero). A partir de las fotografías obtenidas en esta fase, se crea el cariotipo, agrupando los cromosomas por parejas |
| | + | |
| | + | == En los humanos == |
| | + | <p>En la especie humana, el número de cromosomas es de 24 pares. Los 22 primeros son parejas de los cromosomas 1, 2,.. , y 22 (se denominan autosomas) mientras que la pareja 23 es la XX y la 24 la XY para los varones o las XX para las hembras. Los cromosomas difieren en cuanto a forma y tamaño dependiendo del número de pares de bases que contengan. Los cromosomas X e Y reciben el nombre de cromosomas sexuales o gonosomas. En el ratón existen 20 pares de cromosomas y en la mosca drosophiila melanogaster tan solo 4 pares.<br /> |
| | + | </p><p>Durante la metafase, las dos hebras del DNA ya duplicado se encuentran unidas por el centrómero y el cinetocoro. El centrómero esta constituído por DNA, mientras que el cinetocoro es una proteína. Según la posición del centrómero, los cromosonas reciben el nombre de metacéntrico, submetacéntrico, acrocéntrico o telocéntrico. En el cariotipo humano los pares de cromosomas 13, 14, 15, 21, 22 son acrocéntricos y el cromosoma Y es sub-telocéntrico. <br />El centrómero divide el cromosoma en dos brazos: un brazo corto (brazo q) y un brazo largo (brazo p). Por convención, en los diagramas, el brazo q se coloca en la parte superior. |
| | + | </p><p>Algunas técnicas de tinción hacen que los cromosomas aparezcan con bandas oscuras y claras que se alternan en cada uno de los brazos siguiendo un patrón específico y repetible para cada cromosoma. Estas bandas dependen de la situación dinámica del cromosoma, de manera que los cromosomas en profase tienen muchas más bandas que los que se encuentran en metafase.<br />La numeración de estas bandas sigue una convención aceptada por los geneticistas y comienza para cada brazo a partir del centrómero. Las últimas bandas reciben el sufijo ter (21ter). De esta manera, la posición de cada uno de los genes puede ser definida. En los últimos años, los geneticistas están terminando de mapear todos los cromosomas en el llamado proyecto genoma humano. |
| | + | </p> |
| | + | |
| | + | == Anormalidades == |
| | + | |
| | + | Los cromosomas pueden tener anormalidades constitucionales o adquiridas. |
| | + | |
| | + | Anormalidades constitucionales: la misma anormalidad cromosómica se encuentra en las células de todos los tejidos. El error cromosómico puede provenir de uno de los gametos antes de la fertilización, o puede ocurrir en el cigoto fertilizado. Si algunos de los genes no están presentes por duplicado sino que existen 1 copia o 3 copias (por ejemplo en la trisomía 21 o síndrome de Dow), el sujeto experimentará dismorfias, malformaciones viscerales y/o retraso mental y psicomotor. |
| | + | |
| | + | *Las anormalidades adquiridas se refieren a una anormalidad cromosómica que aparece en las células de un sólo tejido, como ocurre en el cáncer. |
| | + | |
| | + | *Las anormalidades cromosómicas pueden ser homogéneas o en mosaico. |
| | + | |
| | + | *Las anormalidades homogéneas con aquellas en las que todas las células tienen la misma anormalidad (por ejemplo la trisomía 21 en el [[Síndrome de Down]]), o cuando una anormalidad adquirida se extiende a todas las células de un mismo tejido (por ejemplo las células de la médula ósea en la leucemia mieloide crónica muestran todas ellas una translocación t(9,22). |
| | + | |
| | + | Se definen como anormalidades mosaico, aquellas en las todas las células muestran la misma anormalidad sino que pueden ser normales o llevar otra anormalidad. Esta situación es relativamente frecuente en la leucemia linfoblástica en la que pueden coexitir clones normales con células con una o más alteraciones [por ejemplo, 46,XY/46, XY, t(4;11)/46, XY, t(4;11), i(7q)]<br>También, se clasifican las anormalidades cromosómicas como númericas o estructurales. |
| | + | |
| | + | *Las anormalidades numéricas son aquellas en las que hay un exceso o un defecto de cromosomas (por ejemplo, la trisomía 21). |
| | + | |
| | + | *Las anormalidades estructurales son aquellas en las que las alteraciones se encuentran dentro de los mismos cromosomas. Puede ser anormalidades compensadas cuando no hay pérdida ni ganancia de material genético o descompensadas cuando existe deleción o duplicación de algún segmento cromosómico.<br> |
| | + | |
| | + | ==Formación== |
| | + | Un cromosoma está formado por dos cromátidas, que son cadenas iguales de ADN, es decir, con los mismos genes y los mismos alelos. |
| | + | Los cromosomas se clasifican según la longitud relativa de sus brazos, es decir, según la posición del centrómero, en: |
| | + | *Metacéntricos: cuando los dos brazos son aproximadamente iguales y el centrómero está en el centro. |
| | + | *Submetacéntricos: el centrómero está ligeramente desplazado hacia un lado dando dos brazos algo desiguales |
| | + | *Telocéntricos: cuando el centrómero está más cerca de un extremo, dando dos brazos muy desiguales |
| | + | *Acrocéntricos: el centrómero está en un extremo, por lo que en realidad sólo existe un brazo. |
| | + | |
| | + | ==Herencia de las enfermedades== |
| | + | Si el gen de una enfermedad esta en el [[Cromosoma X|cromosoma X]] una hembra que tenga uno de estos cromosomas con el alelo normal y el otro con el alelo que produce la enfermedad, no padecerá esta. El alelo normal es dominante y enmascarará al que provoca la anomalía, que es recesivo. La hembra no enferma, pero puede transmitir la enfermedad. Por ello se denomina hembra portadora. |
| | + | El caso del macho es muy distinto. Si recibe un cromosoma X, con el alelo que provoca la enfermedad, irremediablemente la padecerá, ya que no tiene otro cromosoma X en el que pueda estar el alelo dominante. |
| | + | |
| | + | == Cronología de descubrimientos == |
| | + | |
| | + | *[[1841]], los cromosomas fueron descubiertos por [[Karl Wilhelm von Nägeli]]. |
| | + | *[[1869]], [[Friedrich Miescher]] descubre el ADN. |
| | + | *[[1889]], [[Wilhelm von Waldeyer]] les dio el nombre de cromosoma que significa ''cuerpo coloreado'' en idioma griego. |
| | + | *[[1910]], [[Thomas Hunt Morgan]] describió que son los portadores de los [[Gen]]es. |
| | + | *[[1943]], [[Oswald Theodore Avery|Oswald Avery]], C. McLeod y M. McCarty descubren que el ADN es el material hereditario. |
| | + | *[[1953]], [[James Dewey Watson]] y [[Francis Harry Compton Crick]] descubren la estructura del ADN. |
| | + | *[[1966]], [[Severo Ochoa]] completa el código genético. |
| | + | *[[1972]], D. Jackson, R. Symons, P. Berg: [[Molécula]] artificial. |
| | + | *[[1973]], J. Boyer, S. Cohen: [[Clonación]] de bacterias. |
| | + | *[[1977]], [[Frederick Sanger]]: secuenciación del ADN. |
| | + | *[[1978]], producción de proteína humana en bacterias. |
| | + | *[[1981]], se hace el primer diagnóstico prenatal. |
| | + | *[[1982]], se crean los primeros organismos [[Transgénico]]s. |
| | + | *[[1983]], secuenciación de los primeros genomas enteros. |
| | + | *[[2001]], secuenciación del [[Genoma humano]]. |
| | + | |
| | + | == Las histonas == |
| | + | |
| | + | Las histonas son proteínas básicas, ricas en residuos de [[Lisina]] y [[Arginina]], que muestran una elevada conservación evolutiva y que interaccionan con el ADN formando una subunidad que se repite a lo largo de la cromatina denominada nucleosoma. |
| | + | |
| | + | Los principales tipos de histonas que se han aislado en los núcleos interfásicos en diferentes especies eucariontes son: H1, H2A, H2B, H3 y H4. Además de estas histonas, también existen otras que son específicas de tejido como la histona H5 muy rica en lisina (25 moles%) específica de eritrocitos nucleados de vertebrados no mamíferos, y las histonas del endosperma.<ref name="Kornberg1999">Kornberg ,Twenty-Five Years of the Nucleosome, Fundamental Particle of the Eukaryote Chromosome, http://www.rpgroup.caltech.edu/courses/aph161/Handouts/Kornberg1999.pdf</ref> Asimismo, la cromatina centromérica se caracteriza por la presencia de una isoforma específica de la histona H3, denominada CENP-A en vertebrados. |
| | + | |
| | + | Una de las características más destacables es su elevado conservadurismo evolutivo, sobre todo de las histonas H3 y H4. La histona H4 de [[Guisante]] y de timo de ternera se diferencian solamente en dos aminoácidos. Este dato indica que las interacciones entre el ADN y las histonas para formar la cromatina deben ser muy semejantes en todos los organismos eucariontes. |
| | + | |
| | + | Los [[Gen]]es que codifican las histonas se encuentran agrupados en nichos (o ''clusters'') que se repiten decenas o centenas de veces. Cada ''cluster'' o grupo contiene el siguiente orden de genes que codifican histonas: H1-H2A-H3-H2B-H4. Estos genes son ricos en pares G-C, ya que codifican proteínas con un elevado contenido en [[Lisina]] y [[Arginina]], pero están separados por secuencias espaciadoras ricas en pares A-T.<ref name="FCA" /><ref name="Isenberg1979"> Isenberg, Annual Reviews in Biochemistry</ref><ref name="Kornberg1999" /><ref name="Grunstein1990">Grunstein ,Histone Function in Transcription, Annual Reviews in Cell BiologyfckLR</ref><ref name="Kedes1979">Histone Genes and Histone Messengers,Annual Reviews in Biochemistry,volume 48,pages = 837–870fckLR </ref> |
| | + | |
| | + | == Proteínas cromosómicas no histónicas: el armazón proteico == |
| | + | |
| | + | Las proteínas cromosómicas no histónicas son proteínas diferentes de las histonas que se extraen de la cromatina de los núcleos con ClNa 0.35M (solución salina), tienen un alto contenido en [[Aminoácido]]s básicos (25% o más), alto contenido en aminoácidos ácidos (20-30%), una elevada proporción de prolina (7%), bajo contenido en aminoácidos hidrofóbicos y una alta movilidad electroforética. |
| | + | |
| | + | Las proteínas cromosómicas no histónicas que se extraen de la cromatina de los núcleos varían mucho dependiendo de la técnica de aislamiento empleada. Un grupo de estas proteínas cromosómicas no histónicas presentan alta movilidad electrofóretica y se denominan abreviadamente HMG (grupo de alta movilidad). |
| | + | |
| | + | == Modelos alternativos de la estructura cromosómica == |
| | + | |
| | + | Es cada vez más evidente que incluso con los métodos de fijación más utilizados<ref name="Christensen2002" /> se pueden producir cambios significativos en la localización de las proteínas cromosómicas, y estas dificultades técnicas han estado presentes en la mayor parte de las preparaciones cromosómicas utilizadas para realizar los estudios estructurales. Por ello, parece necesario utilizar muestras vivas siempre que sea posible, así como aproximaciones alternativas que permitan un análisis complementario.<ref name="Swedlow2003"> The Making of the Mitotic Chromosome: Modern Insights into Classical Questions,Molecular CellfckLR,http://www.molecule.org/cgi/content/full/11/3/557fckLR</ref> |
| | | | |
| − | En el caso de los organismos eucariontes el cromosoma está formado por tres tipos diferentes de moléculas: el [[ADN]], las [[histona]]s y las proteínas no histónicas. De hecho, los cromosomas eucarióticos son moléculas muy largas de ADN de doble hélice que interactúan con proteínas (histonas y no histonas) y se pueden hallar en estados relajados o poco compactados, como en los núcleos de las células en [[interfase]], hasta en estados altamente compactados, como sucede en la [[metafase]] mitótica.
| + | == La aproximación biofísica == |
| | | | |
| − | === Cronología de descubrimientos ===
| + | Un modo alternativo para el análisis estructural de los cromosomas es el [[Biofísica|biofísico]]. Las medidas precisas de la rigidez y la elasticidad de los cromosomas pueden guiar la construcción de los modelos estructurales. Estudios realizados en diferentes laboratorios indican que los cromosomas presentan una elasticidad remarcable: tanto dentro de las células como en [[Tampón químico|tampones]] fisiológicos, los cromosomas pueden estirarse hasta varias veces su longitud normal y volver de nuevo a su longitud original.<ref name="Poirier2002">The Bending Rigidity of Mitotic Chromosomes, Molecular Biology of the CellfckLR,http://www.molbiolcell.org/cgi/reprint/01-08-0382v1.pdffckLR</ref> |
| | | | |
| − | * [[1841]], los cromosomas fueron descubiertos por [[Karl Wilhelm von Nägeli]].
| + | Sin embargo, los datos obtenidos por diferentes laboratorios son muy variables, probablemente debido a la variedad de tampones utilizado por los distintos grupos. Un estudio de Poirier y Marko en [[2002]] mostró que la elasticidad de los cromosomas es muy sensible a nucleasa.<ref>Mitotic chromosomes are chromatin networks without a mechanically contiguous protein scaffoldfckLR,http://www.physics.ohio-state.edu/~mpoirier/papers/chromosome-no-scaffold.pdffckLR</ref> |
| − | * [[1869]], [[Friedrich Miescher]] descubre el ADN.
| |
| − | * [[1889]], [[Wilhelm von Waldeyer]] les dio el nombre de cromosoma que significa ''cuerpo coloreado'' en idioma griego.
| |
| − | * [[1910]], [[Thomas Hunt Morgan]] describió que son los portadores de los [[gen]]es.
| |
| − | * [[1943]], [[Oswald Avery]], C. McLeod y M. McCarty descubren que el ADN es el material hereditario.
| |
| − | * [[1953]], [[James Dewey Watson]] y [[Francis Harry Compton Crick]] descubren la estructura del ADN.
| |
| − | * [[1966]], [[Severo Ochoa]] completa el código genético.
| |
| − | * [[1972]], D. Jackson, R. Symons, P. Berg: [[molécula]] artificial.
| |
| − | * [[1973]], J. Boyer, S. Cohen: [[clonación]] de bacterias.
| |
| − | * [[1977]], [[Frederick Sanger]]: secuenciación del ADN.
| |
| − | * [[1978]], producción de proteína humana en bacterias.
| |
| − | * [[1981]], se hace el primer diagnóstico prenatal.
| |
| − | * [[1982]], se crean los primeros organismos [[transgénico]]s.
| |
| − | * [[1983]], secuenciación de los primeros genomas enteros.
| |
| − | * [[2001]], secuenciación del [[genoma humano]].
| |
| | | | |
| − | == Estructura y composición química de la cromatina ==
| + | Estos datos sugieren que la integridad mecánica de los cromosomas mitóticos se mantiene por enlaces entre las fibras cromosómicas, no por la existencia de un armazón proteico. La naturaleza de estos enlaces no está clara, pero este estudio estima su frecuencia en 10-20 kb como mínimo. |
| | | | |
| − | Los principales componentes que se obtienen cuando se aísla la [[cromatina]] de los núcleos interfásicos son el ADN, las proteínas histónicas, las proteínas no histónicas y el ARN. La cantidad de proteínas no histónicas puede variar de unos tejidos a otros en el mismo individuo y dentro del mismo tejido a lo largo del desarrollo. | + | == Los componentes bioquímicos de los cromosomas == |
| | | | |
| | + | Un método convencional y muy potente para entender una estructura biológica consiste en establecer una lista que incluya todos sus componentes. Los estudios iniciales de la estructura cromosómica se enfrentaron a muchos problemas técnicos para conseguir aislar bioquímicamente los cromosomas mitóticos de las células, aunque métodos sofisticados permitieron el aislamiento de los cromosomas completos y la identificación del armazón proteico.<ref name="Lewis1982">Higher order metaphase chromosome structure: evidence for metalloprotein interactions,http://www.ncbi.nlm.nih.gov/pubmed/7105181fckLR</ref> |
| | | | |
| − | === Las histonas === | + | Un método alternativo consiste en la utilización de extractos libres de células procedentes de huevos de [[Anfibio|anfibios]]. Este sistema permite la reconstitución ''in vitro'' de cromosomas mitóticos a partir de sustratos simples (por ejemplo, cromatina de [[Semen|esperma]]) en condiciones fisiológicas, de manera que los componentes proteicos de las estructuras que se ensamblan pueden aislarse por centrifugación en un sólo paso y caracterizarse de forma sistemática.<ref name="Hirano1994">fckLR A heterodimeric coiled-coil protein required for mitotic chromosome condensation in vitro,fckLRhttp://www.ncbi.nlm.nih.gov/pubmed/7954811fckLR</ref> |
| | | | |
| − | Las histonas son proteínas básicas, ricas en residuos de [[lisina]] y [[arginina]], que muestran una elevada conservación evolutiva y que interaccionan con el ADN formando una subunidad que se repite a lo largo de la cromatina denominada [[nucleosoma]]. Los principales tipos de histonas que se han aislado en los núcleos interfásicos en diferentes especies eucariontes son: H1, H2A, H2B, H3 y H4. Además de estas histonas, también existen otras que son específicas de tejido como la histona H5 muy rica en lisina (25 moles%) específica de eritrocitos nucleados de vertebrados no mamíferos, y las histonas del endosperma.<ref name=Kornberg1999>Kornberg ,Twenty-Five Years of the Nucleosome, Fundamental Particle of the Eukaryote Chromosome, http://www.rpgroup.caltech.edu/courses/aph161/Handouts/Kornberg1999.pdf</ref> Asimismo, la cromatina centromérica se caracteriza por la presencia de una isoforma específica de la histona H3, denominada CENP-A en vertebrados.
| + | Además de las histonas centrales y una histona de ligamiento, la fracción así aislada contiene '''topoIIa''' (CAP-B en ese estudio), un complejo de cinco subunidades denominado '''[[Condensina]]''' (CAP-C, -E, -D2, -G y -H),<ref name="Hirano1994" /><ref name="Hirano1997">Condensins, Chromosome Condensation Protein Complexes Containing Xcap-c, Xcap-e and a Xenopus …,fckLRhttp://cat.inist.fr/?aModele=afficheNfckLR</ref> '''cromo [[Kinesina]]''' (CAP-D/Klp1 y la [[ATPasa]] remodeladora de cromatina '''ISWI''' (CAP-F). Una de las conclusiones más importantes de estos estudios es que las [[ATPasa]]s son componentes importantes de los cromosomas. La energía de hidrólisis del [[Adenosín trifosfato|ATP]] es utilizada en muchos casos para inducir cambios locales o globales en los cromosomas, mientras que en otros casos sirve para soportar el movimiento de los cromosomas anclados a los microtúbulos. |
| | | | |
| − | Una de las características más destacables es su elevado conservadurismo evolutivo, sobre todo de las histonas H3 y H4. La histona H4 de [[guisante]] y de timo de ternera se diferencian solamente en dos aminoácidos. Este dato indica que las interacciones entre el ADN y las histonas para formar la cromatina deben ser muy semejantes en todos los organismos eucariontes. | + | Una observación sorprendente fue la identificación de la proteína '''titina''' como uno de los componentes de los cromosomas en embriones de ''[[Drosophila]]''. |
| | | | |
| − | Los [[gen]]es que codifican las histonas se encuentran agrupados en nichos (o ''clusters'') que se repiten decenas o centenas de veces. Cada ''cluster'' o grupo contiene el siguiente orden de genes que codifican histonas: H1-H2A-H3-H2B-H4. Estos genes son ricos en pares G-C, ya que codifican proteínas con un elevado contenido en [[lisina]] y [[arginina]], pero están separados por secuencias espaciadoras ricas en pares A-T.<ref name="FCA" /><ref name=Isenberg1979> Isenberg, Annual Reviews in Biochemistry</ref><ref name=Kornberg1999 /><ref name=Grunstein1990>Grunstein ,Histone Function in Transcription, Annual Reviews in Cell Biology
| + | La titina es una proteína filamentosa gigante (~3 MDa) que funciona como un componente integral del filamento grueso en el sarcómero de las células [[Músculo|musculares]]. Se ha propuesto que, en analogía con su función muscular, la isoforma de la titina que se encuentra en los cromosomas puede funcionar por un lado como una "regla molecular" que determina la longitud cromosómica, y por otro como un "muelle molecular" que proporciona elasticidad a los cromosomas. |
| − | </ref><ref name=Kedes1979>Histone Genes and Histone Messengers,Annual Reviews in Biochemistry,volume 48,pages = 837–870
| |
| − | </ref>
| |
| | | | |
| − | === El nucleosoma ===
| + | == El ARN == |
| | | | |
| − | La cromatina de núcleos en interfase, cuando se observa mediante técnicas de microscopia electrónica, se puede describir como un collar de cuentas o un rosario, en el que cada cuenta es una subunidad esférica o globular que se denomina [[nucleosoma]]; los nucleosomas se hallan unidos entre sí mediante fibras de ADN. Se sigue, entonces, que la unidad básica de la estructura de la cromatina es el nucleosoma.
| + | El [[ARN]] parece jugar algún papel en el plegamiento del cromosoma eucariótico. Al menos en humanos y en ''Drosophila'' se han encontrado evidencias de este papel estructural del ARN. |
| − | Un nucleosoma típico está asociado a 200 [[par de bases|pares de bases]] (pb) de ADN y está formado por una '''médula''' (''core'' en inglés) y un '''ligador''' (o ''linker''). La médula está formada por un octámero constituido por dos subunidades de las histonas H2A, H2B, H3 y H4. En otras palabras, se trata de un dímero: 2×(H2A, H2B, H3, H4).
| |
| | | | |
| − | Los trabajos de [[Aaron Klug]] y colaboradores<ref name="kñug80">Klug A, Rhodes D, Smith J, Finch JT, Thomas JO. A low resolution structure for the histone core of the nucleosome. Nature. 1980 Oct 9;287(5782):509–516.</ref><ref name="kñug81">Klug, A. & L C Lutter.1981. [http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=327434 The helical periodicity of DNA on the nucleosome]. Nucleic Acids Res. September 11; 9(17): 4267–4283.</ref> sobre la disposición de las histonas en la médula del nucleosoma le valieron el [[Premio Nobel]] de Química en 1982.
| + | Sin embargo, hay que tener en cuenta que el armazón proteico descrito por Laemmli y colaboradores (1977) no se ve afectado por el tratamiento con ARNasa. Podría ser que las propias proteínas del armazón protegieran al ARN de la acción de la ARNasa. |
| | | | |
| − | Alrededor de la médula se enrolla el ADN (140 [[Par de bases|pb]]) dando casi dos vueltas (una vuelta y tres cuartos). El resto del ADN (60 pb) forma parte del ligador (''linker''), que interacciona con la histona H1. La cantidad de ADN asociado con un nucleosoma varía de una especie a otra, de 154 pb a 241 pb; esta variación se debe fundamentalmente a la cantidad de ADN asociada al ligador (''linker'').<ref name="FCA">Facultad de Ciencias Veterinarias. Universidad Nacional de la Plata. [http://www.fcv.unlp.edu.ar/sitios-catedras/87/material/condensacion%20y%20morfologia%20cromosomica.pdf MORFOLOGÍA CROMOSÓMICA - CARIOTIPO].</ref>
| + | En cualquier caso, es conveniente recordar que el ADN del cromosoma bacteriano también está organizado en dominios y que el ARN podría jugar algún papel en el mantenimiento de dicha estructura. En organismos con características intermedias entre las de procariontes y eucariontes como los dinoflagelados, también existen datos que apoyan el papel estructural del ARN en la organización cromosómica. |
| | | | |
| − | Las fibras de ADN dúplex desnudo tienen un grosor de 20 [[Å]]. La asociación del ADN con las histonas genera los nucleosomas, que muestran unos 100 Å de diámetro. A su vez, los nucleosomas se pueden enrollar helicoidalmente para formar un solenoide (una especie de muelle) que constituye las fibras de cromatina de los núcleos intefásicos con un diámetro aproximado de 300 Å. Los solenoides pueden volverse a enrollar para dar lugar a supersolenoides con un diámetro de 4.000 Å a 6.000 Å que constituirían las fibras de los cromosomas metafásicos.<ref name="kñug80" /><ref name=autogenerated1>Klug, A. & L C Lutter.1981. [http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=327434 The helical periodicity of DNA on the nucleosome] Nucleic Acids Res. September 11; 9(17): 4267–4283.</ref>
| + | == Elementos diferenciados en la estructura cromosómica == |
| | | | |
| | + | La organización de la cromatina no es uniforme a lo largo de la estructura del cromosoma. De hecho, se pueden distinguir una serie de elementos diferenciados: los centrómeros (o constricciones primarias), los [[Telómero]]s (o extremos cromosómicos), las [[Regiones organizadoras del nucléolo]] (NORs según la abreviatura en inglés) y los [[Cromómero]]s, todos ellos caracterizados por contener secuencias específicas de ADN.<ref name="Piqueras" /> |
| | | | |
| − | === Proteínas cromosómicas no histónicas: el armazón proteico === | + | == Regiones organizadoras del nucléolo == |
| | | | |
| − | Las proteínas cromosómicas no histónicas son proteínas diferentes de las histonas que se extraen de la cromatina de los núcleos con ClNa 0.35M (solución salina), tienen un alto contenido en [[aminoácido]]s básicos (25% o más), alto contenido en aminoácidos ácidos (20-30%), una elevada proporción de prolina (7%), bajo contenido en aminoácidos hidrofóbicos y una alta movilidad electroforética. Las proteínas cromosómicas no histónicas que se extraen de la cromatina de los núcleos varían mucho dependiendo de la técnica de aislamiento empleada. Un grupo de estas proteínas cromosómicas no histónicas presentan alta movilidad electrofóretica y se denominan abreviadamente HMG (grupo de alta movilidad).
| + | Además de las constricciones primarias, en algunos cromosomas se puede distinguir otro tipo de "adelgazamiento" denominada ''constricción secundaria'', las que se hallan relacionadas normalmente con la presencia de las secuencias de [[ADN ribosómico]]. Tales regiones se denominan "[[Regiones organizadoras del nucléolo]]" (o, sencillamente, "NORs" por el acrónimo en inglés para ''nucleolus organizer regions''). |
| | | | |
| − | ==== Las proteínas HMG ====
| + | Las secuencias de ADN ribosómico quedan englobadas dentro del [[Nucléolo]], que permanece adosado a las NORs durante buena parte del [[Ciclo celular]].<ref name="Piqueras" /> Los cromosomas con NOR en muchos casos presentan un segmento que une a esta región con el telómero, el cual se denomina ''satélite'' o ''trabante''.<ref name="Panzera" /> |
| − | Estas proteínas se agrupan en una superfamilia por sus similitudes físicas y químicas, y porque todas ellas actúan como elementos arquitectónicos que afectan múltiples procesos dependientes de [[ADN]] en el contexto de la [[cromatina]]. Todas las HMGs tienen un terminal [[carboxilo]] rico en aminoácidos de tipo ácido, y se clasifican en tres familias (HMGA, HMGB y HMGN), cada una con un motivo funcional único, que induce cambios específicos en sus sitios de unión y participa en funciones celulares diferentes.<ref name=Hock2007>{{citation
| |
| − | | last1 = Hock | first1 = R.
| |
| − | | last2 = Furusawa | first2 = T.
| |
| − | | last3 = Ueda | first3 = T.
| |
| − | | last4 = Bustin | first4 = M.
| |
| − | | year = 2007
| |
| − | | title = HMG chromosomal proteins in development and disease
| |
| − | | journal = Trends in Cell Biology
| |
| − | | volume = 17
| |
| − | | issue = 2
| |
| − | | pages = 72–79
| |
| − | | doi = 10.1016/j.tcb.2006.12.001
| |
| − | | url = http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=2442274
| |
| − | }}</ref>
| |
| | | | |
| − | La familia HMGA consta de cuatro miembros, y todos ellos contienen un motivo funcional característico, denominado "gancho AT" (''AT hook''). A través de estas secuencias, las HMGAs se unen preferencialmente a secuencias ricas en AT de [[ADN#Estructuras en doble hélice|ADN]] en forma-B e inducen cambios de conformación que inducen la unión de componentes adicionales. Las proteínas HMGA tienen una cola C-terminal ácida, que podría ser importante para la interacción con otras proteínas. Tradicionalmente, este grupo se denominaba HMG-I/Y.<ref name=Bustin1999>{{citation
| + | == Cromómeros == |
| − | | last = Bustin | first = M.
| |
| − | | year = 1999
| |
| − | | title = Regulation of DNA-Dependent Activities by the Functional Motifs of the High-Mobility-Group Chromosomal Proteins
| |
| − | | journal = Molecular and Cellular Biology
| |
| − | | volume = 19
| |
| − | | issue = 8 | |
| − | | pages = 5237–5246
| |
| − | | url = http://mcb.asm.org/cgi/content/full/19/8/5237
| |
| − | }}</ref>
| |
| | | | |
| − | La familia HMGB consta de tres variantes, cada una de las cuales contiene dos motivos funcionales (las cajas HMG) y un extremo C-terminal muy ácido. Las cajas HMG están formadas por tres α-hélices plegadas conjuntamente para formar una estructura en forma de L, que en parte se introduce en la hendidura menor del [[ADN#hendiduras mayor y menor|ADN]], plegándolo intensamente. Existen ligeras diferencias entre las cajas HMG de las diferentes HMGB, lo que confiere especificidad a cada una de ellas. Las colas acídicas modulan la afinidad por una variedad de estructuras de ADN distorsionado.<ref name=Hock2007 /> Tradicionalmente estas proteínas se denominaban proteínas HMG-1/-2.<ref name=Bustin1999 />
| + | Los cromómeros son "engrosamientos" o regiones más compactadas de la eucromatina, que se distribuyen de manera más o menos uniforme a lo largo de los cromosomas y se pueden visualizar durante las fases de la mitosis o de la meiosis de menor condensación de la cromatina (profase). |
| | | | |
| − | La familia de proteínas HMGN se caracteriza por un dominio cargado positivamente, el dominio de unión a [[nucleosoma]]s, y por una cola C-terminal ácida, el dominio de desplegado de la cromatina. Las proteínas HMGN se unen específicamente a los nucleosomas y alteran tanto la estructura local como la estructura de nivel superior de la cromatina.<ref name=Hock2007 /> Estas proteínas se conocen tradicionalmente como la subfamilia HMG-14/-17.<ref name=Bustin1999 />
| + | Su naturaleza molecular sigue siendo controvertida, pero podrían ser consecuencia de un cierto grado de compartimentalización en la distribución de las secuencias de ADN y en la organización de los cromosomas. |
| | | | |
| − | Se han detectado más de 20 proteínas HMG; las proteínas HMG-1/-2 (HMGB) y HMG-14/-17 (HMGA) se han identificado en todas las especies de mamíferos, aves y peces estudiadas hasta el momento. Las proteínas HMG-1/-2 se encuentran sólo en el núcleo, están implicadas en la replicación, se unen preferentemente a ADN de hélice sencilla, desenrollan el ADN dúplex y se estima que existe una molécula de HMG-1 ó HMG-2 por cada 15 nucleosomas. Las proteínas HMG-14/-17 se encuentran en el núcleo y en el citoplasma, están relacionadas con la regulación de la transcripción y se estima que existe una molécula de HMG14 ó HMG-17 por cada 10 nucleosomas.
| + | Desde hace varios años, el grupo de Giorgio Bernardi en Italia, sostiene que hay una distribución compartimentalizada de secuencias relativamente grandes de ADN (llamadas "isócoras") en el genoma de los [[Vertebrado]]s de sangre caliente, de modo tal que cada isócora tiene un contenido en bases (porcentaje de C+G) relativamente homogéneo pero diferente al de las demás. |
| | | | |
| − | ==== El armazón proteico de los cromosomas ====
| + | Después de publicado el primer borrador del "[[Proyecto Genoma Humano]]", parece confirmarse la existencia de cinco isócoras en el genoma de los humanos, dos de ellas ricas en A y T, y tres ricas en G y C. La distribución alternante de ambos tipos de isócoras podría ser la explicación molecular de la existencia de cromómeros. |
| − | Muchos estudios citogenéticos muestran que el ADN en los cromosomas está intensamente enrollado cuando se observan al microscopio. El primer nivel de compactación lineal del ADN es el obtenido por el plegamiento de la fibra del ADN alrededor de los [[nucleosoma]]s,<ref name=Kornberg1974>{{citation
| + | |
| − | | last = Kornberg | first = Roger D.
| + | == Estructura externa de los cromosomas: número, forma y tamaño == |
| − | | year = 1974
| + | |
| − | | title = Chromatin Structure: A Repeating Unit of Histones and DNA
| + | El estudio de la estructura externa de los cromosomas de cualquier especie eucariótica consiste en analizar la forma, tamaño y número de los cromosomas que posee. El mejor momento para llevar a cabo dicho estudio suele ser aquel en el que los cromosomas han alcanzado su máximo grado de contracción y tienen sus bordes perfectamente definidos. Dicho momento suele ser la [[Metafase]] mitótica. |
| − | | journal = Science
| + | |
| − | | volume = 184
| + | El estudio de la estructura externa de los cromosomas culmina con la obtención del [[Cariotipo]].<ref name="UNCOR">Facultad de Ciencias Agropecuarias. Universidad Nacional de Córdoba (Argentina). Genética. Capítulo 2. Forma y tamaño cromosómico. Cariotipo. [http://www.agro.uncor.edu/~genetica/CAPIS2.pdf]</ref> Los cromosomas se pueden estudiar en distintos momentos según la especie y dependiendo de los objetivos planteados. |
| − | | issue = 4139
| + | |
| − | | pages = 868–871
| + | Algunas especies tienen cromosomas que se pueden observar con gran detalle en [[Interfase]], tal es el caso de ''Drosophila melanogaster'', que posee [[Cromosoma politénico|cromosomas politénicos]] gigantes que se observan en las glándulas salivales de dicho insecto, y el de ''[[Chironomus tentans]]'', otro díptero. |
| − | | doi = 10.1126/science.184.4139.868
| |
| − | | url = http://www.sciencemag.org/cgi/content/citation/184/4139/868
| |
| − | | pmid = 4825889
| |
| − | }}</ref> responsable del primer nivel de plegamiento lineal (de 6 a 7 veces). El siguiente nivel de plegamiento corresponde a la denominada "fibra de 30 nm", que es lo que se observa en núcleos en interfase. Aunque ha habido mucha controversia para describir esta estructura,<ref name=Woodcock2001>{{citation
| |
| − | | last1 = Woodcock | first1 = C.L.
| |
| − | | last2 = Dimitrov | first2 = S.
| |
| − | | year = 2001 | |
| − | | title = Higher-order structure of chromatin and chromosomes
| |
| − | | journal = Current Opinion in Genetics & Development
| |
| − | | volume = 11
| |
| − | | issue = 2
| |
| − | | pages = 130–135
| |
| − | | url = http://linkinghub.elsevier.com/retrieve/pii/S0959437X00001696
| |
| − | }}</ref> la fibra de 30 nm se considera normalmente como el enrollamiento helicoidal de las fibras de nucleosomas, que genera la compactación de otras 6-7 veces. En mitosis, la fibra de 30 nm debe compactarse otras 200-500 veces hasta alcanzar el diámetro observado al microscopio para las fibras cromosómicas durante la división celular (~700 nm).<ref name=Li1998>{{citation
| |
| − | | last1 = Li | first1 = Gang
| |
| − | | last2 = Sudlow | first2 = Gail
| |
| − | | last3 = Belmont | first3 = Andrew S.
| |
| − | | year = 1998
| |
| − | | title = Interphase Cell Cycle Dynamics of a Late-Replicating, Heterochromatic Homogeneously Staining Region: Precise Choreography of Condensation/Decondensation and Nuclear Positioning
| |
| − | | journal = The Journal of Cell Biology
| |
| − | | volume = 140
| |
| − | | issue = 5
| |
| − | | pages = 975–989
| |
| − | | doi = 10.1083/jcb.140.5.975
| |
| − | | url = http://www.jcb.org/cgi/content/full/140/5/975
| |
| − | | pmid = 9490713
| |
| − | }}</ref> Por tanto, se han tenido que producir nuevos superenrollamientos. Sin embargo, la explicación de estos plegamientos de orden superior ha generado gran controversia.<ref name=Woodcock2001 />
| |
| − |
| |
| − | Laemmli y colaboradores en 1977 consiguieron aislar cromosomas metafásicos desprovistos de histonas mediante un tratamiento con sulfato de dextrano y heparina.<ref name=Paulson1977>{{citation
| |
| − | | last1 = Paulson | first1 = J.R.
| |
| − | | last2 = Laemmli | first2 = U.K.
| |
| − | | year = 1977
| |
| − | | title = The structure of histone-depleted metaphase chromosomes
| |
| − | | journal = Cell
| |
| − | | volume = 12
| |
| − | | issue = 3
| |
| − | | pages = 817–28
| |
| − | | doi = 10.1016/0092-8674(77)90280-X
| |
| − | | url = http://www.cell.com/content/article/abstract?uid=PII009286747790280X
| |
| − | }}</ref> Estos cromosomas metafásicos desprovistos de histonas presentan una médula central densamente teñida que ha sido denominada “scaffold” (armazón). Este armazón proteico (“scaffold”) es resistente a la acción de la [[ADNasa]], [[ARNasa]] y también a soluciones de ClNa 2M. Sin embargo, desaparece por tratamientos con urea 4M y dodecil sulfato sódico o por tratamiento con enzimas proteolíticas. Por tanto, se trata de un armazón proteico.
| |
| | | | |
| − | La observación a microscopía electrónica pone de manifiesto que de este armazón proteico (“scaffold”) salen y llegan lazos o fibras que pueden hacerse desaparecer mediante tratamiento con ADNasa. Por tanto, estos lazos o dominios que arrancan del armazón proteico son lazos de ADN. Uno de los principales componentes del armazón proteico es la enzima '''[[topoisomerasa]] II α''' (topoIIα),<ref name=Earnshaw1985>{{citation
| + | El cariotipo se confecciona usualmente después de un apropiado pre-tratamiento y tinción de las células, para hacer más visibles los cromosomas individuales. |
| − | | last1 = Earnshaw | first1 = W.C.
| |
| − | | last2 = Halligan | first2 = B.
| |
| − | | last3 = Cooke | first3 = C.A.
| |
| − | | last4 = Heck | first4 = M.M.
| |
| − | | last5 = Liu | first5 = L.F.
| |
| − | | year = 1985
| |
| − | | title = Topoisomerase II is a structural component of mitotic chromosome scaffolds
| |
| − | | journal = The Journal of Cell Biology
| |
| − | | volume = 100
| |
| − | | issue = 5
| |
| − | | pages = 1706–1715
| |
| − | | doi = 10.1083/jcb.100.5.1706
| |
| − | | url = http://www.google.co.uk/webhp?hl=en
| |
| − | | pmid = 2985625
| |
| − | }}</ref><ref name=Gasser1986>{{citation
| |
| − | | last1 = Gasser | first1 = S.M.
| |
| − | | last2 = Laroche | first2 = T.
| |
| − | | last3 = Falquet | first3 = J.
| |
| − | | last4 = Tour | first4 = E.
| |
| − | | last5 = Laemmli | first5 = U.K.
| |
| − | | year = 1986
| |
| − | | title = Metaphase chromosome structureInvolvement of topoisomerase II
| |
| − | | journal = J. Mol. Biol
| |
| − | | volume = 188
| |
| − | | pages = 613–629
| |
| − | | doi = 10.1016/S0022-2836(86)80010-9
| |
| − | }}</ref> una enzima que produce cortes en el ADN dúplex a nivel de ambas hélices. La topoisomerasa II (girasa) interviene durante la replicación del ADN creando o relajando los superenrollamientos. En [[mamífero]]s se encuentran dos [[isoforma]]s de esta enzima (α y ß), con propiedades similares ''in vitro''. Sin embargo, aunque topoIIα y β se comportan ''in vivo'' de forma similar en interfase, en [[mitosis]] tienen un comportamiento diferente: sólo topoIIα está asociado mayoritariamente a los cromosomas.<ref name=Christensen2002>{{citation
| |
| − | | last1 = Christensen | first1 = Morten O.
| |
| − | | last2 = Larsen | first2 = Morten K.
| |
| − | | last3 = Barthelmes | first3 = Hans Ullrich
| |
| − | | last4 = Hock | first4 = Robert
| |
| − | | last5 = Andersen | first5 = Claus L.
| |
| − | | last6 = Kjeldsen | first6 = Eigil
| |
| − | | last7 = Knudsen | first7 = Birgitta R.
| |
| − | | last8 = Westergaard | first8 = Ole
| |
| − | | last9 = Boege | first9 = Fritz
| |
| − | | last10 = Mielke | first10 = Christian
| |
| − | | year = 2002
| |
| − | | title = Dynamics of human DNA topoisomerases II{alpha} and II{beta} in living cells
| |
| − | | journal = The Journal of Cell Biology
| |
| − | | volume = 157
| |
| − | | issue = 1
| |
| − | | pages = 31–44
| |
| − | | doi = 10.1083/jcb.200112023
| |
| − | | url = http://www.jcb.org/cgi/content/full/157/1/31
| |
| − | | pmid = 11927602
| |
| − | }}</ref> La aparición de la topoisomerasa II α sólo en el armazón proteico sugiere que se encuentra en la base de los lazos o dominios de ADN, indicando que esta organización en dominios podría estar relacionada con la replicación y transcripción. Otras enzimas, como la topoisomerasa I que produce cortes en el ADN dúplex a nivel de una sola hélice y la HMG-17, se encuentran sólo en los lazos o dominios y no en el armazón proteico.
| |
| − | La evidencia existente hasta el momento sugiere que las fibras de solenoides (30 nm) formarían los lazos o dominios que emanan del armazón proteico y que este armazón estaría a su vez enrollado formando una espiral.<ref name=Paulson1977 />
| |
| | | | |
| − | Además de la enzima topoisomerasa II α, el otro componente fundamental propuesto del armazón proteico es la '''[[condensina]] 13S'''.<ref name=Maeshima2003>{{citation
| + | Al diagrama simplificado de los cromosomas metafásicos del cariotipo se lo denomina [[Idiograma]], que se construye con el [[Número genómico]]. Para realizar el ordenamiento de los cromosomas tanto en cariotipos como idiogramas se debe tener en cuenta el tamaño cromosómico (ubicados de mayor a menor, con el brazo corto “bc” o "p" hacia arriba y el brazo largo “bl” o "q" hacia abajo); posición del centrómero (generalmente alineados) y presencia de constricciones secundarias y satélites.<ref name="UNCOR" /> |
| − | | last1 = Maeshima | first1 = K.
| |
| − | | last2 = Laemmli | first2 = U.K.
| |
| − | | year = 2003
| |
| − | | title = A Two-Step Scaffolding Model for Mitotic Chromosome Assembly
| |
| − | | journal = Developmental Cell
| |
| − | | volume = 4
| |
| − | | issue = 4
| |
| − | | pages = 467–480
| |
| − | | doi = 10.1016/S1534-5807(03)00092-3
| |
| − | | url = http://linkinghub.elsevier.com/retrieve/pii/S1534580703000923
| |
| − | }}</ref> La tinción doble con [[anticuerpo]]s contra topoIIα y condensina genera un armazón con aspecto de un "polo de barbero" (un cilindro con bandas espirales rojas y blancas que simboliza la antigua doble profesión de los barberos como cirujanos), en la cual alternan "cuentas" enriquecidas en topoIIα y en condensina. Esta estructura parece estar generada por dos cadenas yuxtapuestas. Parece ser que el ensamblaje de este armazón proteico tiene lugar en dos fases, ya que la condensina sólo se asocia en la transición de profase a metafase durante la [[mitosis]]. Sin embargo, el papel estructural de la topoIIα en la organización de los cromosomas aún se discute, ya que otros grupos argumentan que esta enzima se intercambia rápidamente tanto en los brazos cromosómicos como en los [[cinetocoro]]s durante la [[mitosis]].<ref name=Tavormina2002>{{citation
| |
| − | | last1 = Tavormina | first1 = Penny A.
| |
| − | | last2 = Come | first2 = Marie-George
| |
| − | | last3 = Hudson | first3 = Joanna R.
| |
| − | | last4 = Mo | first4 = Yin-Yuan
| |
| − | | last5 = Beck | first5 = William T.
| |
| − | | last6 = Gorbsky | first6 = Gary J.
| |
| − | | year = 2002
| |
| − | | title = Rapid exchange of mammalian topoisomerase II{alpha} at kinetochores and chromosome arms in mitosis
| |
| − | | journal = The Journal of Cell Biology
| |
| − | | volume = 158
| |
| − | | issue = 1
| |
| − | | pages = 23–29
| |
| − | | doi = 10.1083/jcb.200202053
| |
| − | | url = http://www.jcb.org/cgi/content/full/158/1/23
| |
| − | | pmid = 12105179
| |
| − | }}</ref><ref name=Christensen2002 />
| |
| | | | |
| − | Los dominios de ADN parecen estar unidos al armazón proteico por unas regiones específicas denominadas abreviadamente SARs (''scaffold associated regions'', también denominadas MARS, ''matrix attachment regions'') que se detectan cuando los cromosomas metafásicos desprovistos de histonas se tratan con endonucleasas de restricción.<ref name=Mirkovitch1984>{{citation
| + | == Cromosomas sexuales == |
| − | | last1 = Mirkovitch | first1 = J.
| |
| − | | last2 = Mirault | first2 = M.E.
| |
| − | | last3 = Laemmli | first3 = U.K.
| |
| − | | year = 1984
| |
| − | | title = Organization of the higher-order chromatin loop: specific DNA attachment sites on nuclear scaffold
| |
| − | | journal = Cell
| |
| − | | volume = 39
| |
| − | | issue = 1
| |
| − | | pages = 223–32
| |
| − | | doi = 10.1016/0092-8674(84)90208-3
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/6091913
| |
| − | }}</ref> Después de este tratamiento quedan regiones de ADN unidas al armazón que a su vez resisten la digestión con exonucleasas gracias a que están protegidas por una proteína. Cuando se digiere esta proteína, las regiones de ADN protegidas contienen secuencias de varios cientos de pares de bases que son muy ricas en AT y que presentan sitios de unión para topoisomerasa II e [[histona]] H1. Estas regiones de unión específicas de los dominios al armazón proteico son las regiones SARs. Se ha sugerido que estas regiones juegan un papel global durante la condensación de los cromosomas mitóticos y son necesarias para el mantenimiento de la estructura de los cromosomas.<ref name=Hart1998>{{citation
| |
| − | | last1 = Hart | first1 = C.M.
| |
| − | | last2 = Laemmli | first2 = U.K.
| |
| − | | year = 1998
| |
| − | | title = Facilitation of chromatin dynamics by SARs
| |
| − | | journal = Current Opinion in Genetics & Development
| |
| − | | volume = 8 | |
| − | | issue = 5
| |
| − | | pages = 519–525
| |
| − | | doi = 10.1016/S0959-437X(98)80005-1
| |
| − | | url = http://www.biology.lsu.edu/faculty_listings/fac_pages/chart/1998%20hart.pdf
| |
| − | }}</ref> Las regiones SARs también podrían estar implicadas en la [[expresión génica]], al facilitar tanto la transición como la expansión de una estructura abierta de la cromatina.
| |
| | | | |
| − | === Modelos alternativos de la estructura cromosómica ===
| + | En muchos organismos, uno de los pares de los cromosomas homólogos es distinto al resto, realizando la determinación del sexo del individuo. A estos cromosomas se les llama cromosomas sexuales o heterocromosomas e incluso gonosomas, porque determinan el [[Identidad sexual|sexo]]. |
| − | Es cada vez más evidente que incluso con los métodos de fijación más utilizados<ref name=Christensen2002 /> se pueden producir cambios significativos en la localización de las proteínas cromosómicas, y estas dificultades técnicas han estado presentes en la mayor parte de las preparaciones cromosómicas utilizadas para realizar los estudios estructurales. Por ello, parece necesario utilizar muestras vivas siempre que sea posible, así como aproximaciones alternativas que permitan un análisis complementario.<ref name=Swedlow2003>{{citation
| |
| − | | last1 = Swedlow | first1 = J.R.
| |
| − | | last2 = Hirano | first2 = T.
| |
| − | | year = 2003
| |
| − | | title = The Making of the Mitotic Chromosome: Modern Insights into Classical Questions
| |
| − | | journal = Molecular Cell
| |
| − | | volume = 11
| |
| − | | issue = 3
| |
| − | | pages = 557–569
| |
| − | | doi = 10.1016/S1097-2765(03)00103-5
| |
| − | | url = http://www.molecule.org/cgi/content/full/11/3/557
| |
| − | }}</ref>
| |
| | | | |
| − | ==== La aproximación biofísica ====
| + | *'''Sistema de determinación XY''': es propio del ser humano y muchos otros animales. Las Hembras, siendo XX, darán [[Gameto]]s iguales con [[Cromosoma X]], sexo homogamético y los machos, siendo XY, darán dos tipos de gametos, uno con el cromosoma X y otro con el [[Cromosoma Y]]. La probabilidad de que en la [[Fecundación]], al unirse los gametos, resulte una combinación XX (hembra) o XY (macho) es aproximadamente del 50%. |
| − | Un modo alternativo para el análisis estructural de los cromosomas es el [[biofísica|biofísico]]. Las medidas precisas de la rigidez y la elasticidad de los cromosomas pueden guiar la construcción de los modelos estructurales. Estudios realizados en diferentes laboratorios indican que los cromosomas presentan una elasticidad remarcable: tanto dentro de las células como en [[tampón químico|tampones]] fisiológicos, los cromosomas pueden estirarse hasta varias veces su longitud normal y volver de nuevo a su longitud original.<ref name=Poirier2002>{{citation
| + | *'''Sistema de determinación ZW''': en otras especies (mariposas, p.e.) ocurre lo contrario, el sexo masculino es homogamético (ZZ) y el femenino heterogamético (ZW). |
| − | | last1 = Poirier | first1 = M.G.
| + | *'''Sistema de determinación XO''': otras especies (peces, insectos, anfibios) que no tienen el cromosoma Y, determinándose el sexo por el número de cromosomas X, macho XO y hembra XX. |
| − | | last2 = Eroglu | first2 = S.
| |
| − | | last3 = Marko | first3 = J.F.
| |
| − | | year = 2002
| |
| − | | title = The Bending Rigidity of Mitotic Chromosomes
| |
| − | | journal = Molecular Biology of the Cell
| |
| − | | pages = 10804011
| |
| − | | url = http://www.molbiolcell.org/cgi/reprint/01-08-0382v1.pdf
| |
| − | }}</ref> Sin embargo, los datos obtenidos por diferentes laboratorios son muy variables, probablemente debido a la variedad de tampones utilizado por los distintos grupos. Un estudio de Poirier y Marko en 2002 mostró que la elasticidad de los cromosomas es muy sensible a nucleasa.<ref>{{Citation
| |
| − | | last1 = Poirier | first1 = M.G.
| |
| − | | last2 = Marko | first2 = J.F.
| |
| − | | year = 2002
| |
| − | | journal = Proc. Natl. Acad. Sci. USA
| |
| − | | volume = 99
| |
| − | | pages = 15393-15397
| |
| − | | title = Mitotic chromosomes are chromatin networks without a mechanically contiguous protein scaffold
| |
| − | | url = http://www.physics.ohio-state.edu/~mpoirier/papers/chromosome-no-scaffold.pdf
| |
| − | }}</ref> Estos datos sugieren que la integridad mecánica de los cromosomas mitóticos se mantiene por enlaces entre las fibras cromosómicas, no por la existencia de un armazón proteico. La naturaleza de estos enlaces no está clara, pero este estudio estima su frecuencia en 10-20 kb como mínimo.
| |
| | | | |
| − | ==== Los componentes bioquímicos de los cromosomas ==== | + | == Forma de los cromosomas == |
| − | Un método convencional y muy potente para entender una estructura biológica consiste en establecer una lista que incluya todos sus componentes. Los estudios iniciales de la estructura cromosómica se enfrentaron a muchos problemas técnicos para conseguir aislar bioquímicamente los cromosomas mitóticos de las células, aunque métodos sofisticados permitieron el aislamiento de los cromosomas completos y la identificación del armazón proteico.<ref name=Lewis1982>{{citation
| |
| − | | last1 = Lewis | first1 = C.D.
| |
| − | | last2 = Laemmli | first2 = U.K. | |
| − | | year = 1982
| |
| − | | title = Higher order metaphase chromosome structure: evidence for metalloprotein interactions
| |
| − | | journal = Cell
| |
| − | | volume = 29
| |
| − | | issue = 1
| |
| − | | pages = 171–81
| |
| − | | doi = 10.1016/0092-8674(82)90101-5
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/7105181
| |
| − | }}</ref>
| |
| | | | |
| − | Un método alternativo consiste en la utilización de extractos libres de células procedentes de huevos de [[anfibio]]s. Este sistema permite la reconstitución ''in vitro'' de cromosomas mitóticos a partir de sustratos simples (por ejemplo, cromatina de [[esperma]]) en condiciones fisiológicas, de manera que los componentes proteicos de las estructuras que se ensamblan pueden aislarse por centrifugación en un sólo paso y caracterizarse de forma sistemática.<ref name=Hirano1994>{{citation
| + | La forma de los cromosomas es para todas las células somáticas constante y característica de cada especie. La forma depende fundamentalmente de las constricciones que presente el cromosoma y de su localización en la cromátida. |
| − | | last1 = Hirano | first1 = T.
| |
| − | | last2 = Mitchison | first2 = T.J.
| |
| − | | year = 1994
| |
| − | | title = A heterodimeric coiled-coil protein required for mitotic chromosome condensation in vitro
| |
| − | | journal = Cell
| |
| − | | volume = 79
| |
| − | | issue = 3
| |
| − | | pages = 449–58
| |
| − | | doi = 10.1016/0092-8674(94)90254-2
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/7954811
| |
| − | }}</ref> Además de las histonas centrales y una histona de ligamiento, la fracción así aislada contiene '''topoIIα''' (CAP-B en ese estudio), un complejo de cinco subunidades denominado '''[[condensina]]''' (CAP-C, -E, -D2, -G y -H),<ref name=Hirano1994 /><ref name=Hirano1997>{{citation
| |
| − | | last1 = Hirano | first1 = M.
| |
| − | | last2 = Kobayashi | first2 = R.
| |
| − | | year = 1997
| |
| − | | title = Condensins, Chromosome Condensation Protein Complexes Containing Xcap-c, Xcap-e and a Xenopus …
| |
| − | | journal = Cell(Cambridge)
| |
| − | | volume = 89
| |
| − | | issue = 4
| |
| − | | pages = 511–521
| |
| − | | url = http://cat.inist.fr/?aModele=afficheN
| |
| − | }}</ref> '''cromo[[kinesina]]''' (CAP-D/Klp1<ref name=Vernos1995>{{citation
| |
| − | | last1 = Vernos | first1 = I.
| |
| − | | last2 = Raats | first2 = J.
| |
| − | | last3 = Hirano | first3 = T.
| |
| − | | last4 = Heasman | first4 = J.
| |
| − | | last5 = Karsenti | first5 = E.
| |
| − | | last6 = Wylie | first6 = C.
| |
| − | | year = 1995
| |
| − | | title = Xklp 1, A Chromosomal Xenopus Kinesin-like Protein Essential for Spindle Organization and Chromosome …
| |
| − | | journal = Cell(Cambridge)
| |
| − | | volume = 81
| |
| − | | issue = 1
| |
| − | | pages = 117–127
| |
| − | | url = http://cat.inist.fr/?aModele=afficheN
| |
| − | }}</ref>) y la [[ATPasa]] remodeladora de cromatina '''ISWI'''<ref name=Vernos1995>{{citation
| |
| − | | last1 = Vernos | first1 = I.
| |
| − | | last2 = Raats | first2 = J.
| |
| − | | last3 = Hirano | first3 = T.
| |
| − | | last4 = Heasman | first4 = J.
| |
| − | | last5 = Karsenti | first5 = E.
| |
| − | | last6 = Wylie | first6 = C.
| |
| − | | year = 1995
| |
| − | | title = Xklp 1, A Chromosomal Xenopus Kinesin-like Protein Essential for Spindle Organization and Chromosome …
| |
| − | | journal = Cell(Cambridge)
| |
| − | | volume = 81
| |
| − | | issue = 1
| |
| − | | pages = 117–127
| |
| − | | url = http://cat.inist.fr/?aModele=afficheN
| |
| − | }}</ref> (CAP-F). Una de las conclusiones más importantes de estos estudios es que las [[ATPasa]]s son componentes importantes de los cromosomas. La energía de hidrólisis del [[Adenosín trifosfato|ATP]] es utilizada en muchos casos para inducir cambios locales o globales en los cromosomas, mientras que en otros casos sirve para soportar el movimiento de los cromosomas anclados a los [[microtúbulo]]s.
| |
| | | | |
| − | Una observación sorprendente fue la identificación de la proteína '''titina''' como uno de los componentes de los cromosomas en embriones de ''[[Drosophila]]''.<ref name=MacHado1998>{{citation
| + | El cromosoma se encuentra constituido básicamente por el centrómero que divide el cromosoma en un brazo corto o brazo p y un brazo largo o brazo q. Algunos cromosomas presentan satélites en el brazo corto. |
| − | | last1 = MacHado | first1 = C.
| |
| − | | last2 = Sunkel | first2 = C.E.
| |
| − | | last3 = Andrew | first3 = D.J.
| |
| − | | year = 1998
| |
| − | | title = Human Autoantibodies Reveal Titin as a Chromosomal Protein
| |
| − | | journal = The Journal of Cell Biology
| |
| − | | volume = 141
| |
| − | | issue = 2
| |
| − | | pages = 321–333
| |
| − | | url = http://www.jcb.org/cgi/content/full/141/2/321
| |
| − | }}</ref> La titina es una proteína filamentosa gigante (~3 MDa) que funciona como un componente integral del filamento grueso en el [[sarcómero]] de las células [[músculo|musculares]]. Se ha propuesto que, en analogía con su función muscular, la [[isoforma]] de la titina que se encuentra en los cromosomas puede funcionar por un lado como una "regla molecular" que determina la longitud cromosómica, y por otro como un "muelle molecular" que proporciona elasticidad a los cromosomas.<ref name=MacHado2000>{{citation
| |
| − | | last1 = MacHado | first1 = C.
| |
| − | | last2 = Andrew | first2 = D.J.
| |
| − | | year = 2000
| |
| − | | title = D-Titin a Giant Protein with Dual Roles in Chromosomes and Muscles
| |
| − | | journal = The Journal of Cell Biology
| |
| − | | volume = 151
| |
| − | | issue = 3
| |
| − | | pages = 639–652
| |
| − | | url = http://www.jcb.org/cgi/content/full/151/3/639
| |
| − | }}</ref>
| |
| | | | |
| − | === El ARN ===
| + | Según la posición del centrómero, los cromosomas se clasifican en: |
| − | El [[ARN]] parece jugar algún papel en el plegamiento del cromosoma eucariótico. Al menos en humanos y en ''Drosophila'' se han encontrado evidencias de este papel estructural del ARN.<ref name=Clemson1996>{{citation
| |
| − | | last = Clemson | first = C.M.
| |
| − | | year = 1996
| |
| − | | title = … X chromosome at interphase: evidence for a novel RNA involved in nuclear/chromosome structure
| |
| − | | journal = The Journal of Cell Biology
| |
| − | | volume = 132
| |
| − | | issue = 3
| |
| − | | pages = 259–275
| |
| − | | url = http://www.jcb.org/cgi/reprint/132/3/259.pdf
| |
| − | }}</ref> Sin embargo, hay que tener en cuenta que el armazón proteico descrito por Laemmli y colaboradores (1977) no se ve afectado por el tratamiento con ARNasa. Podría ser que las propias proteínas del armazón protegieran al ARN de la acción de la ARNasa. En cualquier caso, es conveniente recordar que el ADN del cromosoma bacteriano también está organizado en dominios y que el ARN podría jugar algún papel en el mantenimiento de dicha estructura. En organismos con características intermedias entre las de procariontes y eucariontes como los dinoflagelados, también existen datos que apoyan el papel estructural del ARN en la organización cromosómica.
| |
| | | | |
| − | == Tipos de cromatina ==
| + | ;[[Cromosoma metacéntrico|Metacéntricos]] |
| | + | :El centrómero se localiza a mitad del cromosoma y los dos brazos presentan igual longitud. |
| | + | ;[[Cromosoma submetacéntrico|Submetacéntricos]] |
| | + | :La longitud de un brazo del cromosoma es algo mayor que la del otro. |
| | + | ;[[Cromosoma acrocéntrico|Acrocéntricos]] |
| | + | :Un brazo es muy corto (p) y el otro largo (q). |
| | + | ;[[Cromosoma telocéntrico|Telocéntricos]] |
| | + | :Sólo se aprecia un brazo del cromosoma al estar el centrómero en el extremo. |
| | | | |
| − | La cromatina (la sustancia que compone los núcleos de las células y que resulta de la interacción del ADN con las proteínas histónicas, no histónicas y ARN) puede presentar distintos grados de empaquetamiento o contracción. Cuando los cromosomas se tiñen con sustancias químicas que se unen al ADN aparecen regiones densamente teñidas y regiones menos densamente teñidas. La cromatina mayoritaria, la que constituye la mayor parte del núcleo recibe el nombre de '''eucromatina''' y la minoritaria el de '''heterocromatina'''. Mientras que la eucromatina representa la fracción que contiene la mayor parte de los genes activos, la heterocromatina interviene en varios procesos nucleares, como la función centromérica, el silenciamiento de genes y la organización nuclear.
| + | El par de gonosomas o sexocromosomas se constituyen por X (submetacéntrico mediano) y Y considerado acrocéntrico sin satélites, aunque en algunas revisiones de la literatura se le refiere como submetacéntrico. |
| | | | |
| − | La heterocromatina puede aparecer más densamente teñida que la eucromatina (heteropicnosis positiva) o menos densamente teñida que la eucromatina (heteropicnosis negativa). La aplicación de determinados tratamientos experimentales en combinación con diferentes tipos de tinción de los cromosomas, puede producir la aparición de zonas heterocromáticas en los cromosomas de muchas especies. Estas zonas heterocromáticas presentan una distribución característica o patrón de bandas típico de cada cromosoma, que permite identificar cromosomas distintos. Estas técnicas reciben el nombre de [[#Bandeo cromosómico|"técnicas de bandeo cromosómico"]] y son enormemente útiles en la identificación individual de los cromosomas y en la construcción de cariotipos.
| + | == Tamaño cromosómico == |
| | | | |
| − | === Diferencias entre eucromatina y heterocromatina ===
| + | Los cromosomas sufren grandes variaciones en su tamaño a lo largo del [[Ciclo celular]], pasando de estar muy poco compactados ([[Interfase]]) a estar muy compactados ([[Metafase]]), por tal motivo, los estudios sobre el tamaño suelen realizarse en metafase mitótica. |
| | | | |
| − | * '''Diferencias genéticas:''' los experimentos de construcción de mapas demuestran que la mayor parte de los genes activos se localizan en la eucromatina. En los núcleos interfásicos, la eucromatina se tiñe menos densamente debido al menor grado de empaquetamiento, y en general se acepta que este es el estado más compatible con la actividad génica y la transcripción. La heterocromatina se encuentra en muchos organismos flanqueando las [[centrómero|regiones centroméricas]], algunas veces también se encuentra en [[telómero|regiones teloméricas]], y en algunos casos se ha observado la existencia de cromosomas completos heterocromáticos (por ejemplo, el cromosoma Y de ''Drosophila melanogaster''). Se han detectado muy pocos genes activos en la heterocromatina.<ref name=Elgin1996>{{citation
| + | Además, es necesario tener en cuenta que los tratamientos para teñir los cromosomas y para obtener las metafases mitóticas influyen de manera muy importante en el tamaño de los cromosomas. |
| − | | last = Elgin | first = S.C.R.
| |
| − | | year = 1996
| |
| − | | title = Heterochromatin and gene regulation in Drosophila
| |
| − | | journal = Current Opinion in Genetics & Development
| |
| − | | volume = 6
| |
| − | | issue = 2
| |
| − | | pages = 193–202
| |
| − | | url = http://linkinghub.elsevier.com/retrieve/pii/S0959437X96800505
| |
| − | }}</ref> Por ejemplo, en ''Drosophila'' existen mutaciones letales en genes que se localizan en regiones heterocromáticas; por tanto estos genes deben poseer alguna actividad. En cualquier caso, el porcentaje de genes activos localizados en regiones heterocromáticas es muy bajo, comparado con el de genes activos situados en la eucromatina. La principal diferencia entre la eucromatina y la heterocromatina radica por tanto en la actividad de estos dos tipos de cromatina. Estudios tempranos de la heterocromatina condujeron al descubrimiento del fenómeno conocido como "variegación por efecto de la posición" (PEV, por sus siglas en inglés),<ref name=Lewis1950>{{citation
| |
| − | | last = Lewis | first = E.B.
| |
| − | | year = 1950
| |
| − | | title = The phenomenon of position effect
| |
| − | | journal = Adv Genet
| |
| − | | volume = 3
| |
| − | | pages = 73–115
| |
| − | | doi = 10.1016/S0065-2660(08)60083-8
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/15425389
| |
| − | }}</ref> en el cual si un gen eucromático se coloca cerca o dentro de una región heterocromática, deviene silenciado de forma [[epigenética]]. Este proceso tiene importantes implicaciones en la regulación génica, el envejecimiento y la progresión tumoral.
| |
| | | | |
| − | * '''Diferencias citológicas:''' a nivel estructural, en los núcleos interfásicos, existe un mayor grado de enrollamiento o empaquetamiento en la heterocromatina que en la eucromatina.<ref name=Heitz1928>{{citation
| + | En cualquier caso, en general es posible decir que hay especies eucarióticas con cromosomas grandes y especies con cromosomas pequeños. Las [[Monocotiledóneas]] (vegetales) y los [[Anfibios]] y [[Ortópteros]] (animales) poseen cromosomas muy largos (de 10 a 20 micras). |
| − | | last = Heitz | first = E.
| |
| − | | year = 1928
| |
| − | | title = Das heterochromatin der moose
| |
| − | | journal = Jahrb. Wiss. Botanik
| |
| − | | volume = 69
| |
| − | | pages = 762–818
| |
| − | }}</ref> Esto se demuestra porque la heterocromatina presenta una sensibilidad reducida al tratamiento con [[nucleasa]]s, lo cual refleja un posicionamiento de los nucleosomas a intervalos cortos y regulares.
| |
| | | | |
| − | * '''Diferencias bioquímicas:''' la heterocromatina presenta modificaciones características en las [[histona]]s, como un alto grado de [[metilación]] en la [[lisina]] 9 de la histona H3 (H3K9) y en la lisina 27 (H3K27), combinado con una carencia de [[acetilación]]. La heterocromatina también se caracteriza por la presencia de la proteína '''HP1''' (''heterochromatin protein 1''). Además, la heterocromatina de vertebrados y plantas presenta un elevado grado de metilación en las islas CpG (regiones genómicas ricas en dinucleótidos C+G).<ref name=Grewal2004>{{citation
| + | Las [[Dicotiledóneas]], las [[Algas]], los [[Hongo]]s y la mayoría de las especies animales poseen cromosomas pequeños (longitud inferior a 5 micras). Naturalmente, existen algunas excepciones en los ejemplos citados. El cromosoma 1 humano tiene 0,235 pg de ADN, que equivalen a una longitud total de ADN doble hélice de 7,3 cm y en metafase mitótica presenta una longitud aproximada de 0,001 cm. |
| − | | last1 = Grewal | first1 = S.I.S.
| |
| − | | last2 = Rice | first2 = J.C.
| |
| − | | year = 2004
| |
| − | | title = Regulation of heterochromatin by histone methylation and small RNAs
| |
| − | | journal = Current Opinion in Cell Biology
| |
| − | | volume = 16
| |
| − | | issue = 3
| |
| − | | pages = 230–238
| |
| − | | doi = 10.1016/j.ceb.2004.04.002
| |
| − | | url = http://rosenfeldlab.ucsd.edu/NEU221/publications/Rice%20Regulation%20of%20heterochromatin.pdf
| |
| − | }}</ref> La metilación de H3K9 conlleva el reclutamiento de más enzimas que transfieren grupos metilo a las histonas (HMTs, ''histone methyltransferases''), mediado por HP1. Se han descrito dos rutas diferentes para llevar a cabo este proceso. Una de estas rutas utiliza [[siRNA#Ensamblaje de heterocromatina mediante RNAi en S. pombe|ARN interferente]],<ref name=Volpe2002>{{citation
| |
| − | | last1 = Volpe | first1 = Thomas A.
| |
| − | | last2 = Kidner | first2 = Catherine
| |
| − | | last3 = Hall | first3 = Ira M.
| |
| − | | last4 = Teng | first4 = Grace
| |
| − | | last5 = Grewal | first5 = Shiv I. S.
| |
| − | | last6 = Martienssen | first6 = Robert A.
| |
| − | | year = 2002
| |
| − | | title = Regulation of Heterochromatic Silencing and Histone H3 Lysine-9 Methylation by RNAi
| |
| − | | journal = Science
| |
| − | | volume = 297
| |
| − | | issue = 5588
| |
| − | | pages = 1833–1837
| |
| − | | doi = 10.1126/science.1074973
| |
| − | | url = http://www.icmb.edinburgh.ac.uk/research/institutes/plant/PDF/2002/Volpe-2002-1833.pdf
| |
| − | | pmid = 12193640
| |
| − | }}</ref> mientras que la segunda utiliza proteínas de unión a ADN que reconocen secuencias específicas para dirigir las HMTs.<ref name=Volpe2002>{{citation
| |
| − | | last1 = Volpe | first1 = Thomas A.
| |
| − | | last2 = Kidner | first2 = Catherine
| |
| − | | last3 = Hall | first3 = Ira M.
| |
| − | | last4 = Teng | first4 = Grace
| |
| − | | last5 = Grewal | first5 = Shiv I. S.
| |
| − | | last6 = Martienssen | first6 = Robert A.
| |
| − | | year = 2002
| |
| − | | title = Regulation of Heterochromatic Silencing and Histone H3 Lysine-9 Methylation by RNAi
| |
| − | | journal = Science
| |
| − | | volume = 297
| |
| − | | issue = 5588
| |
| − | | pages = 1833–1837
| |
| − | | doi = 10.1126/science.1074973
| |
| − | | url = http://www.icmb.edinburgh.ac.uk/research/institutes/plant/PDF/2002/Volpe-2002-1833.pdf
| |
| − | | pmid = 12193640
| |
| − | }}</ref>
| |
| | | | |
| − | * '''Alociclia:''' la heterocromatina sigue un ciclo de condensación y descondensación distinto a la eucromatina. La heterocromatina puede aparecer más intensamente teñida que la eucromatina o menos intensamente teñida dependiendo del estado celular (alociclia). La alociclia a su vez está relacionada con la replicación del ADN. La heterocromatina se replica más tarde que la eucromatina.
| + | == Bandeo cromosómico == |
| | | | |
| − | === Tipos de heterocromatina ===
| + | En algunas especies los pares cromosómicos no pueden diferenciarse claramente considerando sólo sus componentes distintivos en sentido longitudinal; en estos casos se debe recurrir a técnicas citológicas especiales para la tinción de los cromosomas, que evidencian "bandas" transversales (oscuras y claras) a lo largo de los mismos, y que corresponden a los distintos tipos de cromatina. |
| − | Se pueden distinguir dos clases de heterocromatina:
| + | |
| − | * '''Heterocromatina constitutiva''': cromatina que aparece siempre más intensamente teñida que la eucromatina (heteropicnosis positiva), o menos intensamente teñida que la eucromatina (heteropicnosis negativa), independientemente del estado de desarrollo o fisiológico. HP1 es esencial para la formación de la heterocromatina constitutiva, que se caracteriza por la presencia de H3K9-trimetilada, mediada por las HMTs denominadas Suv39h1 y Suv39h2.<ref name=Lachner2003>{{citation
| + | En una especie dada, estas variantes de la cromatina presentan un tamaño y disposición constante. Las técnicas de bandeo cromosómico más usadas son: |
| − | | last1 = Lachner | first1 = M.
| + | |
| − | | last2 = O'Sullivan | first2 = R.J.
| + | *Bandeo C : es relativamente sencilla, y se basa en el uso del colorante [[Giemsa]] que tiñe regiones con heterocromatina constitutiva, que en vegetales se halla localizada principalmente en regiones teloméricas, mientras que en animales, se encuentra en regiones centroméricas. |
| − | | last3 = Jenuwein | first3 = T.
| + | *Bandeos G, R, Q : son técnicas basadas en tratamientos enzimáticos que ponen de manifiesto distintos patrones de bandas de la eucromatina a lo largo del cromosoma. El material se tiñe con colorante Giemsa (G, R) ó colorantes fluorescentes, como la [[Quinacrina]] (Q). |
| − | | year = 2003
| |
| − | | title = An epigenetic road map for histone lysine methilation
| |
| − | | journal = Journal of Cell Science
| |
| − | | volume = 116
| |
| − | | issue =
| |
| − | | pages = 2117-2124
| |
| − | | doi = 10.1242/10.1242/jcs.00493
| |
| − | | url = http://jcs.biologists.org/cgi/content/full/116/11/2117
| |
| − | }}</ref> En este grupo se incluyen el [[centrómero#ADN satélite|ADN satélite]] de las regiones centroméricas y la cromatina de los [[telómero]]s.
| |
| − |
| |
| − | * '''Heterocromatina facultativa''': cromatina que aparece más intensamente teñida que la eucromatina, o menos intensamente teñida que la eucromatina dependiendo del estado fisiológico o del momento de desarrollo. El cromosoma X, en algunas especies animales, como el saltamontes ''[[Schistocerca gregaria]]'', aparece más intensamente teñido que el resto de los cromosomas durante la diplotena de la profase I de [[meiosis]]. La heterocromatina facultativa se genera de manera diferente a la constitutiva, posiblemente mediada por HMTs diferentes (como G9a, ESET/SETDB1 y/o ErHMTasa1), y parece ser que presenta sobre todo H3K9-mono y dimetilada.<ref name=Grewal2004 /> | |
| − |
| |
| − | En la especie humana, todos los cromosomas '''X''' que están en exceso de uno aparecen más intensamente teñido que el resto de los cromosomas (''heteropicnosis positiva'') en los núcleos de células en interfase. Por tanto, las mujeres normales que tienen dos cromosomas X, tienen un cromosoma X que aparece más intensamente teñido y que está inactivado. Sin embargo, durante las primeras etapas del desarrollo embrionario (durante los 16 primeros días de gestación en la especie humana) ambos cromosomas X son activos.
| |
| | | | |
| − | En algunas especies eucariontes, el ADN satélite o ADN minoritario que presenta un contenido en G+C distinto al ADN principal o mayoritario, está constituido por unas secuencias cortas de ADN que están repetidas millones de veces. En concreto en ratón se ha demostrado que el [[centrómero#ADN satélite|ADN satélite]] está localizado en la zona centrómerica. Este ADN satélite constituye un ejemplo de heterocromatina constitutiva cuya presencia y acción es constante en el cromosoma.<ref name=Hennig1999>{{citation
| + | Son las bandas más estudiadas en animales y en el hombre. En los vegetales son muy difíciles de obtener por el alto grado de empaquetamiento de los cromosomas metafásicos. |
| − | | last = Hennig | first = W.
| |
| − | | year = 1999
| |
| − | | title = Heterochromatin
| |
| − | | journal = Chromosoma
| |
| − | | volume = 108
| |
| − | | issue = 1
| |
| − | | pages = 1–9
| |
| − | | doi = 10.1007/s004120050346
| |
| − | | url = http://www.springerlink.com/index/6JH5GH0KXYG8HE3J.pdf
| |
| − | }}</ref><ref name=Craig2005>{{citation
| |
| − | | last = Craig | first = J.M.
| |
| − | | year = 2005
| |
| − | | title = Heterochromatin-many flavours, common themes
| |
| − | | journal = BioEssays
| |
| − | | volume = 27
| |
| − | | issue = 1
| |
| − | | pages = 17–28
| |
| − | | doi = 10.1002/bies.20145
| |
| − | | url = http://www.uam.es/personal_pdi/ciencias/genhum/bibliogenoma/heterochromatinreview2005.pdf
| |
| − | }}</ref>
| |
| | | | |
| − | == Elementos diferenciados en la estructura cromosómica ==
| + | *Bandeo NOR : permite identificar cromatina con secuencias medianamente repetidas de ADNr, asociada a las regiones NOR del cromosoma. El número total y localización de las regiones NOR es variable, por lo cual, como ya se expresó, además de su importancia funcional tiene valor cariotípico.<ref name="UNCOR" /> |
| − | La organización de la cromatina no es uniforme a lo largo de la estructura del cromosoma. De hecho, se pueden distinguir una serie de elementos diferenciados: los [[centrómero]]s (o constricciones primarias), los [[telómero]]s (o extremos cromosómicos), las [[regiones organizadoras del nucléolo]] (NORs según la abreviatura en inglés) y los [[cromómero]]s, todos ellos caracterizados por contener secuencias específicas de ADN.<ref name="Piqueras" />
| |
| | | | |
| − | === Centrómeros === | + | == Técnica de estudio == |
| | | | |
| − | El '''centrómero''' es la constricción primaria que, utilizando tinciones tradicionales, aparece menos teñida que el resto del cromosoma. Es la zona por la que el cromosoma interacciona con las fibras del [[huso acromático]] desde profase hasta anafase, tanto en [[mitosis]] como en [[meiosis]], y es responsable de realizar y regular los movimientos cromosómicos que tienen lugar durante estas fases. Las estructuras centroméricas que interaccionan con las fibras del huso se denominan [[cinetocoro]]s. Además, el centrómero contribuye a la nucleación de la cohesión de las [[cromátida]]s hermanas. En la estructura del centrómero intervienen tanto el ADN centromérico, que consta fundamentalmente de heterocromatina constitutiva, como proteínas centroméricas.
| + | Es posible visualizar los cromosomas por medio de la [[Microscopía de luz]] y de tinciones especiales. El proceso para obtener el material cromosómico se realiza en diversos pasos, que incluyen la obtención de una muestra viva, la siembra e incubación de la misma y la posterior tinción y lectura. |
| | | | |
| − | En la levadura de gemación (''[[Saccharomyces cerevisiae]]'') el ADN centromérico consta únicamente de 125 pb y está conservado entre los diferentes cromosomas.<ref name=Fitzgerald-hayes1982>{{citation
| + | == Tipos especiales de cromosomas == |
| − | | last1 = Fitzgerald-hayes | first1 = M.
| |
| − | | last2 = Clarke | first2 = L.
| |
| − | | last3 = Carbon | first3 = J.
| |
| − | | year = 1982
| |
| − | | title = Nucleotide sequence comparisons and functional analysis of yeast centromere DNAs
| |
| − | | journal = Cell
| |
| − | | volume = 29
| |
| − | | issue = 1
| |
| − | | pages = 235–44
| |
| − | | doi = 10.1016/0092-8674(82)90108-8
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/7049398
| |
| − | }}</ref> Sin embargo, el ADN centromérico en [[metazoos]] puede constar de megabases, y no contiene secuencias consenso fácilmente identificables (ver la revisión de Choo en 1997<ref name=Choo1997>{{Citation
| |
| − | | last = Choo | first = K.H.A.
| |
| − | | year = 1997
| |
| − | | title = The centromere
| |
| − | | url = http://books.google.co.uk/books?id=qFXPXQx9LA0C&printsec=frontcover&dq=the+centromere
| |
| − | }}</ref>). A pesar de las diferencias entre el ADN centromérico de levaduras y metazoos, el [[cinetocoro]] se ensambla en ambos casos sobre nucleosomas centroméricos que contienen una forma especializada de [[histona]] H3 (Cse4p en levaduras<ref name=Meluh1998>{{citation
| |
| − | | last1 = Meluh | first1 = P.B.
| |
| − | | last2 = Yang | first2 = P.
| |
| − | | last3 = Glowczewski | first3 = L.
| |
| − | | last4 = Koshland | first4 = D.
| |
| − | | last5 = Smith | first5 = M.M.
| |
| − | | year = 1998
| |
| − | | title = Cse 4 P is a Component of the Core Centromere of Saccharomyces Cerevisiae
| |
| − | | journal = Cell(Cambridge)
| |
| − | | volume = 94
| |
| − | | issue = 5
| |
| − | | pages = 607–613
| |
| − | | url = http://cat.inist.fr/?aModele=afficheN | |
| − | }}</ref> o su homólogo CENP-A en metazoos).
| |
| | | | |
| − | === Telómeros ===
| + | Existen algunos tipos de cromosomas presentes sólo en algunos tipos celulares o en poblaciones concretas de una [[Especie]]. Entre ellos, destacan los [[Cromosoma politénico|cromosomas politénicos]], en [[Cromosoma en escobilla|escobilla]], [[Cromosoma B|cromosomas B]] e [[Isocromosoma]]s. |
| | | | |
| − | La palabra telómero procede del griego ''telos'', "final" y ''meros'', "parte". Los '''telómeros''' son los extremos de los cromosomas. Son regiones de [[ADN]] no codificante, altamente repetitivas, cuya función principal es la estabilidad estructural de los cromosomas en las [[célula]]s [[eucariota]]s, la división celular y el tiempo de vida de las estirpes celulares. Además están involucradas en enfermedades tan importantes como el [[cáncer]]. En los organismos procariotes, los cromosomas son circulares y no poseen telómeros.<ref name=Kurenova1997>{{citation
| + | == Cromosomas politénicos == |
| − | | last1 = Kurenova | first1 = E.V.
| |
| − | | last2 = Mason | first2 = J.M.
| |
| − | | year = 1997
| |
| − | | title = Telomere functions. A review
| |
| − | | journal = Biochemistry (Mosc)
| |
| − | | volume = 62
| |
| − | | issue = 11
| |
| − | | pages = 1242–53 | |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/9467848
| |
| − | }}</ref>
| |
| | | | |
| − | Los telómeros fueron descubiertos por [[Hermann Joseph Muller]] durante la década de los años 30. Desde entonces, se ha avanzado mucho en el conocimiento de los telómeros, gracias a las técnicas de la genética molecular.
| + | Las células de las glándulas salivares de los [[Insecto]]s del orden de los [[Dípteros]] presentan [[Núcleo celular|núcleos]] que se hallan en una interfase permanente. Durante el crecimiento y desarrollo de las larvas de estos insectos, la división celular se detiene en algunos tejidos pero las células continúan su crecimiento por incremento de volumen. |
| | | | |
| − | {| class=wikitable BORDER="1"
| + | Este proceso ocurre, por ejemplo, en los [[Tubo de Malpighi|tubos de Malpighi]], en las células nutricias de los [[Ovario]]s, en el epitelio intestinal y en las células de las glándulas salivares. En las células de tejidos mencionados, los cromosomas sufren rondas repetidas de duplicaciones pero sin separarse, proceso conocido como [[Endomitosis]]. Esto lleva a la producción de cromosomas constituidos por varios cientos o aún miles de hebras. |
| − | |+ '''Algunas secuencias conocidas de telómeros'''
| |
| − | |-
| |
| − | ! Grupo
| |
| − | ! Organismo
| |
| − | ! Secuencia del telómero (Dirección 5'a 3' hasta el fin)
| |
| − | |-
| |
| − | | [[Vertebrado]]s
| |
| − | | [[Humano]]s, [[mus musculus|ratón]], ''[[Xenopus laevis|Xenopus]]''
| |
| − | | TTAGGG
| |
| − | |-
| |
| − | | [[Hongo]]s filamentosos
| |
| − | | ''[[Neurospora crassa]]''
| |
| − | | TTAGGG
| |
| − | |-
| |
| − | | [[Moho]]s del fango
| |
| − | | ''[[Physarum]]'', ''[[Didymium]]''<br />''[[Dictyostelid|Dictyostelium]]''
| |
| − | | TTAGGG<br />AG(1-8)
| |
| − | |-
| |
| − | | [[Protozoo]]s cinetoplástidos
| |
| − | | ''[[Trypanosoma]]'', ''[[Crithidia]]''
| |
| − | | TTAGGG
| |
| − | |-
| |
| − | | Protozoos ciliados
| |
| − | | ''[[Tetrahymena]]'', ''[[Glaucoma (ciliate)|Glaucoma]]''<br />''[[Paramecium]]''<br />''[[Oxytricha]]'', ''[[Stylonychia]]'', ''[[Euplotes]]''
| |
| − | | TTGGGG<br />TTGGG(T/G)<br />TTTTGGGG
| |
| − | |-
| |
| − | | Protozoos apicomplexa
| |
| − | | ''[[Plasmodium]]''
| |
| − | | TTAGGG(T/C)
| |
| − | |-
| |
| − | | [[Planta]]s superiores
| |
| − | | ''[[Arabidopsis thaliana]]''
| |
| − | | TTTAGGG
| |
| − | |-
| |
| − | | [[Alga]]s verdes
| |
| − | | ''[[Chlamydomonas]]''
| |
| − | | TTTTAGGG
| |
| − | |-
| |
| − | | [[Insecto]]s
| |
| − | | ''[[Bombyx mori]]''
| |
| − | | TTAGG
| |
| − | |-
| |
| − | | [[Ascárido]]s
| |
| − | | ''[[Ascaris lumbricoides]]''
| |
| − | | TTAGGC
| |
| − | |-
| |
| − | | [[Levadura]]s aisladas
| |
| − | | ''[[Schizosaccharomyces pombe]]''
| |
| − | | TTAC (A)(C) G(1-8)
| |
| − | |-
| |
| − | | Levaduras agregadas
| |
| − | | ''[[Saccharomyces cerevisiae]]''<br /><br />
| |
| − | ''[[Candida glabrata]]''<br />
| |
| − | ''[[Candida albicans]]''<br />
| |
| − | ''[[Candida tropicalis]]''<br />
| |
| − | ''[[Candida maltosa]]''<br />
| |
| − | ''[[Candida guillermondii]]''<br />
| |
| − | ''[[Candida pseudotropicalis]]''<br />
| |
| − | ''[[Kluyveromyces lactis]]''
| |
| − | | TGTGGGTGTGGTG (de copias de ARN)<br />
| |
| − | or G(2-3)(TG)(1-6)T (consenso)<br />
| |
| − | GGGGTCTGGGTGCTG<br />
| |
| − | GGTGTACGGATGTCTAACTTCTT<br />
| |
| − | GGTGTA[C/A]GGATGTCACGATCATT<br />
| |
| − | GGTGTACGGATGCAGACTCGCTT<br />
| |
| − | GGTGTAC<br />
| |
| − | GGTGTACGGATTTGATTAGTTATGT<br />
| |
| − | GGTGTACGGATTTGATTAGGTATGT<br />
| |
| − | |}
| |
| | | | |
| − | === Regiones organizadoras del nucléolo ===
| + | Durante este proceso de politenización o [[Politenia]], los cromosomas incrementan tanto su longitud como su diámetro. De hecho, la longitud de los cromosomas de ''Drosophila'' en una metafase es del orden de 7,5 µm mientras que el largo total de los cromosomas en un núcleo de las glándulas salivares es de alrededor de 2.000 µm.<ref name="Panzera" /> |
| − | Además de las constricciones primarias, en algunos cromosomas se puede distinguir otro tipo de "adelgazamiento" denominada ''constricción secundaria'', las que se hallan relacionadas normalmente con la presencia de las secuencias de [[ADN ribosómico]]. Tales regiones se denominan "[[regiones organizadoras del nucléolo]]" (o, sencillamente, "NORs" por el acrónimo en inglés para ''nucleolus organizer regions''). Las secuencias de ADN ribosómico quedan englobadas dentro del [[nucléolo]], que permanece adosado a las NORs durante buena parte del [[ciclo celular]].<ref name="Piqueras" /> Los cromosomas con NOR en muchos casos presentan un segmento que une a esta región con el telómero, el cual se denomina ''satélite'' o ''trabante''.<ref name=Panzera />
| |
| | | | |
| − | === Cromómeros ===
| + | Además del cambio en el tamaño, los cromosomas politénicos presentan otras dos características. En primer lugar, los cromosomas homólogos están asociados entre sí en toda su extensión. Esta condición, denominada ''apareamiento somático'' es propia de la mitosis de la mayoría de los Dípteros. |
| − | Los cromómeros son "engrosamientos" o regiones más compactadas de la eucromatina, que se distribuyen de manera más o menos uniforme a lo largo de los cromosomas y se pueden visualizar durante las fases de la mitosis o de la meiosis de menor condensación de la cromatina (profase). Su naturaleza molecular sigue siendo controvertida, pero podrían ser consecuencia de un cierto grado de compartimentalización en la distribución de las secuencias de ADN y en la organización de los cromosomas. Desde hace varios años, el grupo de Giorgio Bernardi en Italia, sostiene que hay una distribución compartimentalizada de secuencias relativamente grandes de ADN (llamadas "isócoras") en el genoma de los [[vertebrado]]s de sangre caliente, de modo tal que cada isócora tiene un contenido en bases (porcentaje de C+G) relativamente homogéneo pero diferente al de las demás.<ref name=Saccone2002>{{citation
| |
| − | | last1 = Saccone | first1 = S.
| |
| − | | last2 = Federico | first2 = C.
| |
| − | | last3 = Andreozzi | first3 = L.
| |
| − | | last4 = D�antoni | first4 = S.
| |
| − | | last5 = Bernardi | first5 = G.
| |
| − | | last6 = Molecolare | first6 = E.
| |
| − | | last7 = Zoologica | first7 = S.
| |
| − | | last8 = Slota | first8 = E.
| |
| − | | last9 = Czech | first9 = B.D.
| |
| − | | year = 2002
| |
| − | | title = Chromosome structure
| |
| − | | journal = Chromosome Research
| |
| − | | volume = 10
| |
| − | | issue = 1
| |
| − | | pages = 1–50
| |
| − | | url = http://www.ingentaconnect.com/content/klu/chro/2002/00000010/A00100s1/05093457
| |
| − | }}</ref><ref name=Bernardi1989>{{citation
| |
| − | | last = Bernardi | first = G.
| |
| − | | year = 1989
| |
| − | | title = The Isochore Organization of the Human Genome
| |
| − | | journal = Annual Reviews in Genetics
| |
| − | | volume = 23
| |
| − | | issue = 1
| |
| − | | pages = 637–659
| |
| − | | doi = 10.1146/annurev.ge.23.120189.003225
| |
| − | }}</ref><ref name=Saccone2001>{{citation
| |
| − | | last1 = Saccone | first1 = S.
| |
| − | | last2 = Bernardi | first2 = G.
| |
| − | | year = 2001
| |
| − | | title = Human chromosomal banding by in situ hybridization of isochores
| |
| − | | journal = Methods in Cell Science
| |
| − | | volume = 23
| |
| − | | issue = 1
| |
| − | | pages = 7–15
| |
| − | | doi = 10.1023/A:1013173011458
| |
| − | | url = http://www.springerlink.com/index/Q2L7291Q17478J87.pdf
| |
| − | }}</ref><ref name=Bernardi1995>{{citation
| |
| − | | last = Bernardi | first = G.
| |
| − | | year = 1995
| |
| − | | title = The Human Genome: Organization and Evolutionary History
| |
| − | | journal = Annual Reviews in Genetics
| |
| − | | volume = 29
| |
| − | | issue = 1
| |
| − | | pages = 445–476
| |
| − | | doi = 10.1146/annurev.ge.29.120195.002305
| |
| − | }}</ref> Después de publicado el primer borrador del "[[Proyecto Genoma Humano]]", parece confirmarse la existencia de cinco isócoras en el genoma de los humanos, dos de ellas ricas en A y T, y tres ricas en G y C. La distribución alternante de ambos tipos de isócoras podría ser la explicación molecular de la existencia de cromómeros.<ref name=Costantini2006>{{citation
| |
| − | | last1 = Costantini | first1 = M.
| |
| − | | last2 = Clay | first2 = O.
| |
| − | | last3 = Auletta | first3 = F.
| |
| − | | last4 = Bernardi | first4 = G.
| |
| − | | year = 2006
| |
| − | | title = An isochore map of human chromosomes
| |
| − | | journal = Genome Research
| |
| − | | volume = 16
| |
| − | | issue = 4
| |
| − | | pages = 536–541
| |
| − | | doi = 10.1101/gr.4910606
| |
| − | | url = http://www.genome.org/cgi/content/full/16/4/536
| |
| − | }}</ref><ref name=Bernardi2000>{{citation
| |
| − | | last = Bernardi | first = G.
| |
| − | | year = 2000
| |
| − | | title = Isochores and the evolutionary genomics of vertebrates
| |
| − | | journal = Gene
| |
| − | | volume = 241
| |
| − | | issue = 1
| |
| − | | pages = 3–17
| |
| − | | doi = 10.1016/S0378-1119(99)00485-0
| |
| − | | url = http://www.iubs.org/newiubs/products/bioint/BioInt%20PDF1/BI%20Regular%20Issues/BI%20Numero%2041.pdf#page=99
| |
| − | }}</ref>
| |
| | | | |
| − | == Estructura externa de los cromosomas: número, forma y tamaño ==
| + | La otra característica peculiar es que los cromosomas muestran un patrón particular de bandeo transversal que consiste en zonas más oscuras, llamadas ''bandas'', que alternan con zonas claras, llamadas ''interbandas''. Cuando se observan al microscopio óptico se identifican como bandas oscuras y claras transversales alternantes. |
| | | | |
| − | El estudio de la estructura externa de los cromosomas de cualquier especie eucariótica consiste en analizar la forma, tamaño y número de los cromosomas que posee. El mejor momento para llevar a cabo dicho estudio suele ser aquel en el que los cromosomas han alcanzado su máximo grado de contracción y tienen sus bordes perfectamente definidos. Dicho momento suele ser la [[metafase]] mitótica. El estudio de la estructura externa de los cromosomas culmina con la obtención del [[cariotipo]].<ref name = "UNCOR">Facultad de Ciencias Agropecuarias. Universidad Nacional de Córdoba (Argentina). Genética. Capítulo 2. Forma y tamaño cromosómico. Cariotipo. [http://www.agro.uncor.edu/~genetica/CAPIS2.pdf]</ref>
| + | Aunque la mayoría de las bandas son continuas a través del cromosoma, otras aparecen como una serie de puntos. Éste bandeo es reproducible de núcleo a núcleo, formando un patrón constante de tal manera que los cromosomas pueden ser identificados y mapeados en toda su longitud. Hay aproximadamente 5000 bandas y 5000 interbandas en total en el genoma de ''Drosophila melanogaster''. |
| − | Los cromosomas se pueden estudiar en distintos momentos según la especie y dependiendo de los objetivos planteados. Algunas especies tienen cromosomas que se pueden observar con gran detalle en [[interfase]], tal es el caso de ''Drosophila melanogaster'', que posee [[cromosoma politénico|cromosomas politénicos]] gigantes que se observan en las glándulas salivales de dicho insecto, y el de ''[[Chironomus tentans]]'', otro díptero. El cariotipo se confecciona usualmente después de un apropiado pre-tratamiento y tinción de las células, para hacer más visibles los cromosomas individuales. Al diagrama simplificado de los cromosomas metafásicos del cariotipo se lo denomina [[idiograma]], que se construye con el [[número genómico]].
| |
| − | Para realizar el ordenamiento de los cromosomas tanto en cariotipos como idiogramas se debe tener en cuenta el tamaño cromosómico (ubicados de mayor a menor, con el brazo corto “bc” o "p" hacia arriba y el brazo largo “bl” o "q" hacia abajo); posición del centrómero (generalmente alineados) y presencia de constricciones secundarias y satélites.<ref name = "UNCOR" />
| |
| | | | |
| − | === Constancia del número de cromosomas ===
| + | Debido a que el patrón de bandeo que presentan los cromosomas politénicos es un reflejo constante de las secuencias de ADN, las bandas sirven como marcadores para localizar varias características genéticas (lugar de los genes, o cambios en el genoma debido a reordenamientos cromosómicos, por ejemplo deleciones, duplicaciones de bandas y translocaciones) y se han utilizado en diversos estudios genéticos y evolutivos.<ref name="Gunderina2005b">Gunderina, L. I. (2005) Divergence patterns of banding sequences in different polytene chromosome arms reflect relatively independent evolution of different genome components. Russian Journal of Genetics 41(4)</ref> |
| − | {| border="1" cellpadding="4" cellspacing="0" style="float:right; margin: 1em 0 1em 1em; background: #f9f9f9; border: 1px #aaa solid; border-collapse: collapse; font-size: 0.95em; line-height: 0.9em"
| |
| − | |+ style="line-height: 1.2em" | '''Números de cromosomas en<br />diferentes especies'''
| |
| − | |- style="line-height: 1.2em"
| |
| − | ! Especie !! Número de<br />cromosomas
| |
| − | |-
| |
| − | | [[Hormiga]] ''[[Myrmecia pilosula]]'', macho|| align="right" | 1
| |
| − | |-
| |
| − | | [[Hormiga]] ''[[Myrmecia pilosula]]'', hembra || align="right" | 2
| |
| − | |-
| |
| − | |[[Drosophila melanogaster|Mosca de la fruta]] (''Drosophila melanogaster'')|| align="right" | 8
| |
| − | |-
| |
| − | | [[Centeno]] (''Secale cereale'')|| align="right" | 14
| |
| − | |-
| |
| − | | [[Caracol]] (''Helix'')|| align="right" | 24
| |
| − | |-
| |
| − | | [[Gato]] (''Felis silvestris catus'')|| align="right" | 38
| |
| − | |-
| |
| − | | [[Cerdo]] (''Sus scrofa'')|| align="right" | 40
| |
| − | |-
| |
| − | | [[Ratón]] (''Mus musculus'')|| align="right" | 40
| |
| − | |-
| |
| − | | [[Trigo]] (''Triticum aestivum'')|| align="right" | 42
| |
| − | |-
| |
| − | | [[Rata]] (''Rattus rattus'')|| align="right" | 42
| |
| − | |-
| |
| − | | [[Conejo]] (''Oryctolagus cuniculus'')|| align="right" | 44
| |
| − | |-
| |
| − | | [[Liebre]] (''Lepus europaeus'')|| align="right" | 46
| |
| − | |-
| |
| − | | [[Humano]] (''Homo sapiens sapiens'')|| align="right" | 46
| |
| − | |-
| |
| − | | [[Chimpancé]] (''Pan troglodytes'')|| align="right" | 48
| |
| − | |-
| |
| − | | [[Patata]], Papa (''Solanum tuberosum'')|| align="right" | 48
| |
| − | |-
| |
| − | | [[Oveja]] (''Ovis aries'')|| align="right" | 54
| |
| − | |-
| |
| − | | [[Vaca]] (''Bos taurus'')|| align="right" | 60
| |
| − | |-
| |
| − | | [[Asno]] (''Equus asinus'')|| align="right" | 62
| |
| − | |-
| |
| − | | [[Mula]] (''Equus mulus'')|| align="right" | 63 (estéril)
| |
| − | |-
| |
| − | | [[Caballo]] (''Equus caballus'')|| align="right" | 64
| |
| − | |-
| |
| − | | [[Camello]] ('' [[Camelus bactrianus]]'')|| align="right" | 74
| |
| − | |-
| |
| − | | [[Llama]] (''Lama glama'')|| align="right" | 74
| |
| − | |-
| |
| − | | [[Perro]] (''Canis lupus familiaris'')|| align="right" | 78
| |
| − | |-
| |
| − | | [[Gallina]] (''Gallus gallus'')|| align="right" | 78
| |
| − | |-
| |
| − | | [[Paloma]] ''[[Columbia livia]]''|| align="right" | 80
| |
| − | |-
| |
| − | | Pez ''[[Carassius auratus]]''|| align="right" | 94
| |
| − | |-
| |
| − | | [[Mariposa]] || align="right" | ~380
| |
| − | |-
| |
| − | | [[Helecho]] ''[[Ophioglussum reticulatum]]'' || align="right" | 1260
| |
| − | |-
| |
| − | | [[Protozoario]] ''[[Aulacantha scolymantha]]'' || align="right" | 1600
| |
| − | |}
| |
| | | | |
| − | Usualmente las especies animales y vegetales tienen un número de cromosomas constante y determinado que constituyen su [[cariotipo]] (ley de la constancia numérica de los cromosomas), aunque existen especies con una alta variabilidad cariotípica, no sólo en número sino en forma y tamaño de los cromosomas.
| + | En ''[[Drosophila melanogaster|D. melanogaster]]'' el patrón de bandeo no se distingue en aquellas regiones heterocromáticas presentes en región centromérica de todos sus cromosomas (n=4). Las regiones heterocromáticas están asociadas formando un ''cromocentro''. |
| | | | |
| | + | Ya que dos miembros del complemento haploide de esta especie son metacéntricos (los cromosomas II y III) y dos son acrocéntricos (cromosoma sexual X o Y y el cromosoma IV), los cromosomas politénicos en esta especie aparecen como cinco brazos desiguales que irradian del cromocentro: un brazo correspondiente al cromosoma X, los dos brazos del cromosoma II y los dos brazos del cromosoma III (3L y 3R). |
| | | | |
| − | El número de cromosomas de una especie (o fase vital) diploide se identifica como ''2n'' mientras que ese número en una especie (o fase vital) haploide se identifica con la letra ''n''. En aquellas especies que presentan un número repetido de cromosomas superior a dos complementos se habla de [[poliploidía]], representándose el múltiplo por delante de la letra ''n''. Así: ''3n'' indicaría un complemento cromosómico triploide, ''4n'' un tetraploide, etc. Todas estas son situaciones de [[euploidía]]. Con la indicación ''x'' se quiere expresar el número básico de cromosomas de una especie que presenta individuos con diversos grados de ''ploidía'' o el de una línea filogenética a partir de la cual diversos taxones han alcanzado situaciones aneuploides variadas, siendo en este caso el número cromosómico una variación del número original con aumento o disminución del número básico, por pérdida, fusión o división de cromosomas (p. ej., n+1 o n-1). Un ejemplo de esta situación anormal la tenemos en los individuos de la especie humana que presentan el llamado [[síndrome de Down]], situación de [[aneuploidía]] (2n=47) por la presencia de un ejemplar más de lo habitual del cromosoma 21 (trisomía).
| + | En algunos casos se puede visualizar un sexto brazo muy pequeño que representa el cromosoma IV.<ref name="Panzera">Panzera, F., Ruben Pérez y Yanina Panzera. [http://www.fcv.unlp.edu.ar/sitios-catedras/87/material/Bandeos%20Cromosomicos.pdf Identificación cromosómica, cariotipo]. Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata.</ref> |
| | | | |
| − | El número de cromosomas 2n varía mucho de unas especies a otras y no existe relación entre el número de cromosomas y la complejidad de los mismos: existen especies vegetales con pocos cromosomas como ''[[Haplopappus gracilis]]'' (2n=4), ''[[Crepis capillaris]]'' (2n=6) y ''[[Secale cereale]]'' (2n=14) , especies vegetales con bastantes cromosomas como ''[[Triticum aestivum]]'' (2n=42) y especies vegetales con muchos cromosomas como ''[[Ophioglossum petiolatum]]'' (n >500). En animales sucede algo semejante, hay especies con pocos cromosomas como la hormiga australiana ''[[Myrmecia pilosula]]'' cuyos machos tienen un cromosoma (2n=1) y las hembras dos cromosomas (2n=2), especies con bastantes cromosomas como la humana ''[[Homo sapiens]]'' (2n=46) y especies con muchos cromosomas como el lepidóptero ''[[Lysandra atlantica]]'' (2n=434-466). No existe ninguna relación entre el número de cromosomas 2n y la complejidad evolutiva, ni entre el número de cromosomas y la cantidad de ADN. Un ejemplo claro de esta situación es el de los ciervos del género ''[[Muntiacus]]'' en el que hay especies muy similares (denominadas [[especies gemelas]]) una con 2n=6 (''M. muntjak'') y otra con 2n=46 (''M. reevesi'').<ref name = "Wurster ">Doris H. Wurster and Kurt Benirschke.1970. [http://www.sciencemag.org/cgi/content/abstract/168/3937/1364 Indian Momtjac, ''Muntiacus muntiak'': A Deer with a Low Diploid Chromosome Number]. Science 12 June 1970: Vol. 168. no. 3937, pp. 1364 - 1366.</ref><ref name = "McClintock">McClintock, B. (1984). The significance of responses of the genome to challenge. Science 226, 792-801.</ref>
| + | == Cromosomas en escobilla == |
| | | | |
| − | === Cromosomas sexuales === | + | Los cromosomas en escobilla (también llamados ''cromosomas plumosos''), observados por primera vez por [[Walther Flemming]] en 1882 en oocitos de salamandra ''([[Ambystoma mexicanum]])'',<ref name="Flemming">Flemming W. 1882. Zellsubstanz, Kern- und Zelltheilung. Vogel, Leipzig.</ref> son uno de los tipos de cromosomas más grandes y se hallan en los [[Oocito]]s de la mayoría de los animales, exceptuando a los mamíferos. |
| − | En muchos organismos, uno de los pares de los cromosomas homólogos es distinto al resto, realizando la determinación del sexo del individuo. A estos cromosomas se les llama cromosomas sexuales o heterocromosomas e incluso gonosomas, porque determinan el [[identidad sexual|sexo]].
| |
| | | | |
| − | * '''Sistema de determinación XY''': es propio del ser humano y muchos otros animales. Las [[hembra]]s, siendo XX, darán [[gameto]]s iguales con [[cromosoma X]], sexo homogamético y los machos, siendo XY, darán dos tipos de gametos, uno con el cromosoma X y otro con el [[cromosoma Y]]. La probabilidad de que en la [[fecundación]], al unirse los gametos, resulte una combinación XX (hembra) o XY (macho) es aproximadamente del 50%.
| + | Se hallan durante el estadio de la [[Meiosis]] I denominado [[Diploteno]]. Luego de este relativamente largo período de la meiosis I, los cromosomas en escobilla vuelven a compactarse durante el período de [[Metafase]] I. Son estructuras transitorias, específicamente [[Bivalente]]s (es decir, dos cromosomas apareados cada uno de los cuales está formado por dos cromátidas hermanas). |
| − | * '''Sistema de determinación ZW''': en otras especies (mariposas, p.e.) ocurre lo contrario, el sexo masculino es homogamético (ZZ) y el femenino heterogamético (ZW).
| |
| − | * '''Sistema de determinación XO''': otras especies (peces, insectos, anfibios) que no tienen el cromosoma Y, determinándose el sexo por el número de cromosomas X, macho XO y hembra XX.
| |
| | | | |
| − | === Forma de los cromosomas ===
| + | Cada uno de los dos cromosomas está constituido por dos largas hebras que forman muchos "rulos" o "bucles", a la manera de un cepillo o escobilla, a lo largo del eje mayor del cromosoma. Esos "rulos" permiten que el ADN se halle disponible para el proceso de transcripción durante la maduración del ovocito. |
| | | | |
| − | La forma de los cromosomas es para todas las células somáticas constante y característica de cada especie. La forma depende fundamentalmente de las constricciones que presente el cromosoma y de su localización en la cromátida.
| + | De hecho, la presencia de cromosomas en escobilla en una célula es indicador de que está ocurriendo la transcripción del [[ARN mensajero]].<ref name="Macgregor">Macgregor, H. [http://projects.exeter.ac.uk/lampbrush/intro.htm ''Lampbrush chromosomes'' ]. School of Biosciences, University of Exeter.</ref>. |
| | | | |
| − | El cromosoma se encuentra constituido básicamente por el centrómero que divide el cromosoma en un brazo corto o brazo p y un brazo largo o brazo q. Algunos cromosomas presentan satélites en el brazo corto. | + | El nombre de "cromosomas en escobilla" ("lampbrush chromosome") fue acuñado por J. Rückert en 1892,<ref>Rückert, J. 1892. Zur Entwicklungsgeschichte des Ovarialeies bei Selachiern. Anat Anz 7: 107-158.</ref> quien asimiló la forma de estos cromosomas a un cepillo del siglo XIX, bastante equivalente a o que actualmente se denomina "[[Limpiatubo]]s".<ref name="Macgregor" /> |
| | | | |
| − | Según la posición del centrómero, los cromosomas se clasifican en:
| + | == Cromosomas B == |
| − | ;[[Cromosoma metacéntrico|Metacéntricos]]
| |
| − | :El centrómero se localiza a mitad del cromosoma y los dos brazos presentan igual longitud.
| |
| − | ;[[Cromosoma submetacéntrico|Submetacéntricos]]
| |
| − | :La longitud de un brazo del cromosoma es algo mayor que la del otro.
| |
| − | ;[[Cromosoma acrocéntrico|Acrocéntricos]]
| |
| − | :Un brazo es muy corto (p) y el otro largo (q).
| |
| − | ;[[Cromosoma telocéntrico|Telocéntricos]]
| |
| − | :Sólo se aprecia un brazo del cromosoma al estar el centrómero en el extremo.
| |
| | | | |
| − | El par de gonosomas o sexocromosomas se constituyen por X (submetacéntrico mediano) y Y considerado acrocéntrico sin satélites, aunque en algunas revisiones de la literatura se le refiere como submetacéntrico.
| + | La mayoría de los organismos son habitualmente muy poco tolerantes a la adición o pérdida de material cromosómico, incluso en cantidades ínfimas. Así, alteraciones cromosómicas como las deleciones, duplicaciones y [[Aneuploidía]]s (el exceso o defecto respecto al número cromosómico normal en una [[Especie]] dada) provocan en el individuo afectado desde malformaciones hasta inviabilidad en diferentes niveles del desarrollo. |
| | | | |
| − | === Tamaño cromosómico ===
| + | Sin embargo, una excepción a este hecho en muchas especies animales y vegetales consiste en la existencia de cromosomas supernumerarios o cromosomas B. La distinción entre cromosomas B y los del complemento normal (cromosomas A) fue realizada por primera vez por Randolph en [[1928]]. |
| − | Los cromosomas sufren grandes variaciones en su tamaño a lo largo del [[ciclo celular]], pasando de estar muy poco compactados ([[interfase]]) a estar muy compactados ([[metafase]]), por tal motivo, los estudios sobre el tamaño suelen realizarse en metafase mitótica. Además, es necesario tener en cuenta que los tratamientos para teñir los cromosomas y para obtener las metafases mitóticas influyen de manera muy importante en el tamaño de los cromosomas. En cualquier caso, en general es posible decir que hay especies eucarióticas con cromosomas grandes y especies con cromosomas pequeños. Las [[monocotiledóneas]] (vegetales) y los [[anfibios]] y [[ortópteros]] (animales) poseen cromosomas muy largos (de 10 a 20 micras). Las [[dicotiledóneas]], las [[algas]], los [[hongos]] y la mayoría de las especies animales poseen cromosomas pequeños (longitud inferior a 5 micras). Naturalmente, existen algunas excepciones en los ejemplos citados. El cromosoma 1 humano tiene 0,235 pg de ADN, que equivalen a una longitud total de ADN doble hélice de 7,3 cm y en metafase mitótica presenta una longitud aproximada de 0,001 cm.
| |
| | | | |
| − | === Bandeo cromosómico ===
| + | En general, los cromosomas accesorios presentan las siguientes características: |
| − | En algunas especies los pares cromosómicos no pueden diferenciarse claramente considerando sólo sus componentes distintivos en sentido longitudinal; en estos casos se debe recurrir a técnicas citológicas especiales para la tinción de los cromosomas, que evidencian "bandas" transversales (oscuras y claras) a lo largo de los mismos, y que corresponden a los distintos tipos de cromatina. En una especie dada, estas variantes de la cromatina presentan un tamaño y disposición constante. | |
| − | Las técnicas de bandeo cromosómico más usadas son:
| |
| | | | |
| − | * Bandeo C : es relativamente sencilla, y se basa en el uso del colorante [[Giemsa]] que tiñe regiones con heterocromatina constitutiva, que en vegetales se halla localizada principalmente en regiones teloméricas, mientras que en animales, se encuentra en regiones centroméricas. | + | *no son indispensables para la vida normal de sus portadores; |
| − | * Bandeos G, R, Q : son técnicas basadas en tratamientos enzimáticos que ponen de manifiesto distintos patrones de bandas de la eucromatina a lo largo del cromosoma. El material se tiñe con colorante Giemsa (G, R) ó colorantes fluorescentes, como la [[quinacrina]] (Q). Son las bandas más estudiadas en animales y en el hombre. En los vegetales son muy difíciles de obtener por el alto grado de empaquetamiento de los cromosomas metafásicos. | + | *no son homólogos de ninguno de los cromosomas A, de los que probablemente proceden; |
| − | * Bandeo NOR : permite identificar cromatina con secuencias medianamente repetidas de ADNr, asociada a las regiones NOR del cromosoma. El número total y localización de las regiones NOR es variable, por lo cual, como ya se expresó, además de su importancia funcional tiene valor cariotípico.<ref name = "UNCOR" /> | + | *por lo general tienen sistemas de herencia irregulares y no mendelianos; |
| | + | *morfológicamente, suelen ser más pequeños que los cromosomas del complemento normal, [[Heterocromatina|heterocromáticos]] y alocíclicos; |
| | + | *en cuanto a su distribución, los cromosomas B varían en frecuencia |
| | + | **dentro de poblaciones de la misma especie (por ejemplo, en el saltamontes ''Myrmeleotettix maculatus'' sólo se han encontrado cromosomas B en la parte sur de Gran Bretaña, no apareciendo ni en otras poblaciones del país ni en las poblaciones de países continentales adyacentes como Francia o Bélgica |
| | + | **dentro de individuos de la misma población; |
| | + | **dentro de células del mismo organismo (por ejemplo, en ''Aegilops mutica'' y ''Aegilops speltoides'' los B sólo están presentes en varias partes aéreas de las plantas, como [[Hipocótilo]]s y ápices, y no en las raíces; |
| | + | *en general carecen de genes mayores,no tienen efectos cualitativos sobre el [[Fenotipo]] y son dañinos para los individuos que los portan en número elevado. |
| | | | |
| − | == Los cromosomas humanos ==
| + | Sin embargo, el término "cromosoma B" integra un conjunto heterogéneo de cromosomas, que varían tanto en su comportamiento como en su forma y tamaño, por lo que las generalizaciones deben realizarse con precaución. |
| − | El [[ser humano]] presenta 23 pares de cromosomas en sus células somáticas: 22 [[autosoma]]s y un par de cromosomas sexuales (dos [[cromosoma X|X]] en el caso de las mujeres y un cromosoma X y un [[cromosoma Y|Y]] en el caso de los varones). El tamaño total aproximado aproximado del [[genoma humano]] es de 3200 millones de pares de [[nucleótido|bases]] de [[ADN]] (3200 [[Mb]]) que contienen unos 20.000-25.000 [[gen]]es.<ref name="IHSGC2004">{{Cita publicación| autor= International Human Genome Sequencing Consortium | título= Finishing the euchromatic sequence of the human genome. | revista= Nature | volumen= 431 | número= 7011 | páginas= 931-45 | año= 2004 | id = PMID 15496913}} [http://www.nature.com/nature/journal/v431/n7011/full/nature03001.html]</ref> De las 3200 Mb unas 2950 Mb corresponden a [[eucromatina]] y unas 250 Mb a [[heterocromatina]]. El [[Proyecto Genoma Humano]] produjo una secuencia de referencia del genoma humano eucromático, usado en todo el mundo en las ciencias biomédicas.
| |
| | | | |
| − | La secuencia de ADN que conforma el genoma humano contiene [[código genético|codificada]] la información necesaria para la expresión, altamente coordinada y adaptable al ambiente, del [[proteoma]] humano, es decir, del conjunto de [[proteína]]s del ser humano. El genoma humano presenta una densidad de genes muy inferior a la que inicialmente se había predicho, con sólo en torno al 1,5%<ref name="IHSGC2001">{{Cita publicación| autor= International Human Genome Sequencing Consortium | título= Initial sequencing and analysis of the human genome. | revista= Nature | volumen= 409 | número= 6822 | páginas= 860-921 | año= 2001 | id = PMID 11237011}} [http://www.nature.com/nature/journal/v409/n6822/full/409860a0.html]</ref> de su longitud compuesta por [[exón|exones]] codificantes de proteínas. Un 70% está compuesto por ADN extragénico y un 30 % por secuencias relacionadas con genes. Del total de ADN extragénico, aproximadamente un 70% corresponde a repeticiones dispersas, de manera que, más o menos, la mitad del genoma humano corresponde a secuencias repetitivas de ADN. Por su parte, del total de ADN relacionado con genes se estima que el 95% corresponde a ADN no codificante: [[#pseudogenes|pseudogenes]], fragmentos de genes, [[intrón|intrones]], secuencias [[UTR (genética)|UTR]], entre otras. Aunque tradicionalmente esas secuencias de ADN han sido consideradas regiones del cromosoma sin función, hay datos que demuestran que esas regiones desarrollan funciones relacionadas con la regulación de la expresión génica.
| + | == Isocromosomas == |
| | | | |
| − | En la siguiente tabla se listan los cromosomas humanos, el número de genes que presenta cada uno, su tamaño en pares de bases y su morfología.
| + | Un [[Isocromosoma]] es un cromosoma metacéntrico anormal originado durante la meiosis o mitosis cuando la división del centrómero se produce según el plano horizontal en vez de vertical. Como consecuencia, uno de los brazos del cromosoma original se pierde y los brazos del isocromosoma resultante son genéticamente idénticos entre sí pero en sentido inverso.<ref name="UNCOR" /> |
| − | {| class="wikitable" style="text-align:right"
| |
| − | |-
| |
| − | ! Cromosoma!! [[Genes]] !! [[Base nitrogenada|Bases]] !! Forma†
| |
| − | |-
| |
| − | | [[Cromosoma 1 (humano)|1]] || 4.222 || 247.199.719<ref name = "vega1">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 1. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=1]</ref>
| |
| − | || metacéntrico, grande.
| |
| − | |-
| |
| − | | [[Cromosoma 2 (humano)|2]] || 2.613 || 242.751.149<ref name = "vega2">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 2. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=2]</ref> || submetacéntrico, grande.
| |
| − | |-
| |
| − | | [[Cromosoma 3 (humano)|3]] || 1.859 || 199.446.827<ref name = "vega3">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 3. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=3]</ref>|| metacéntrico, grande.
| |
| − | |-
| |
| − | | [[Cromosoma 4 (humano)|4]] || 451|| 191.263.063<ref name = "vega4">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 4. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=4]</ref>|| submetacéntrico, grande.
| |
| − | |-
| |
| − | | [[Cromosoma 5 (humano)|5]] || 617|| 180.837.866<ref name = "vega5">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 5. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=5]</ref>|| submetacéntrico, grande.
| |
| | | | |
| − | |-
| + | En los humanos, los isocromosomas se hallan asociados a ciertas enfermedades. Así, por ejemplo, se hallan en algunas niñas que presentan el [[Síndrome de Turner]], en los pacientes con el [[Síndrome de Pallister-Killian]] y en algunos [[Tumor]]es. |
| − | | [[Cromosoma 6 (humano)|6]] || 2.280 || 170.896.993<ref name = "vega6">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 6. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=6]</ref> || submetacéntrico, mediano.
| |
| | | | |
| − | |-
| + | El isocromosoma "17q" (o sea, el isocromosoma formado por dos brazos largos del [[Cromosoma 17]] y que ha perdido el brazo corto) y el isocromosoma "14q" están asociados a ciertos tipos de leucemia. |
| − | | [[Cromosoma 7 (humano)|7]] || 2.758 || 158.821.424<ref name = "vega7">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 7. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=7]</ref> || submetacéntrico, mediano.
| |
| − | |-
| |
| − | | [[Cromosoma 8 (humano)|8]] || 1.288 || 146.274.826<ref name = "vega8">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 8. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=8]</ref>|| submetacéntrico, mediano.
| |
| − | |-
| |
| − | | [[Cromosoma 9 (humano)|9]] || 1.924 || 140.442.298<ref name = "vega9">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 9. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=9]</ref>|| submetacéntrico, mediano.
| |
| − | |-
| |
| − | | [[Cromosoma 10 (humano)|10]] || 1.793 || 131.624.737<ref name = "vega10">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 10. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=10]</ref> || submetacéntrico, mediano.
| |
| − | |-
| |
| − | | [[Cromosoma 11 (humano)|11]] || 449 || 131.130.853<ref name = "vega11">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 11. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=11]</ref> || submetacéntrico, mediano.
| |
| − | |-
| |
| − | | [[Cromosoma 12 (humano)|12]] || 1562 || 132.289.534<ref name = "vega12">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 12. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=12]</ref> || submetacéntrico, mediano.
| |
| − | |-
| |
| − | | [[Cromosoma 13 (humano)|13]] || 924 || 114.127.980<ref name = "vega13">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 13. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=13]</ref>|| acrocéntrico, mediano, con satélite en su brazo corto.
| |
| − | |-
| |
| − | | [[Cromosoma 14 (humano)|14]] || 1.803 || 106.360.585<ref name = "vega14">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 14. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=14]</ref> || acrocéntrico, mediano, con satélite en sus brazo corto.
| |
| − | |-
| |
| − | | [[Cromosoma 15 (humano)|15]] || 1122 || 100.114.055<ref name = "vega15">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 15. Accedido 12 de diciembre de 2008. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=15]</ref>|| acrocéntrico, mediano, con satélite en sus brazo corto.
| |
| − | |-
| |
| − | | [[Cromosoma 16 (humano)|16]] || 1098 || 88.822.254<ref name = "vega16">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 16. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=16]</ref>|| submetacéntrico, pequeño.
| |
| − | |-
| |
| − | | [[Cromosoma 17 (humano)|17]] || 1576 || 78.654.742<ref name = "vega17">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 17. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=17]</ref>|| submetacéntrico, pequeño.
| |
| − | |-
| |
| − | | [[Cromosoma 18 (humano)|18]] || 766 || 76.117.153<ref name = "vega18">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 18. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=18]</ref>|| submetacéntrico, pequeño.
| |
| − | |-
| |
| − | | [[Cromosoma 19 (humano)|19]] || 1859 || 63.806.651<ref name = "vega19">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 19. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=19]</ref>|| metacéntrico, pequeño.
| |
| − | |-
| |
| − | | [[Cromosoma 20 (humano)|20]] || 1012|| 62.436.224<ref name = "vega20">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 20. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=20]</ref>|| metacéntrico, pequeño.
| |
| − | |-
| |
| − | | [[Cromosoma 21 (humano)|21]] || 582|| 46.944.323<ref name = "vega21">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 21. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=21]</ref>|| acrocéntrico, pequeño.
| |
| − | |-
| |
| − | | [[Cromosoma 22 (humano)|22]] || 1816|| 49.528.953<ref name = "vega22">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome 22. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=22]</ref>|| acrocéntrico, pequeño.
| |
| − | |-
| |
| − | | [[Cromosoma X]] || 1850 || 154.913.754<ref name = "vegaX">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome X. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=X]</ref>||submetacéntrico, mediano.
| |
| − | |-
| |
| − | | [[Cromosoma Y]] || 454 || 57.741.652<ref name = "vegaY">Sanger Institute. Vertebrate Genome Annotation (VEGA) database. Human Map View. Chromosome Y. Accedido 11 de enero de 2009. [http://vega.sanger.ac.uk/Homo_sapiens/mapview?chr=Y]</ref> || acrocéntrico, pequeño.
| |
| | | | |
| − | |}
| + | Además, los individuos portadores de isocromosomas pueden tener descendientes con mayor número de cromosomas que el normal. |
| | | | |
| − | === Técnica de estudio === | + | == El cromosoma en organismos procariotas == |
| − | Es posible visualizar los cromosomas por medio de la [[microscopía de luz]] y de tinciones especiales. El proceso para obtener el material cromosómico se realiza en diversos pasos, que incluyen la obtención de una muestra viva, la siembra e incubación de la misma y la posterior tinción y lectura.{{Ref_label|A|a|none}}
| |
| | | | |
| − | == Tipos especiales de cromosomas ==
| + | Los procariotas, [[Bacteria]] y [[Archaea]], presentan típicamente un solo cromosoma circular, si bien existen algunas variantes a esta regla.El cromosoma bacteriano puede tener un tamaño desde 160.000 pares de bases (como en el endosimbionte ''[[Carsonella ruddii]]'',a 12.200.000 pares de bases en la bacteria del suelo ''[[Sorangium cellulosum]]''. |
| − | Existen algunos tipos de cromosomas presentes sólo en algunos tipos celulares o en poblaciones concretas de una [[especie]]. Entre ellos, destacan los [[cromosoma politénico|cromosomas politénicos]], en [[cromosoma en escobilla|escobilla]], [[cromosoma B|cromosomas B]] e [[isocromosoma]]s.
| |
| | | | |
| − | === Cromosomas politénicos ===
| + | Las bacterias usualmente tienen un solo punto en su cromosoma desde el cual se inicia la duplicación, mientras que algunas archeas presentan múltiples sitios de inicio de la duplicación. Por otro lado, los genes de los procariotas están organizados en operones y no contienen intrones. |
| | | | |
| | + | Los procariotas no poseen un núcleo verdadero, en cambio su ADN está organizado en una estructura denominada ''nucleoide''. El nucleoide es una estructura distintiva y ocupa una región definida en la célula bacteriana. |
| | | | |
| − | Las células de las glándulas salivares de los [[insecto]]s del orden de los [[Dípteros]] presentan [[núcleo celular|núcleos]] que se hallan en una interfase permanente. Durante el crecimiento y desarrollo de las larvas de estos insectos, la división celular se detiene en algunos tejidos pero las células continúan su crecimiento por incremento de volumen. Este proceso ocurre, por ejemplo, en los [[tubo de Malpighi|tubos de Malpighi]], en las células nutricias de los [[ovario]]s, en el epitelio intestinal y en las células de las glándulas salivares. En las células de tejidos mencionados, los cromosomas sufren rondas repetidas de duplicaciones pero sin separarse, proceso conocido como [[endomitosis]]. Esto lleva a la producción de cromosomas constituidos por varios cientos o aún miles de hebras. Durante este proceso de politenización o [[politenia]], los cromosomas incrementan tanto su longitud como su diámetro. De hecho, la longitud de los cromosomas de ''Drosophila'' en una metafase es del orden de 7,5 μm mientras que el largo total de los cromosomas en un núcleo de las glándulas salivares es de alrededor de 2.000 μm.<ref name=Panzera /><ref name=Ashburner1970>{{citation
| + | Esta estructura es muy dinámica y se halla mantenida y remodelada a través de la acción de proteínas similares a histonas, las cuales se asocian al cromosoma bacteriano. En archaea, el ADN en el cromosoma se halla todavía más organizado, con el ADN empacado dentro de estructuras similares a los nucleosomas eucarióticos. |
| − | | last = Ashburner | first = M.
| |
| − | | year = 1970
| |
| − | | title = Function and structure of polytene chromosomes during insect development
| |
| − | | journal = Adv Insect Physiol
| |
| − | | volume = 7
| |
| − | | issue = 1
| |
| − | | pages = 3S4
| |
| − | | url = http://books.google.co.uk/books?hl=en
| |
| − | }}</ref>
| |
| | | | |
| − | Además del cambio en el tamaño, los cromosomas politénicos presentan otras dos características. En primer lugar, los cromosomas homólogos están asociados entre sí en toda su extensión. Esta condición, denominada ''apareamiento somático'' es propia de la mitosis de la mayoría de los Dípteros.<ref name=Rudkin1972>{{citation
| + | == Cromosomas artificiales == |
| − | | last = Rudkin | first = G.T.
| |
| − | | year = 1972
| |
| − | | title = Replication in polytene chromosomes
| |
| − | | journal = Results Probl Cell Differ
| |
| − | | volume = 4
| |
| − | | pages = 59–85
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/4198832
| |
| − | }}</ref> La otra característica peculiar es que los cromosomas muestran un patrón particular de bandeo transversal que consiste en zonas más oscuras, llamadas ''bandas'', que alternan con zonas claras, llamadas ''interbandas''. Cuando se observan al microscopio óptico se identifican como bandas oscuras y claras transversales alternantes.<ref>{{citation
| |
| − | | last = G.
| |
| − | | year = 1974
| |
| − | | title = The Relationship Between Genes and Polytene Chromosome Bands
| |
| − | | journal = Annual Reviews in Genetics
| |
| − | | volume = 8
| |
| − | | issue = 1
| |
| − | | pages = 51–62
| |
| − | | doi = 10.1146/annurev.ge.08.120174.000411
| |
| − | }}</ref> Aunque la mayoría de las bandas son continuas a través del cromosoma, otras aparecen como una serie de puntos. Éste bandeo es reproducible de núcleo a núcleo, formando un patrón constante de tal manera que los cromosomas pueden ser identificados y mapeados en toda su longitud. Hay aproximadamente 5000 bandas y 5000 interbandas en total en el genoma de ''Drosophila melanogaster''. Debido a que el patrón de bandeo que presentan los cromosomas politénicos es un reflejo constante de las secuencias de ADN, las bandas sirven como marcadores para localizar varias características genéticas (lugar de los genes, o cambios en el genoma debido a reordenamientos cromosómicos, por ejemplo deleciones, duplicaciones de bandas y translocaciones)<ref name=Lewis1954>{{citation
| |
| − | | last = Lewis | first = E.B.
| |
| − | | year = 1954
| |
| − | | title = The Theory and Application of a New Method of Detecting Chromosomal Rearrangements in Drosophila
| |
| − | | journal = The American Naturalist
| |
| − | | volume = 88
| |
| − | | issue = 841
| |
| − | | pages = 225
| |
| − | | doi = 10.1086/281833
| |
| − | }}</ref><ref>{{citation
| |
| − | | last = C.A.
| |
| − | | year = 1971
| |
| − | | title = The Genetic Organization of Chromosomes
| |
| − | | journal = Annual Reviews in Genetics
| |
| − | | volume = 5
| |
| − | | issue = 1
| |
| − | | pages = 237–256
| |
| − | | doi = 10.1146/annurev.ge.05.120171.001321
| |
| − | }}</ref> y se han utilizado en diversos estudios genéticos y evolutivos.<ref name=Gunderina2005>{{citation
| |
| − | | last1 = Gunderina | first1 = L.I.
| |
| − | | last2 = Kiknadze | first2 = I.I.
| |
| − | | last3 = Istomina | first3 = A.G.
| |
| − | | last4 = Gusev | first4 = V.D.
| |
| − | | last5 = Miroshnichenko | first5 = L.A.
| |
| − | | year = 2005
| |
| − | | title = Divergence of the polytene chromosome banding sequences as a reflection of evolutionary
| |
| − | | journal = Russian Journal of Genetics
| |
| − | | volume = 41
| |
| − | | issue = 2
| |
| − | | pages = 130–137
| |
| − | | doi = 10.1007/s11177-005-0036-6
| |
| − | | url = http://www.springerlink.com/index/H5457R0UN5025585.pdf
| |
| − | }}</ref><ref name=Gunderina2005b>Gunderina, L. I. (2005) Divergence patterns of banding sequences in different polytene chromosome arms reflect relatively independent evolution of different genome components. Russian Journal of Genetics 41(4)</ref><ref name=Coluzzi2002>{{citation
| |
| − | | last1 = Coluzzi | first1 = Mario
| |
| − | | last2 = Sabatini | first2 = Adriana
| |
| − | | last3 = Della Torre | first3 = Alessandra
| |
| − | | last4 = Di Deco | first4 = Maria Angela
| |
| − | | last5 = Petrarca | first5 = Vincenzo
| |
| − | | year = 2002
| |
| − | | title = A Polytene Chromosome Analysis of the Anopheles gambiae Species Complex
| |
| − | | journal = Science
| |
| − | | volume = 298
| |
| − | | issue = 5597
| |
| − | | pages = 1415–1418
| |
| − | | doi = 10.1126/science.1077769
| |
| − | | url = http://www.sciencemag.org/cgi/content/full/298/5597/1415
| |
| − | | pmid = 12364623
| |
| − | }}</ref>
| |
| − | <ref name=Moltó1987>{{citation
| |
| − | | last1 = Moltó | first1 = M.D.
| |
| − | | last2 = Frutos | first2 = R.
| |
| − | | last3 = Martinez-sebastián | first3 = M.J.
| |
| − | | year = 1987
| |
| − | | title = The banding pattern of polytene chromosomes of Drosophila guanche compared with that of D.
| |
| − | | journal = Genetica
| |
| − | | volume = 75
| |
| − | | issue = 1
| |
| − | | pages = 55–70
| |
| − | | doi = 10.1007/BF00056033
| |
| − | | url = http://www.springerlink.com/index/JHWN015824554250.pdf
| |
| − | }}</ref><ref name=Zhao1998>{{citation
| |
| − | | last1 = Zhao | first1 = J.T.
| |
| − | | last2 = Frommer | first2 = M.
| |
| − | | last3 = Sved | first3 = J.A.
| |
| − | | last4 = Zacharopoulou | first4 = A.
| |
| − | | year = 1998
| |
| − | | title = Mitotic and polytene chromosome analyses in the Queensland fruit fly, ''Bactrocera tryoni'' (Diptera: Tephritidae)
| |
| − | | journal = GENOME
| |
| − | | volume = 41
| |
| − | | pages = 510–526
| |
| − | | doi = 10.1139/gen-41-4-510
| |
| − | | url = http://article.pubs.nrc-cnrc.gc.ca/RPAS/RPViewDoc?_handler_=HandleInitialGet | |
| − | }}</ref>
| |
| | | | |
| − | En ''[[Drosophila melanogaster|D. melanogaster]]'' el patrón de bandeo no se distingue en aquellas regiones heterocromáticas presentes en región centromérica de todos sus cromosomas (n=4). Las regiones heterocromáticas están asociadas formando un ''cromocentro''. Ya que dos miembros del complemento haploide de esta especie son metacéntricos (los cromosomas II y III) y dos son acrocéntricos (cromosoma sexual X o Y y el cromosoma IV), los cromosomas politénicos en esta especie aparecen como cinco brazos desiguales que irradian del cromocentro: un brazo correspondiente al cromosoma X, los dos brazos del cromosoma II y los dos brazos del cromosoma III (3L y 3R). En algunos casos se puede visualizar un sexto brazo muy pequeño que representa el cromosoma IV.<ref name=Panzera>Panzera, F., Ruben Pérez y Yanina Panzera. [http://www.fcv.unlp.edu.ar/sitios-catedras/87/material/Bandeos%20Cromosomicos.pdf Identificación cromosómica, cariotipo]. Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata.</ref>
| + | Los cromosomas artificiales son cromosomas que han sido manipulados a través de herramientas de [[Ingeniería genética]] para que presenten estructuras precisas que permiten su integración, permanencia y duplicación en determinados organismos.<ref name="Joydeep">Basu, J. and Huntington F. Willard. Artificial ''and engineered chromosomes: non-integrating vectors for gene therapy''. Trends in Molecular Medicine, Volume 11, Issue 5, May 2005, 251-258.</ref> |
| | | | |
| − | === Cromosomas en escobilla ===
| + | El [[Cromosoma artificial de levadura]] o "YAC" (acrónimo inglés por ''Yeast artificial chromosome'') es un tipo de [[Vector]] de clonación de alta capacidad siendo, de hecho, el de mayor capacidad (200 [[Kb]] a 3.000 kb). |
| | | | |
| − | Los cromosomas en escobilla (también llamados ''cromosomas plumosos''), observados por primera vez por [[Walther Flemming]] en 1882 en oocitos de salamandra ''([[Ambystoma mexicanum]])'',<ref name=Flemming >Flemming W. 1882. Zellsubstanz, Kern- und Zelltheilung. Vogel, Leipzig.</ref> son uno de los tipos de cromosomas más grandes y se hallan en los [[oocito]]s de la mayoría de los animales, exceptuando a los mamíferos. Se hallan durante el estadio de la [[meiosis]] I denominado [[diploteno]]. Luego de este relativamente largo período de la meiosis I, los cromosomas en escobilla vuelven a compactarse durante el período de [[metafase]] I. Son estructuras transitorias, específicamente [[bivalente]]s (es decir, dos cromosomas apareados cada uno de los cuales está formado por dos cromátidas hermanas). Cada uno de los dos cromosomas está constituido por dos largas hebras que forman muchos "rulos" o "bucles", a la manera de un cepillo o escobilla, a lo largo del eje mayor del cromosoma. Esos "rulos" permiten que el ADN se halle disponible para el proceso de transcripción durante la maduración del ovocito.<ref name=Izawa1963>{{citation
| + | Fueron descritos por primera vez en [[1983]].<ref name="Murray">Murray AW, Szostak JW (1983): ''Construction of artificial chromosomes in yeast'', Nature 305, 2049-2054.</ref> Es un vector que imita las características de un cromosoma normal de una [[Levadura]], ya que porta un centrómero y los telómeros terminales. |
| − | | last1 = Izawa | first1 = M.
| |
| − | | last2 = Allfrey | first2 = V.G.
| |
| − | | last3 = Mirsky | first3 = A.E.
| |
| − | | year = 1963
| |
| − | | title = The Relationship between RNA Synthesis and Loop Structure in Lampbrush Chromosomes
| |
| − | | journal = Proceedings of the National Academy of Sciences
| |
| − | | volume = 49
| |
| − | | issue = 4
| |
| − | | pages = 544–551
| |
| − | | url = http://www.pnas.org/cgi/reprint/49/4/544.pdf
| |
| − | }}</ref><ref name=Callan1963>{{citation
| |
| − | | last = Callan | first = H.G.
| |
| − | | year = 1963
| |
| − | | title = The Nature of Lampbrush Chromosomes
| |
| − | | journal = Int Rev Cytol
| |
| − | | volume = 15
| |
| − | | pages = 1–34
| |
| − | | doi = 10.1016/S0074-7696(08)61114-6
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/14283578
| |
| − | }}</ref> De hecho, la presencia de cromosomas en escobilla en una célula es indicador de que está ocurriendo la transcripción del [[ARN mensajero]].<ref name=Macgregor>Macgregor, H. [http://projects.exeter.ac.uk/lampbrush/intro.htm ''Lampbrush chromosomes'' ]. School of Biosciences, University of Exeter.</ref><ref name=Callan1986>{{citation
| |
| − | | last = Callan | first = H.G.
| |
| − | | year = 1986
| |
| − | | title = Lampbrush chromosomes
| |
| − | | journal = Mol Biol Biochem Biophys
| |
| − | | volume = 36
| |
| − | | pages = 1–252
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/3531807
| |
| − | }}</ref><ref name=Gall1991>{{citation
| |
| − | | last1 = Gall | first1 = J.G.
| |
| − | | last2 = Murphy | first2 = C.
| |
| − | | last3 = Callan | first3 = H.G.
| |
| − | | last4 = Wu | first4 = Z.A.
| |
| − | | year = 1991
| |
| − | | title = Lampbrush chromosomes
| |
| − | | journal = Methods Cell Biol
| |
| − | | volume = 36
| |
| − | | pages = 149–66
| |
| − | | doi = 10.1016/S0091-679X(08)60276-9
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/1811131
| |
| − | }}</ref>
| |
| − | El nombre de "cromosomas en escobilla" ("lampbrush chromosome") fue acuñado por J. Rückert en 1892,<ref name=Rückert >Rückert, J. 1892. Zur Entwicklungsgeschichte des Ovarialeies bei Selachiern. Anat Anz 7: 107-158.</ref> quien asimiló la forma de estos cromosomas a un cepillo del siglo XIX, bastante equivalente a o que actualmente se denomina "[[limpiatubo]]s".<ref name=Macgregor />
| |
| | | | |
| − | === Cromosomas B ===
| + | Esto permite clonar (es decir, multiplicar) en levaduras secuencias de ADN de hasta un millón de pares de [[Nucleótido|bases]] o más, al comportarse como un cromosoma propio de la levadura. |
| − | La mayoría de los organismos son habitualmente muy poco tolerantes a la adición o pérdida de material cromosómico, incluso en cantidades ínfimas. Así, alteraciones cromosómicas como las deleciones, duplicaciones y [[aneuploidía]]s (el exceso o defecto respecto al número cromosómico normal en una [[especie]] dada) provocan en el individuo afectado desde malformaciones hasta inviabilidad en diferentes niveles del desarrollo. Sin embargo, una excepción a este hecho en muchas especies animales y vegetales consiste en la existencia de cromosomas supernumerarios o cromosomas B. La distinción entre cromosomas B y los del complemento normal (cromosomas A) fue realizada por primera vez por Randolph en 1928.<ref name="Randolph1928">{{cita publicación | autor = Randolph, L.F. | título = Chromosome numbers in Zea Mays | año = 1928 | publicación = L. Cornel1 Agric. Exp. Sta. Memoir | volumen = 117 | número = | id = 44 }}</ref> En general, los cromosomas accesorios presentan las siguientes características:<ref name=Jones1982>{{Citation
| |
| − | | last1 = Jones | first1 = R.N.
| |
| − | | last2 = Rees | first2 = H.
| |
| − | | title = B chromosomes
| |
| − | | year = 1982
| |
| − | | url = http://www.kew.org/kbd/detailedresult.do?id=240511
| |
| − | }}</ref>
| |
| − | * no son indispensables para la vida normal de sus portadores;
| |
| − | * no son homólogos de ninguno de los cromosomas A, de los que probablemente proceden;
| |
| − | * por lo general tienen sistemas de herencia irregulares y no mendelianos;
| |
| − | * morfológicamente, suelen ser más pequeños que los cromosomas del complemento normal, [[heterocromatina|heterocromáticos]] y alocíclicos;
| |
| − | * en cuanto a su distribución, los cromosomas B varían en frecuencia
| |
| − | ** dentro de poblaciones de la misma especie (por ejemplo, en el saltamontes ''Myrmeleotettix maculatus'' sólo se han encontrado cromosomas B en la parte sur de Gran Bretaña, no apareciendo ni en otras poblaciones del país ni en las poblaciones de países continentales adyacentes como Francia o Bélgica<ref name=Hewitt1978>{{citation
| |
| − | | last1 = Hewitt | first1 = G.M.
| |
| − | | last2 = East | first2 = T.M.
| |
| − | | year = 1978
| |
| − | | title = Effects of B chromosomes on development in grasshopper embryos
| |
| − | | journal = Heredity
| |
| − | | volume = 41
| |
| − | | pages = 347–356
| |
| − | | doi = 10.1038/hdy.1978.105
| |
| − | | url = http://www.nature.com/hdy/journal/v41/n3/abs/hdy1978105a.html
| |
| − | }}</ref>);
| |
| − | ** dentro de individuos de la misma población;
| |
| − | ** dentro de células del mismo organismo (por ejemplo, en ''Aegilops mutica'' y ''Aegilops speltoides'' los B sólo están presentes en varias partes aéreas de las plantas, como [[hipocótilo]]s y ápices, y no en las raíces;<ref name="Cebriá1994">{{cita publicación | autor = Cebriá A., Navarro M.L., Puertas M.J.| título = Genetic control of B-chromosome transmission in Aegilops speltoides (Poaceae)| año = 1994 | publicación = Am J of Botany | volumen = 81 | número = 11 | id = 1502-1511}}</ref>
| |
| − | * en general carecen de genes mayores,<ref name=Fox1974>{{citation
| |
| − | | last1 = Fox | first1 = D.P.
| |
| − | | last2 = Hewitt | first2 = G.M.
| |
| − | | last3 = Hall | first3 = D.J.
| |
| − | | year = 1974
| |
| − | | title = DNA replication and RNA transcription of euchromatic and heterochromatic chromosome regions during …
| |
| − | | journal = Chromosoma
| |
| − | | volume = 45
| |
| − | | issue = 1
| |
| − | | pages = 43–62
| |
| − | | doi = 10.1007/BF00283829
| |
| − | | url = http://www.springerlink.com/index/X57T3662GR353677.pdf
| |
| − | }}</ref> no tienen efectos cualitativos sobre el [[fenotipo]]<ref name=Hewitt1978 /> y son dañinos para los individuos que los portan en número elevado.<ref name=Jones1982 />
| |
| | | | |
| − | Sin embargo, el término "cromosoma B" integra un conjunto heterogéneo de cromosomas, que varían tanto en su comportamiento como en su forma y tamaño, por lo que las generalizaciones deben realizarse con precaución.
| + | Son utilizados en construcción de [[Genoteca]]s genómicas, siendo muy extendido su uso en los primeros años del [[Proyecto Genoma Humano]].<ref name="Larin">Larin Z, Monaco AP, Lehrach H (1991): ''Yeast artificial chromosome libraries containing large inserts from mouse and human DNA'', Proceedings of the National Academy of Sciences (USA) 88, 4123-4127.</ref> Sin embargo, son más inestables que otros vectores, tales como BACs (acrónimo inglés de "Bacterial artificial chromosome" o [[Cromosoma artificial bacteriano]]), que han acabado imponiéndose.<ref>Bellanné-Chantelot C et al. (1992): ''Mapping the whole human genome by fingerprinting yeast artificial chromosomes'', Cell 70, 1059-1068</ref> |
| | | | |
| − | === Isocromosomas === | + | Estos últimos son también vectores de clonación usados para clonar fragmentos de [[ADN]] de 100 a 300 kb de tamaño en la [[Bacteria]] ''[[Escherichia coli]]''. Su estructura es análoga a la del [[Plásmido]] factor-F encontrado de modo natural en esa especie bacteriana.<ref name="Piqueras" /> |
| | | | |
| − | Un [[isocromosoma]] es un cromosoma metacéntrico anormal originado durante la meiosis o mitosis cuando la división del centrómero se produce según el plano horizontal en vez de vertical. Como consecuencia, uno de los brazos del cromosoma original se pierde y los brazos del isocromosoma resultante son genéticamente idénticos entre sí pero en sentido inverso.<ref name = "UNCOR" />
| + | == Véase también == |
| | | | |
| − | En los humanos, los isocromosomas se hallan asociados a ciertas enfermedades. Así, por ejemplo, se hallan en algunas niñas que presentan el [[síndrome de Turner]], en los pacientes con el [[síndrome de Pallister-Killian]] y en algunos [[tumor]]es. El isocromosoma "17q" (o sea, el isocromosoma formado por dos brazos largos del [[cromosoma 17]] y que ha perdido el brazo corto) y el isocromosoma "14q" están asociados a ciertos tipos de leucemia.<ref name=Hernandez-boluda2000>{{citation
| + | *[[Genotipo]] |
| − | | last1 = Hernandez-boluda | first1 = J.C.
| + | *[[Genoma]] |
| − | | last2 = Cervantes | first2 = F.
| + | *[[Genoma humano]] |
| − | | last3 = Costa | first3 = D.
| + | *[[Citogenética]] |
| − | | last4 = Carrio | first4 = A.
| + | *[[Cariotipo]] |
| − | | last5 = Montserrat | first5 = E.
| + | *[[Aberración cromosómica]] |
| − | | year = 2000
| + | *[[Anomalias cromosómicas]] |
| − | | title = . Chronic myeloid leukemia with isochromosome 17q: report of 12 cases and review of the literature
| |
| − | | journal = Leuk Lymphoma
| |
| − | | volume = 38
| |
| − | | issue = 1-2
| |
| − | | pages = 83–90
| |
| − | | url = http://www.ncbi.nlm.nih.gov/pubmed/10811450
| |
| − | }}</ref><ref name=Liu1992>{{citation
| |
| − | | last1 = Liu | first1 = H.W.
| |
| − | | last2 = Lie | first2 = K.W.
| |
| − | | last3 = Chan | first3 = L.C.
| |
| − | | year = 1992
| |
| − | | title = Isochromosome 14 q and leukemia with dysplastic features
| |
| − | | journal = Cancer genetics and cytogenetics
| |
| − | | volume = 64
| |
| − | | issue = 1
| |
| − | | pages = 97–98
| |
| − | | doi = 10.1016/0165-4608(92)90333-4
| |
| − | | url = http://cat.inist.fr/?aModele=afficheN
| |
| − | }}</ref>Además, los individuos portadores de isocromosomas pueden tener descendientes con mayor número de cromosomas que el normal.<ref name=Kleczkowska1986>{{citation
| |
| − | | last1 = Kleczkowska | first1 = A.
| |
| − | | last2 = Fryns | first2 = J.P.
| |
| − | | last3 = Buttiens | first3 = M.
| |
| − | | last4 = Bisschop | first4 = F.
| |
| − | | last5 = Emmery | first5 = L.
| |
| − | | last6 = Berghe | first6 = H.V.
| |
| − | | year = 1986
| |
| − | | title = Trisomy (18q) and tetrasomy (18p) resulting from isochromosome formation
| |
| − | | journal = Clinical Genetics
| |
| − | | volume = 30
| |
| − | | issue = 6
| |
| − | | pages = 503–508
| |
| − | | doi = 10.1111/j.1399-0004.1986.tb01918.x
| |
| − | }}</ref>
| |
| | | | |
| − | == El cromosoma en organismos procariotas == | + | == Notas == |
| | + | <div class="references-small" style="-moz-column-count: 1;"> |
| | + | '''a.''' Los pasos para realizar el estudio de los cromosomas humanos mediante técnicas convencionales son los siguientes:<ref name="Cesar Paz">César Paz y Miño. 1999. Citogenética humana: manual de prácticas. [http://members.tripod.com/geneticahumana/libros/libros.html Práctica 5: CULTIVO Y PREPARACION DE LINFOCITOS PARA ANALISIS CROMOSOMICO]. Laboratorio de Genética Molecular y Citogenética Humana, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales y Facultad de Medicina. PONTIFICIA UNIVERSIDAD CATOLICA DEL ECUADOR.</ref> |
| | | | |
| − | Los procariotas, [[bacteria]] y [[archaea]], presentan típicamente un solo cromosoma circular, si bien existen algunas variantes a esta regla.<ref>{{Cita publicación|autor=Thanbichler M, Shapiro L |título=Chromosome organization and segregation in bacteria |revista=J. Struct. Biol. |volumen=156 |número=2 |páginas=292–303 |año=2006 |pmid=16860572 |doi=10.1016/j.jsb.2006.05.007}}</ref> El cromosoma bacteriano puede tener un tamaño desde 160.000 pares de bases (como en el endosimbionte ''[[Carsonella ruddii]]'',<ref>{{Cita publicación|autor=Nakabachi A, Yamashita A, Toh H, Ishikawa H, Dunbar H, Moran N, Hattori M |título=The 160-kilobase genome of the bacterial endosymbiont ''Carsonella'' |revista=Science |volumen=314 |número=5797 |páginas=267 |año=2006 |pmid=17038615 |doi=10.1126/science.1134196}}</ref> a 12.200.000 pares de bases en la bacteria del suelo ''[[Sorangium cellulosum]]''.<ref>{{Cita publicación|autor=Pradella S, Hans A, Spröer C, Reichenbach H, Gerth K, Beyer S |título=Characterisation, genome size and genetic manipulation of the myxobacterium ''Sorangium cellulosum'' So ce56 |revista=Arch Microbiol |volumen=178 |número=6 |páginas=484–92 |año=2002 |pmid=12420170 | doi = 10.1007/s00203-002-0479-2 }}</ref>
| + | #'''Obtención de la muestra''': se realiza exclusivamente de tejidos vivos que contengan células con núcleo. Principalmente se emplean los glóbulos blancos que se hallan en la sangre por su fácil accesibilidad. |
| | + | #'''Siembra''': la cual se realiza agregando aproximadamente 1 mililitro de sangre entera heparinizada a un medio de cultivo enriquecido con suero fetal bovino, antibióticos y mitógenos, lo cual estimulará el crecimiento y división de las células. |
| | + | #'''Incubación''': se mantiene a 38 grados centígrados con una atmósfera de CO2 al 5 % y humedad por 72 horas. |
| | + | #'''Cosecha''': Se agrega colchicina a la muestra para detener la [[Mitosis]] en metafase, posteriormente se cenfrifuga la mezcla para retirar el sobrenadante (suero sanguíneo y medio de cultivo). |
| | | | |
| − | Las bacterias usualmente tienen un solo punto en su cromosoma desde el cual se inicia la duplicación, mientras que algunas archeas presentan múltiples sitios de inicio de la duplicación.<ref>{{Cita publicación|autor=Kelman LM, Kelman Z |título=Multiple origins of replication in archaea |revista=Trends Microbiol. |volumen=12 |número=9 |páginas=399–401 |año=2004 |pmid=15337158 |doi=10.1016/j.tim.2004.07.001}}</ref> Por otro lado, los genes de los procariotas están organizados en operones y no contienen intrones.
| + | Se agrega solución hipotónica de [[Cloruro de Potasio]] para romper las membranas celulares y para finalizar el paso de la cosecha se realizan 3 lavados con una solución de [[Metanol]] y [[Ácido acético]]. |
| | | | |
| − | Los procariotas no poseen un núcleo verdadero, en cambio su ADN está organizado en una estructura denominada ''nucleoide''.<ref>{{Cita publicación|autor=Thanbichler M, Wang SC, Shapiro L |título=The bacterial nucleoid: a highly organized and dynamic structure |revista=J. Cell. Biochem. |volumen=96 |número=3 |páginas=506–21 |año=2005 |pmid=15988757 | doi = 10.1002/jcb.20519 <!--Retrieved from PMID by DOI bot-->}}</ref> El nucleoide es una estructura distintiva y ocupa una región definida en la célula bacteriana. Esta estructura es muy dinámica y se halla mantenida y remodelada a través de la acción de proteínas similares a histonas, las cuales se asocian al cromosoma bacteriano.<ref>{{Cita publicación|autor=Sandman K, Pereira SL, Reeve JN |título=Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome |revista=Cell. Mol. Life Sci. |volumen=54 |número=12 |páginas=1350–64 |año=1998 |pmid=9893710 |doi=10.1007/s000180050259}}</ref> En archaea, el ADN en el cromosoma se halla todavía más organizado, con el ADN empacado dentro de estructuras similares a los nucleosomas eucarióticos.<ref>{{Cita publicación|autor=Sandman K, Reeve JN |título=Structure and functional relationships of archaeal and eukaryal histones and nucleosomes | doi = 10.1007/s002039900122 <!--Retrieved from Yahoo! by DOI bot-->|revista=Arch. Microbiol. |volumen=173 |número=3 |páginas=165–9 |año=2000 |pmid=10763747}}</ref><ref>{{Cita publicación|autor=Pereira SL, Grayling RA, Lurz R, Reeve JN |título=Archaeal nucleosomes | doi = 10.1073/pnas.94.23.12633 <!--Retrieved from URL by DOI bot-->|revista=Proc. Natl. Acad. Sci. U.S.A. |volumen=94 |número=23 |páginas=12633–7 |año=1997 |pmid=9356501 |url=http://www.pnas.org/cgi/pmidlookup?view=long&pmid=9356501}}</ref>
| + | #'''Goteo''': con posterioridad a los lavados, por medio de centrifugación, se obtiene un botón celular blanco, el cual se suspende en la misma solución fijadora de metanol y ácido acético y se procede a gotear en un portaobjetos a unos cuantos centímetros, esto es con el objetivo de "reventar" las células y obtener los cromosomas. |
| | + | #'''Envejecimiento''': en este paso se espera a que la muestra pierda humedad. Se puede aplicar calor al portaobjetos para deshidratar la muestra. |
| | + | #'''Tinción''': existen muchos tipos de tinciones para observar los cromosomas. La más utilizada es la tinción con colorante [[Giemsa]], se conoce como técnica de bandas GTG. En este caso se expone la muestra del portaobjetos a [[Tripsina]], con el objetivo de desnaturalizar algunas de las proteínas constitutivas de los cromosomas. |
| | | | |
| − | == Cromosomas artificiales ==
| + | Posteriormente se tiñen con dos colorantes, Giemsa y Wrigth, en algunos laboratorios puede emplearse un solo colorante, pero el empleo de los dos mejora la calidad del resultado, puesto que facilita el análisis al microscopio para el citogenetista creando un contraste de color en las bandas que se formaron al emplear la tripsina. |
| − | {{AP|Cromosoma artificial de levadura|AP2=Cromosoma artificial bacteriano|AP3=Cromosoma artificial humano|AP4=Cromosoma artificial de mamífero}}
| |
| − | Los cromosomas artificiales son cromosomas que han sido manipulados a través de herramientas de [[ingeniería genética]] para que presenten estructuras precisas que permiten su integración, permanencia y duplicación en determinados organismos.<ref name=Joydeep >Basu, J. and Huntington F. Willard. Artificial ''and engineered chromosomes: non-integrating vectors for gene therapy''. Trends in Molecular Medicine, Volume 11, Issue 5, May 2005, 251-258.</ref>
| |
| − | El [[cromosoma artificial de levadura]] o "YAC" (acrónimo inglés por ''Yeast artificial chromosome'') es un tipo de [[vector]] de clonación de alta capacidad siendo, de hecho, el de mayor capacidad (200 [[kb]] a 3.000 kb). Fueron descritos por primera vez en [[1983]].<ref name=Murray >Murray AW, Szostak JW (1983): ''Construction of artificial chromosomes in yeast'', Nature 305, 2049-2054.</ref>
| |
| − | Es un vector que imita las características de un cromosoma normal de una [[levadura]], ya que porta un centrómero y los telómeros terminales. Esto permite clonar (es decir, multiplicar) en levaduras secuencias de ADN de hasta un millón de pares de [[nucleótido|bases]] o más, al comportarse como un cromosoma propio de la levadura. Son utilizados en construcción de [[genoteca]]s genómicas, siendo muy extendido su uso en los primeros años del [[Proyecto Genoma Humano]].<ref name=Larin >Larin Z, Monaco AP, Lehrach H (1991): ''Yeast artificial chromosome libraries containing large inserts from mouse and human DNA'', Proceedings of the National Academy of Sciences (USA) 88, 4123-4127.</ref> Sin embargo, son más inestables que otros vectores, tales como BACs (acrónimo inglés de "Bacterial artificial chromosome" o [[cromosoma artificial bacteriano]]), que han acabado imponiéndose.<ref name=Bellanné>Bellanné-Chantelot C et al. (1992): ''Mapping the whole human genome by fingerprinting yeast artificial chromosomes'', Cell 70, 1059-1068</ref> Estos últimos son también vectores de clonación usados para clonar fragmentos de [[ADN]] de 100 a 300 kb de tamaño en la [[bacteria]] ''[[Escherichia coli]]''. Su estructura es análoga a la del [[plásmido]] factor-F encontrado de modo natural en esa especie bacteriana.<ref name=Piqueras />
| |
| | | | |
| − | == Véase también ==
| + | Por medio de estas bandas podemos distinguir las características de un cromosoma y determinar si es normal o presenta alguna anomalía estructural. Existen otras técnicas de tinción, como bandas NOR, ICH, bandas Q, bandas R, técnicas para teñir centrómero y heterocromatina. Con este tipo de técnicas se puede llegar a realizar un diagnóstico citogenético acerca de una enfermedad cromosómica. |
| − | * [[Genotipo]]
| |
| − | * [[Genoma]]
| |
| − | * [[Genoma humano]]
| |
| − | * [[Citogenética]]
| |
| − | * [[Cariotipo]]
| |
| − | * [[Aberración cromosómica]]
| |
| | | | |
| − | == Notas ==
| + | #'''Lectura''': el último paso consiste en observar por lo menos 20 placas metafásicas y formar un cariotipo o cariograma, donde se acomodan los cromosomas por grupos según el tamaño y la localización del centrómero. |
| − | <div class="references-small" style="-moz-column-count:1; column-count:1;">
| |
| − | '''a.''' Los pasos para realizar el estudio de los cromosomas humanos mediante técnicas convencionales son los siguientes:<ref name="Cesar Paz">César Paz y Miño. 1999. Citogenética humana: manual de prácticas. [http://members.tripod.com/geneticahumana/libros/libros.html Práctica 5: CULTIVO Y PREPARACION DE LINFOCITOS PARA ANALISIS CROMOSOMICO]. Laboratorio de Genética Molecular y Citogenética Humana, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales y Facultad de Medicina. PONTIFICIA UNIVERSIDAD CATOLICA DEL ECUADOR.</ref>
| |
| − | # '''Obtención de la muestra''': se realiza exclusivamente de tejidos vivos que contengan células con núcleo. Principalmente se emplean los glóbulos blancos que se hallan en la sangre por su fácil accesibilidad.
| |
| − | # '''Siembra''': la cual se realiza agregando aproximadamente 1 mililitro de sangre entera heparinizada a un medio de cultivo enriquecido con suero fetal bovino, antibióticos y mitógenos, lo cual estimulará el crecimiento y división de las células.
| |
| − | # '''Incubación''': se mantiene a 38 grados centígrados con una atmósfera de CO2 al 5 % y humedad por 72 horas.
| |
| − | # '''Cosecha''': Se agrega colchicina a la muestra para detener la [[mitosis]] en metafase, posteriormente se cenfrifuga la mezcla para retirar el sobrenadante (suero sanguíneo y medio de cultivo). Se agrega solución hipotónica de [[cloruro de potasio]] para romper las membranas celulares y para finalizar el paso de la cosecha se realizan 3 lavados con una solución de [[metanol]] y [[ácido acético]].
| |
| − | # '''Goteo''': con posterioridad a los lavados, por medio de centrifugación, se obtiene un botón celular blanco, el cual se suspende en la misma solución fijadora de metanol y ácido acético y se procede a gotear en un portaobjetos a unos cuantos centímetros, esto es con el objetivo de "reventar" las células y obtener los cromosomas.
| |
| − | # '''Envejecimiento''': en este paso se espera a que la muestra pierda humedad. Se puede aplicar calor al portaobjetos para deshidratar la muestra.
| |
| − | # '''Tinción''': existen muchos tipos de tinciones para observar los cromosomas. La más utilizada es la tinción con colorante [[Giemsa]], se conoce como técnica de bandas GTG. En este caso se expone la muestra del portaobjetos a [[tripsina]], con el objetivo de desnaturalizar algunas de las proteínas constitutivas de los cromosomas. Posteriormente se tiñen con dos colorantes, Giemsa y Wrigth, en algunos laboratorios puede emplearse un solo colorante, pero el empleo de los dos mejora la calidad del resultado, puesto que facilita el análisis al microscopio para el citogenetista creando un contraste de color en las bandas que se formaron al emplear la tripsina. Por medio de estas bandas podemos distinguir las características de un cromosoma y determinar si es normal o presenta alguna anomalía estructural. Existen otras técnicas de tinción, como bandas NOR, ICH, bandas Q, bandas R, técnicas para teñir centrómero y heterocromatina. Con este tipo de técnicas se puede llegar a realizar un diagnóstico citogenético acerca de una enfermedad cromosómica.
| |
| − | # '''Lectura''': el último paso consiste en observar por lo menos 20 placas metafásicas y formar un cariotipo o cariograma, donde se acomodan los cromosomas por grupos según el tamaño y la localización del centrómero. | |
| | </div> | | </div> |
| | | | |
| − | == Referencias == | + | == Referencias == |
| | + | |
| | + | {{Listaref|2}} |
| | + | |
| | + | == Bibliografía == |
| | | | |
| − | {{Listaref|2}}
| + | *Adolph, K. (ed.) [[1988|1988]].''Chromosomes and chromatin, Vols. 1-3, Boca RAton, FL; CRC Press.'' |
| | + | *Hsu, T.C. [[1979|1979]].''Human and mammalian cytogenetics: an historical perspective. New York, Springer Verlag.'' |
| | + | *Stewart, A. [[1990|1990]]. ''The functional organization of chromosomes and the nucleus, a special issue. Trends Genet. 6:377-379'' |
| | + | *Price, C.M. [[1992|1992]]. ''Centromeres and telomeres. Curr. Opin. Cell Biol. 4: 379-384.'' |
| | + | *Gall, J.G. [[1981|1981]].''Chromosome structure and the C-value paradox. J. Cell Biol. 91:3-14'' |
| | + | *Blackburn, E.H., Szostak, J.W. [[1984|1984]]. ''The molecular structure of centromeres and telomeres. Annu. Rev. Biochem. 53: 163-194.'' |
| | | | |
| − | == Bibliografía == | + | == Enlaces externos == |
| − | * Adolph, K. (ed.) 1988. Chromosomes and chromatin, Vols. 1-3, Boca RAton, FL; CRC Press.
| |
| − | * Hsu, T.C. 1979. Human and mammalian cytogenetics: an historical perspective. New York, Springer Verlag.
| |
| − | * Stewart, A. 1990. The functional organization of chromosomes and the nucleus, a special issue. Trends Genet. 6:377-379
| |
| − | * Price, C.M. 1992. Centromeres and telomeres. Curr. Opin. Cell Biol. 4: 379-384.
| |
| − | * Gall, J.G. 1981. Chromosome structure and the C-value paradox. J. Cell Biol. 91:3-14
| |
| − | * Blackburn, E.H., Szostak, J.W. 1984. The molecular structure of centromeres and telomeres. Annu. Rev. Biochem. 53: 163-194.
| |
| | | | |
| − | == Enlaces externos ==
| + | *[http://www.ornl.gov/hgmis/posters/chromosome Exploring Genes and Genetic Disorders] (en inglés). |
| − | * [http://www.ornl.gov/hgmis/posters/chromosome Exploring Genes and Genetic Disorders] (en inglés). | |
| | | | |
| − | * [http://www.youtube.com/watch?v=nVbaULi0VF4 Los Cromosomas Video en Youtube] | + | *[http://www.youtube.com/watch?v=nVbaULi0VF4 Los Cromosomas Video en Youtube] |
| | | | |
| − | [[Categoría:Genética]] | + | [[Category:Genética_clínica]] |
Cromosoma |
|---|
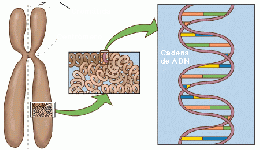
|
|
Cromosomas. Los cromosomas son los portadores de la mayor parte del material genético y condicionan la organización de la vida y las características hereditarias de cada especie. Los experimentos de Mendel pusieron de manifiesto que muchos de los caracteres del guisante dependen de dos factores, después llamados genes, de los que cada individuo recibe una copia procedente del padre y otra procedente de la madre.
Introducción
Cuando el núcleo celular comienza el proceso de división (cariocinesis), esa maraña de hilos inicia un fenómeno de condensación progresivo que finaliza en la formación de entidades discretas e independientes: los cromosomas. Por lo tanto, cromatina y cromosoma son dos aspectos morfológicamente distintos de una misma entidad celular.[1]
Cuando se examinan con detalle durante la mitosis, se observa que los cromosomas presentan una forma y un tamaño característicos. Cada cromosoma tiene una región condensada, o constreñida, llamada centrómero, que confiere la apariencia general de cada cromosoma y que permite clasificarlos según la posición del centrómero a lo largo del cromosoma. Otra observación que se puede realizar es que el número de cromosomas de los individuos de la misma especie es constante.
Más o menos en la época en la que Mendel llevaba a cabo sus experimentos, se consiguió ver los cromosomas al microscopio mediante tinciones especiales, descubriéndose una serie de propiedades:
- Todos los individuos de una misma especie tienen el mismo número de cromosomas
- Los cromosomas se duplican durante la división celular y, una vez completada, recuperan el estado original
- Los cromosomas de una célula difieren en tamaño y forma, y de cada tipo se encuentran dos ejemplares, de modo que el número de cromosomas es de 2N (esta propiedad se denomina diploidía)
- Durante la formación de células sexuales (meiosis) el número de cromosomas baja a N. La fertilización del óvulo por el espermatozoide, restaura el número de cromosomas a 2N, de los cuales N proceden del padre y N de la madre
- Además de los cromosomas usuales que forman parejas, existen los cromosomas X e Y que condicionan el sexo. El cromosoma X está presente en dos copias en las hembras, mientras que los varones tienen un cromosoma X y un cromosoma Y. La asignación del sexo a un solo par de cromosomas explica la proporción aproximadamente igual de varones y hembras.
- Los cromosomas se observan mejor al microscopio durante la metafase, cuando el DNA se ha duplicado y la cromatina está muy condensada, formando las cromátidas (las dos hebras de DNA todavía unidas por un solo centrómero). A partir de las fotografías obtenidas en esta fase, se crea el cariotipo, agrupando los cromosomas por parejas
En los humanos
En la especie humana, el número de cromosomas es de 24 pares. Los 22 primeros son parejas de los cromosomas 1, 2,.. , y 22 (se denominan autosomas) mientras que la pareja 23 es la XX y la 24 la XY para los varones o las XX para las hembras. Los cromosomas difieren en cuanto a forma y tamaño dependiendo del número de pares de bases que contengan. Los cromosomas X e Y reciben el nombre de cromosomas sexuales o gonosomas. En el ratón existen 20 pares de cromosomas y en la mosca drosophiila melanogaster tan solo 4 pares.
Durante la metafase, las dos hebras del DNA ya duplicado se encuentran unidas por el centrómero y el cinetocoro. El centrómero esta constituído por DNA, mientras que el cinetocoro es una proteína. Según la posición del centrómero, los cromosonas reciben el nombre de metacéntrico, submetacéntrico, acrocéntrico o telocéntrico. En el cariotipo humano los pares de cromosomas 13, 14, 15, 21, 22 son acrocéntricos y el cromosoma Y es sub-telocéntrico.
El centrómero divide el cromosoma en dos brazos: un brazo corto (brazo q) y un brazo largo (brazo p). Por convención, en los diagramas, el brazo q se coloca en la parte superior.
Algunas técnicas de tinción hacen que los cromosomas aparezcan con bandas oscuras y claras que se alternan en cada uno de los brazos siguiendo un patrón específico y repetible para cada cromosoma. Estas bandas dependen de la situación dinámica del cromosoma, de manera que los cromosomas en profase tienen muchas más bandas que los que se encuentran en metafase.
La numeración de estas bandas sigue una convención aceptada por los geneticistas y comienza para cada brazo a partir del centrómero. Las últimas bandas reciben el sufijo ter (21ter). De esta manera, la posición de cada uno de los genes puede ser definida. En los últimos años, los geneticistas están terminando de mapear todos los cromosomas en el llamado proyecto genoma humano.
Anormalidades
Los cromosomas pueden tener anormalidades constitucionales o adquiridas.
Anormalidades constitucionales: la misma anormalidad cromosómica se encuentra en las células de todos los tejidos. El error cromosómico puede provenir de uno de los gametos antes de la fertilización, o puede ocurrir en el cigoto fertilizado. Si algunos de los genes no están presentes por duplicado sino que existen 1 copia o 3 copias (por ejemplo en la trisomía 21 o síndrome de Dow), el sujeto experimentará dismorfias, malformaciones viscerales y/o retraso mental y psicomotor.
- Las anormalidades adquiridas se refieren a una anormalidad cromosómica que aparece en las células de un sólo tejido, como ocurre en el cáncer.
- Las anormalidades cromosómicas pueden ser homogéneas o en mosaico.
- Las anormalidades homogéneas con aquellas en las que todas las células tienen la misma anormalidad (por ejemplo la trisomía 21 en el Síndrome de Down), o cuando una anormalidad adquirida se extiende a todas las células de un mismo tejido (por ejemplo las células de la médula ósea en la leucemia mieloide crónica muestran todas ellas una translocación t(9,22).
Se definen como anormalidades mosaico, aquellas en las todas las células muestran la misma anormalidad sino que pueden ser normales o llevar otra anormalidad. Esta situación es relativamente frecuente en la leucemia linfoblástica en la que pueden coexitir clones normales con células con una o más alteraciones [por ejemplo, 46,XY/46, XY, t(4;11)/46, XY, t(4;11), i(7q)]
También, se clasifican las anormalidades cromosómicas como númericas o estructurales.
- Las anormalidades numéricas son aquellas en las que hay un exceso o un defecto de cromosomas (por ejemplo, la trisomía 21).
- Las anormalidades estructurales son aquellas en las que las alteraciones se encuentran dentro de los mismos cromosomas. Puede ser anormalidades compensadas cuando no hay pérdida ni ganancia de material genético o descompensadas cuando existe deleción o duplicación de algún segmento cromosómico.
Formación
Un cromosoma está formado por dos cromátidas, que son cadenas iguales de ADN, es decir, con los mismos genes y los mismos alelos.
Los cromosomas se clasifican según la longitud relativa de sus brazos, es decir, según la posición del centrómero, en:
- Metacéntricos: cuando los dos brazos son aproximadamente iguales y el centrómero está en el centro.
- Submetacéntricos: el centrómero está ligeramente desplazado hacia un lado dando dos brazos algo desiguales
- Telocéntricos: cuando el centrómero está más cerca de un extremo, dando dos brazos muy desiguales
- Acrocéntricos: el centrómero está en un extremo, por lo que en realidad sólo existe un brazo.
Herencia de las enfermedades
Si el gen de una enfermedad esta en el cromosoma X una hembra que tenga uno de estos cromosomas con el alelo normal y el otro con el alelo que produce la enfermedad, no padecerá esta. El alelo normal es dominante y enmascarará al que provoca la anomalía, que es recesivo. La hembra no enferma, pero puede transmitir la enfermedad. Por ello se denomina hembra portadora.
El caso del macho es muy distinto. Si recibe un cromosoma X, con el alelo que provoca la enfermedad, irremediablemente la padecerá, ya que no tiene otro cromosoma X en el que pueda estar el alelo dominante.
Cronología de descubrimientos
- 1841, los cromosomas fueron descubiertos por Karl Wilhelm von Nägeli.
- 1869, Friedrich Miescher descubre el ADN.
- 1889, Wilhelm von Waldeyer les dio el nombre de cromosoma que significa cuerpo coloreado en idioma griego.
- 1910, Thomas Hunt Morgan describió que son los portadores de los Genes.
- 1943, Oswald Avery, C. McLeod y M. McCarty descubren que el ADN es el material hereditario.
- 1953, James Dewey Watson y Francis Harry Compton Crick descubren la estructura del ADN.
- 1966, Severo Ochoa completa el código genético.
- 1972, D. Jackson, R. Symons, P. Berg: Molécula artificial.
- 1973, J. Boyer, S. Cohen: Clonación de bacterias.
- 1977, Frederick Sanger: secuenciación del ADN.
- 1978, producción de proteína humana en bacterias.
- 1981, se hace el primer diagnóstico prenatal.
- 1982, se crean los primeros organismos Transgénicos.
- 1983, secuenciación de los primeros genomas enteros.
- 2001, secuenciación del Genoma humano.
Las histonas
Las histonas son proteínas básicas, ricas en residuos de Lisina y Arginina, que muestran una elevada conservación evolutiva y que interaccionan con el ADN formando una subunidad que se repite a lo largo de la cromatina denominada nucleosoma.
Los principales tipos de histonas que se han aislado en los núcleos interfásicos en diferentes especies eucariontes son: H1, H2A, H2B, H3 y H4. Además de estas histonas, también existen otras que son específicas de tejido como la histona H5 muy rica en lisina (25 moles%) específica de eritrocitos nucleados de vertebrados no mamíferos, y las histonas del endosperma.[2] Asimismo, la cromatina centromérica se caracteriza por la presencia de una isoforma específica de la histona H3, denominada CENP-A en vertebrados.
Una de las características más destacables es su elevado conservadurismo evolutivo, sobre todo de las histonas H3 y H4. La histona H4 de Guisante y de timo de ternera se diferencian solamente en dos aminoácidos. Este dato indica que las interacciones entre el ADN y las histonas para formar la cromatina deben ser muy semejantes en todos los organismos eucariontes.
Los Genes que codifican las histonas se encuentran agrupados en nichos (o clusters) que se repiten decenas o centenas de veces. Cada cluster o grupo contiene el siguiente orden de genes que codifican histonas: H1-H2A-H3-H2B-H4. Estos genes son ricos en pares G-C, ya que codifican proteínas con un elevado contenido en Lisina y Arginina, pero están separados por secuencias espaciadoras ricas en pares A-T.[3][4][2][5][6]
Proteínas cromosómicas no histónicas: el armazón proteico
Las proteínas cromosómicas no histónicas son proteínas diferentes de las histonas que se extraen de la cromatina de los núcleos con ClNa 0.35M (solución salina), tienen un alto contenido en Aminoácidos básicos (25% o más), alto contenido en aminoácidos ácidos (20-30%), una elevada proporción de prolina (7%), bajo contenido en aminoácidos hidrofóbicos y una alta movilidad electroforética.
Las proteínas cromosómicas no histónicas que se extraen de la cromatina de los núcleos varían mucho dependiendo de la técnica de aislamiento empleada. Un grupo de estas proteínas cromosómicas no histónicas presentan alta movilidad electrofóretica y se denominan abreviadamente HMG (grupo de alta movilidad).
Modelos alternativos de la estructura cromosómica
Es cada vez más evidente que incluso con los métodos de fijación más utilizados[7] se pueden producir cambios significativos en la localización de las proteínas cromosómicas, y estas dificultades técnicas han estado presentes en la mayor parte de las preparaciones cromosómicas utilizadas para realizar los estudios estructurales. Por ello, parece necesario utilizar muestras vivas siempre que sea posible, así como aproximaciones alternativas que permitan un análisis complementario.[8]
La aproximación biofísica
Un modo alternativo para el análisis estructural de los cromosomas es el biofísico. Las medidas precisas de la rigidez y la elasticidad de los cromosomas pueden guiar la construcción de los modelos estructurales. Estudios realizados en diferentes laboratorios indican que los cromosomas presentan una elasticidad remarcable: tanto dentro de las células como en tampones fisiológicos, los cromosomas pueden estirarse hasta varias veces su longitud normal y volver de nuevo a su longitud original.[9]
Sin embargo, los datos obtenidos por diferentes laboratorios son muy variables, probablemente debido a la variedad de tampones utilizado por los distintos grupos. Un estudio de Poirier y Marko en 2002 mostró que la elasticidad de los cromosomas es muy sensible a nucleasa.[10]
Estos datos sugieren que la integridad mecánica de los cromosomas mitóticos se mantiene por enlaces entre las fibras cromosómicas, no por la existencia de un armazón proteico. La naturaleza de estos enlaces no está clara, pero este estudio estima su frecuencia en 10-20 kb como mínimo.
Los componentes bioquímicos de los cromosomas
Un método convencional y muy potente para entender una estructura biológica consiste en establecer una lista que incluya todos sus componentes. Los estudios iniciales de la estructura cromosómica se enfrentaron a muchos problemas técnicos para conseguir aislar bioquímicamente los cromosomas mitóticos de las células, aunque métodos sofisticados permitieron el aislamiento de los cromosomas completos y la identificación del armazón proteico.[11]
Un método alternativo consiste en la utilización de extractos libres de células procedentes de huevos de anfibios. Este sistema permite la reconstitución in vitro de cromosomas mitóticos a partir de sustratos simples (por ejemplo, cromatina de esperma) en condiciones fisiológicas, de manera que los componentes proteicos de las estructuras que se ensamblan pueden aislarse por centrifugación en un sólo paso y caracterizarse de forma sistemática.[12]
Además de las histonas centrales y una histona de ligamiento, la fracción así aislada contiene topoIIa (CAP-B en ese estudio), un complejo de cinco subunidades denominado Condensina (CAP-C, -E, -D2, -G y -H),[12][13] cromo Kinesina (CAP-D/Klp1 y la ATPasa remodeladora de cromatina ISWI (CAP-F). Una de las conclusiones más importantes de estos estudios es que las ATPasas son componentes importantes de los cromosomas. La energía de hidrólisis del ATP es utilizada en muchos casos para inducir cambios locales o globales en los cromosomas, mientras que en otros casos sirve para soportar el movimiento de los cromosomas anclados a los microtúbulos.
Una observación sorprendente fue la identificación de la proteína titina como uno de los componentes de los cromosomas en embriones de Drosophila.
La titina es una proteína filamentosa gigante (~3 MDa) que funciona como un componente integral del filamento grueso en el sarcómero de las células musculares. Se ha propuesto que, en analogía con su función muscular, la isoforma de la titina que se encuentra en los cromosomas puede funcionar por un lado como una "regla molecular" que determina la longitud cromosómica, y por otro como un "muelle molecular" que proporciona elasticidad a los cromosomas.
El ARN
El ARN parece jugar algún papel en el plegamiento del cromosoma eucariótico. Al menos en humanos y en Drosophila se han encontrado evidencias de este papel estructural del ARN.
Sin embargo, hay que tener en cuenta que el armazón proteico descrito por Laemmli y colaboradores (1977) no se ve afectado por el tratamiento con ARNasa. Podría ser que las propias proteínas del armazón protegieran al ARN de la acción de la ARNasa.
En cualquier caso, es conveniente recordar que el ADN del cromosoma bacteriano también está organizado en dominios y que el ARN podría jugar algún papel en el mantenimiento de dicha estructura. En organismos con características intermedias entre las de procariontes y eucariontes como los dinoflagelados, también existen datos que apoyan el papel estructural del ARN en la organización cromosómica.
Elementos diferenciados en la estructura cromosómica
La organización de la cromatina no es uniforme a lo largo de la estructura del cromosoma. De hecho, se pueden distinguir una serie de elementos diferenciados: los centrómeros (o constricciones primarias), los Telómeros (o extremos cromosómicos), las Regiones organizadoras del nucléolo (NORs según la abreviatura en inglés) y los Cromómeros, todos ellos caracterizados por contener secuencias específicas de ADN.[1]
Regiones organizadoras del nucléolo
Además de las constricciones primarias, en algunos cromosomas se puede distinguir otro tipo de "adelgazamiento" denominada constricción secundaria, las que se hallan relacionadas normalmente con la presencia de las secuencias de ADN ribosómico. Tales regiones se denominan "Regiones organizadoras del nucléolo" (o, sencillamente, "NORs" por el acrónimo en inglés para nucleolus organizer regions).
Las secuencias de ADN ribosómico quedan englobadas dentro del Nucléolo, que permanece adosado a las NORs durante buena parte del Ciclo celular.[1] Los cromosomas con NOR en muchos casos presentan un segmento que une a esta región con el telómero, el cual se denomina satélite o trabante.[14]
Cromómeros
Los cromómeros son "engrosamientos" o regiones más compactadas de la eucromatina, que se distribuyen de manera más o menos uniforme a lo largo de los cromosomas y se pueden visualizar durante las fases de la mitosis o de la meiosis de menor condensación de la cromatina (profase).
Su naturaleza molecular sigue siendo controvertida, pero podrían ser consecuencia de un cierto grado de compartimentalización en la distribución de las secuencias de ADN y en la organización de los cromosomas.
Desde hace varios años, el grupo de Giorgio Bernardi en Italia, sostiene que hay una distribución compartimentalizada de secuencias relativamente grandes de ADN (llamadas "isócoras") en el genoma de los Vertebrados de sangre caliente, de modo tal que cada isócora tiene un contenido en bases (porcentaje de C+G) relativamente homogéneo pero diferente al de las demás.
Después de publicado el primer borrador del "Proyecto Genoma Humano", parece confirmarse la existencia de cinco isócoras en el genoma de los humanos, dos de ellas ricas en A y T, y tres ricas en G y C. La distribución alternante de ambos tipos de isócoras podría ser la explicación molecular de la existencia de cromómeros.
Estructura externa de los cromosomas: número, forma y tamaño
El estudio de la estructura externa de los cromosomas de cualquier especie eucariótica consiste en analizar la forma, tamaño y número de los cromosomas que posee. El mejor momento para llevar a cabo dicho estudio suele ser aquel en el que los cromosomas han alcanzado su máximo grado de contracción y tienen sus bordes perfectamente definidos. Dicho momento suele ser la Metafase mitótica.
El estudio de la estructura externa de los cromosomas culmina con la obtención del Cariotipo.[15] Los cromosomas se pueden estudiar en distintos momentos según la especie y dependiendo de los objetivos planteados.
Algunas especies tienen cromosomas que se pueden observar con gran detalle en Interfase, tal es el caso de Drosophila melanogaster, que posee cromosomas politénicos gigantes que se observan en las glándulas salivales de dicho insecto, y el de Chironomus tentans, otro díptero.
El cariotipo se confecciona usualmente después de un apropiado pre-tratamiento y tinción de las células, para hacer más visibles los cromosomas individuales.
Al diagrama simplificado de los cromosomas metafásicos del cariotipo se lo denomina Idiograma, que se construye con el Número genómico. Para realizar el ordenamiento de los cromosomas tanto en cariotipos como idiogramas se debe tener en cuenta el tamaño cromosómico (ubicados de mayor a menor, con el brazo corto “bc” o "p" hacia arriba y el brazo largo “bl” o "q" hacia abajo); posición del centrómero (generalmente alineados) y presencia de constricciones secundarias y satélites.[15]
Cromosomas sexuales
En muchos organismos, uno de los pares de los cromosomas homólogos es distinto al resto, realizando la determinación del sexo del individuo. A estos cromosomas se les llama cromosomas sexuales o heterocromosomas e incluso gonosomas, porque determinan el sexo.
- Sistema de determinación XY: es propio del ser humano y muchos otros animales. Las Hembras, siendo XX, darán Gametos iguales con Cromosoma X, sexo homogamético y los machos, siendo XY, darán dos tipos de gametos, uno con el cromosoma X y otro con el Cromosoma Y. La probabilidad de que en la Fecundación, al unirse los gametos, resulte una combinación XX (hembra) o XY (macho) es aproximadamente del 50%.
- Sistema de determinación ZW: en otras especies (mariposas, p.e.) ocurre lo contrario, el sexo masculino es homogamético (ZZ) y el femenino heterogamético (ZW).
- Sistema de determinación XO: otras especies (peces, insectos, anfibios) que no tienen el cromosoma Y, determinándose el sexo por el número de cromosomas X, macho XO y hembra XX.
Forma de los cromosomas
La forma de los cromosomas es para todas las células somáticas constante y característica de cada especie. La forma depende fundamentalmente de las constricciones que presente el cromosoma y de su localización en la cromátida.
El cromosoma se encuentra constituido básicamente por el centrómero que divide el cromosoma en un brazo corto o brazo p y un brazo largo o brazo q. Algunos cromosomas presentan satélites en el brazo corto.
Según la posición del centrómero, los cromosomas se clasifican en:
- Metacéntricos
- El centrómero se localiza a mitad del cromosoma y los dos brazos presentan igual longitud.
- Submetacéntricos
- La longitud de un brazo del cromosoma es algo mayor que la del otro.
- Acrocéntricos
- Un brazo es muy corto (p) y el otro largo (q).
- Telocéntricos
- Sólo se aprecia un brazo del cromosoma al estar el centrómero en el extremo.
El par de gonosomas o sexocromosomas se constituyen por X (submetacéntrico mediano) y Y considerado acrocéntrico sin satélites, aunque en algunas revisiones de la literatura se le refiere como submetacéntrico.
Tamaño cromosómico
Los cromosomas sufren grandes variaciones en su tamaño a lo largo del Ciclo celular, pasando de estar muy poco compactados (Interfase) a estar muy compactados (Metafase), por tal motivo, los estudios sobre el tamaño suelen realizarse en metafase mitótica.
Además, es necesario tener en cuenta que los tratamientos para teñir los cromosomas y para obtener las metafases mitóticas influyen de manera muy importante en el tamaño de los cromosomas.
En cualquier caso, en general es posible decir que hay especies eucarióticas con cromosomas grandes y especies con cromosomas pequeños. Las Monocotiledóneas (vegetales) y los Anfibios y Ortópteros (animales) poseen cromosomas muy largos (de 10 a 20 micras).
Las Dicotiledóneas, las Algas, los Hongos y la mayoría de las especies animales poseen cromosomas pequeños (longitud inferior a 5 micras). Naturalmente, existen algunas excepciones en los ejemplos citados. El cromosoma 1 humano tiene 0,235 pg de ADN, que equivalen a una longitud total de ADN doble hélice de 7,3 cm y en metafase mitótica presenta una longitud aproximada de 0,001 cm.
Bandeo cromosómico
En algunas especies los pares cromosómicos no pueden diferenciarse claramente considerando sólo sus componentes distintivos en sentido longitudinal; en estos casos se debe recurrir a técnicas citológicas especiales para la tinción de los cromosomas, que evidencian "bandas" transversales (oscuras y claras) a lo largo de los mismos, y que corresponden a los distintos tipos de cromatina.
En una especie dada, estas variantes de la cromatina presentan un tamaño y disposición constante. Las técnicas de bandeo cromosómico más usadas son:
- Bandeo C : es relativamente sencilla, y se basa en el uso del colorante Giemsa que tiñe regiones con heterocromatina constitutiva, que en vegetales se halla localizada principalmente en regiones teloméricas, mientras que en animales, se encuentra en regiones centroméricas.
- Bandeos G, R, Q : son técnicas basadas en tratamientos enzimáticos que ponen de manifiesto distintos patrones de bandas de la eucromatina a lo largo del cromosoma. El material se tiñe con colorante Giemsa (G, R) ó colorantes fluorescentes, como la Quinacrina (Q).
Son las bandas más estudiadas en animales y en el hombre. En los vegetales son muy difíciles de obtener por el alto grado de empaquetamiento de los cromosomas metafásicos.
- Bandeo NOR : permite identificar cromatina con secuencias medianamente repetidas de ADNr, asociada a las regiones NOR del cromosoma. El número total y localización de las regiones NOR es variable, por lo cual, como ya se expresó, además de su importancia funcional tiene valor cariotípico.[15]
Técnica de estudio
Es posible visualizar los cromosomas por medio de la Microscopía de luz y de tinciones especiales. El proceso para obtener el material cromosómico se realiza en diversos pasos, que incluyen la obtención de una muestra viva, la siembra e incubación de la misma y la posterior tinción y lectura.
Tipos especiales de cromosomas
Existen algunos tipos de cromosomas presentes sólo en algunos tipos celulares o en poblaciones concretas de una Especie. Entre ellos, destacan los cromosomas politénicos, en escobilla, cromosomas B e Isocromosomas.
Cromosomas politénicos
Las células de las glándulas salivares de los Insectos del orden de los Dípteros presentan núcleos que se hallan en una interfase permanente. Durante el crecimiento y desarrollo de las larvas de estos insectos, la división celular se detiene en algunos tejidos pero las células continúan su crecimiento por incremento de volumen.
Este proceso ocurre, por ejemplo, en los tubos de Malpighi, en las células nutricias de los Ovarios, en el epitelio intestinal y en las células de las glándulas salivares. En las células de tejidos mencionados, los cromosomas sufren rondas repetidas de duplicaciones pero sin separarse, proceso conocido como Endomitosis. Esto lleva a la producción de cromosomas constituidos por varios cientos o aún miles de hebras.
Durante este proceso de politenización o Politenia, los cromosomas incrementan tanto su longitud como su diámetro. De hecho, la longitud de los cromosomas de Drosophila en una metafase es del orden de 7,5 µm mientras que el largo total de los cromosomas en un núcleo de las glándulas salivares es de alrededor de 2.000 µm.[14]
Además del cambio en el tamaño, los cromosomas politénicos presentan otras dos características. En primer lugar, los cromosomas homólogos están asociados entre sí en toda su extensión. Esta condición, denominada apareamiento somático es propia de la mitosis de la mayoría de los Dípteros.
La otra característica peculiar es que los cromosomas muestran un patrón particular de bandeo transversal que consiste en zonas más oscuras, llamadas bandas, que alternan con zonas claras, llamadas interbandas. Cuando se observan al microscopio óptico se identifican como bandas oscuras y claras transversales alternantes.
Aunque la mayoría de las bandas son continuas a través del cromosoma, otras aparecen como una serie de puntos. Éste bandeo es reproducible de núcleo a núcleo, formando un patrón constante de tal manera que los cromosomas pueden ser identificados y mapeados en toda su longitud. Hay aproximadamente 5000 bandas y 5000 interbandas en total en el genoma de Drosophila melanogaster.
Debido a que el patrón de bandeo que presentan los cromosomas politénicos es un reflejo constante de las secuencias de ADN, las bandas sirven como marcadores para localizar varias características genéticas (lugar de los genes, o cambios en el genoma debido a reordenamientos cromosómicos, por ejemplo deleciones, duplicaciones de bandas y translocaciones) y se han utilizado en diversos estudios genéticos y evolutivos.[16]
En D. melanogaster el patrón de bandeo no se distingue en aquellas regiones heterocromáticas presentes en región centromérica de todos sus cromosomas (n=4). Las regiones heterocromáticas están asociadas formando un cromocentro.
Ya que dos miembros del complemento haploide de esta especie son metacéntricos (los cromosomas II y III) y dos son acrocéntricos (cromosoma sexual X o Y y el cromosoma IV), los cromosomas politénicos en esta especie aparecen como cinco brazos desiguales que irradian del cromocentro: un brazo correspondiente al cromosoma X, los dos brazos del cromosoma II y los dos brazos del cromosoma III (3L y 3R).
En algunos casos se puede visualizar un sexto brazo muy pequeño que representa el cromosoma IV.[14]
Cromosomas en escobilla
Los cromosomas en escobilla (también llamados cromosomas plumosos), observados por primera vez por Walther Flemming en 1882 en oocitos de salamandra (Ambystoma mexicanum),[17] son uno de los tipos de cromosomas más grandes y se hallan en los Oocitos de la mayoría de los animales, exceptuando a los mamíferos.
Se hallan durante el estadio de la Meiosis I denominado Diploteno. Luego de este relativamente largo período de la meiosis I, los cromosomas en escobilla vuelven a compactarse durante el período de Metafase I. Son estructuras transitorias, específicamente Bivalentes (es decir, dos cromosomas apareados cada uno de los cuales está formado por dos cromátidas hermanas).
Cada uno de los dos cromosomas está constituido por dos largas hebras que forman muchos "rulos" o "bucles", a la manera de un cepillo o escobilla, a lo largo del eje mayor del cromosoma. Esos "rulos" permiten que el ADN se halle disponible para el proceso de transcripción durante la maduración del ovocito.
De hecho, la presencia de cromosomas en escobilla en una célula es indicador de que está ocurriendo la transcripción del ARN mensajero.[18].
El nombre de "cromosomas en escobilla" ("lampbrush chromosome") fue acuñado por J. Rückert en 1892,[19] quien asimiló la forma de estos cromosomas a un cepillo del siglo XIX, bastante equivalente a o que actualmente se denomina "Limpiatubos".[18]
Cromosomas B
La mayoría de los organismos son habitualmente muy poco tolerantes a la adición o pérdida de material cromosómico, incluso en cantidades ínfimas. Así, alteraciones cromosómicas como las deleciones, duplicaciones y Aneuploidías (el exceso o defecto respecto al número cromosómico normal en una Especie dada) provocan en el individuo afectado desde malformaciones hasta inviabilidad en diferentes niveles del desarrollo.
Sin embargo, una excepción a este hecho en muchas especies animales y vegetales consiste en la existencia de cromosomas supernumerarios o cromosomas B. La distinción entre cromosomas B y los del complemento normal (cromosomas A) fue realizada por primera vez por Randolph en 1928.
En general, los cromosomas accesorios presentan las siguientes características:
- no son indispensables para la vida normal de sus portadores;
- no son homólogos de ninguno de los cromosomas A, de los que probablemente proceden;
- por lo general tienen sistemas de herencia irregulares y no mendelianos;
- morfológicamente, suelen ser más pequeños que los cromosomas del complemento normal, heterocromáticos y alocíclicos;
- en cuanto a su distribución, los cromosomas B varían en frecuencia
- dentro de poblaciones de la misma especie (por ejemplo, en el saltamontes Myrmeleotettix maculatus sólo se han encontrado cromosomas B en la parte sur de Gran Bretaña, no apareciendo ni en otras poblaciones del país ni en las poblaciones de países continentales adyacentes como Francia o Bélgica
- dentro de individuos de la misma población;
- dentro de células del mismo organismo (por ejemplo, en Aegilops mutica y Aegilops speltoides los B sólo están presentes en varias partes aéreas de las plantas, como Hipocótilos y ápices, y no en las raíces;
- en general carecen de genes mayores,no tienen efectos cualitativos sobre el Fenotipo y son dañinos para los individuos que los portan en número elevado.
Sin embargo, el término "cromosoma B" integra un conjunto heterogéneo de cromosomas, que varían tanto en su comportamiento como en su forma y tamaño, por lo que las generalizaciones deben realizarse con precaución.
Isocromosomas
Un Isocromosoma es un cromosoma metacéntrico anormal originado durante la meiosis o mitosis cuando la división del centrómero se produce según el plano horizontal en vez de vertical. Como consecuencia, uno de los brazos del cromosoma original se pierde y los brazos del isocromosoma resultante son genéticamente idénticos entre sí pero en sentido inverso.[15]
En los humanos, los isocromosomas se hallan asociados a ciertas enfermedades. Así, por ejemplo, se hallan en algunas niñas que presentan el Síndrome de Turner, en los pacientes con el Síndrome de Pallister-Killian y en algunos Tumores.
El isocromosoma "17q" (o sea, el isocromosoma formado por dos brazos largos del Cromosoma 17 y que ha perdido el brazo corto) y el isocromosoma "14q" están asociados a ciertos tipos de leucemia.
Además, los individuos portadores de isocromosomas pueden tener descendientes con mayor número de cromosomas que el normal.
El cromosoma en organismos procariotas
Los procariotas, Bacteria y Archaea, presentan típicamente un solo cromosoma circular, si bien existen algunas variantes a esta regla.El cromosoma bacteriano puede tener un tamaño desde 160.000 pares de bases (como en el endosimbionte Carsonella ruddii,a 12.200.000 pares de bases en la bacteria del suelo Sorangium cellulosum.
Las bacterias usualmente tienen un solo punto en su cromosoma desde el cual se inicia la duplicación, mientras que algunas archeas presentan múltiples sitios de inicio de la duplicación. Por otro lado, los genes de los procariotas están organizados en operones y no contienen intrones.
Los procariotas no poseen un núcleo verdadero, en cambio su ADN está organizado en una estructura denominada nucleoide. El nucleoide es una estructura distintiva y ocupa una región definida en la célula bacteriana.
Esta estructura es muy dinámica y se halla mantenida y remodelada a través de la acción de proteínas similares a histonas, las cuales se asocian al cromosoma bacteriano. En archaea, el ADN en el cromosoma se halla todavía más organizado, con el ADN empacado dentro de estructuras similares a los nucleosomas eucarióticos.
Cromosomas artificiales
Los cromosomas artificiales son cromosomas que han sido manipulados a través de herramientas de Ingeniería genética para que presenten estructuras precisas que permiten su integración, permanencia y duplicación en determinados organismos.[20]
El Cromosoma artificial de levadura o "YAC" (acrónimo inglés por Yeast artificial chromosome) es un tipo de Vector de clonación de alta capacidad siendo, de hecho, el de mayor capacidad (200 Kb a 3.000 kb).
Fueron descritos por primera vez en 1983.[21] Es un vector que imita las características de un cromosoma normal de una Levadura, ya que porta un centrómero y los telómeros terminales.
Esto permite clonar (es decir, multiplicar) en levaduras secuencias de ADN de hasta un millón de pares de bases o más, al comportarse como un cromosoma propio de la levadura.
Son utilizados en construcción de Genotecas genómicas, siendo muy extendido su uso en los primeros años del Proyecto Genoma Humano.[22] Sin embargo, son más inestables que otros vectores, tales como BACs (acrónimo inglés de "Bacterial artificial chromosome" o Cromosoma artificial bacteriano), que han acabado imponiéndose.[23]
Estos últimos son también vectores de clonación usados para clonar fragmentos de ADN de 100 a 300 kb de tamaño en la Bacteria Escherichia coli. Su estructura es análoga a la del Plásmido factor-F encontrado de modo natural en esa especie bacteriana.[1]
Véase también
Notas
a. Los pasos para realizar el estudio de los cromosomas humanos mediante técnicas convencionales son los siguientes:[24]
- Obtención de la muestra: se realiza exclusivamente de tejidos vivos que contengan células con núcleo. Principalmente se emplean los glóbulos blancos que se hallan en la sangre por su fácil accesibilidad.
- Siembra: la cual se realiza agregando aproximadamente 1 mililitro de sangre entera heparinizada a un medio de cultivo enriquecido con suero fetal bovino, antibióticos y mitógenos, lo cual estimulará el crecimiento y división de las células.
- Incubación: se mantiene a 38 grados centígrados con una atmósfera de CO2 al 5 % y humedad por 72 horas.
- Cosecha: Se agrega colchicina a la muestra para detener la Mitosis en metafase, posteriormente se cenfrifuga la mezcla para retirar el sobrenadante (suero sanguíneo y medio de cultivo).
Se agrega solución hipotónica de Cloruro de Potasio para romper las membranas celulares y para finalizar el paso de la cosecha se realizan 3 lavados con una solución de Metanol y Ácido acético.
- Goteo: con posterioridad a los lavados, por medio de centrifugación, se obtiene un botón celular blanco, el cual se suspende en la misma solución fijadora de metanol y ácido acético y se procede a gotear en un portaobjetos a unos cuantos centímetros, esto es con el objetivo de "reventar" las células y obtener los cromosomas.
- Envejecimiento: en este paso se espera a que la muestra pierda humedad. Se puede aplicar calor al portaobjetos para deshidratar la muestra.
- Tinción: existen muchos tipos de tinciones para observar los cromosomas. La más utilizada es la tinción con colorante Giemsa, se conoce como técnica de bandas GTG. En este caso se expone la muestra del portaobjetos a Tripsina, con el objetivo de desnaturalizar algunas de las proteínas constitutivas de los cromosomas.
Posteriormente se tiñen con dos colorantes, Giemsa y Wrigth, en algunos laboratorios puede emplearse un solo colorante, pero el empleo de los dos mejora la calidad del resultado, puesto que facilita el análisis al microscopio para el citogenetista creando un contraste de color en las bandas que se formaron al emplear la tripsina.
Por medio de estas bandas podemos distinguir las características de un cromosoma y determinar si es normal o presenta alguna anomalía estructural. Existen otras técnicas de tinción, como bandas NOR, ICH, bandas Q, bandas R, técnicas para teñir centrómero y heterocromatina. Con este tipo de técnicas se puede llegar a realizar un diagnóstico citogenético acerca de una enfermedad cromosómica.
- Lectura: el último paso consiste en observar por lo menos 20 placas metafásicas y formar un cariotipo o cariograma, donde se acomodan los cromosomas por grupos según el tamaño y la localización del centrómero.
Referencias
- ↑ 1,0 1,1 1,2 1,3 Piqueras, J.F., Fernández Peralta, A.M., Hernández, J.S., González Aguilera, J.J. 2002. Genética. Ariel Ciencia, España, 474 pp. ISBN: 84-344-8056-5
- ↑ 2,0 2,1 Kornberg ,Twenty-Five Years of the Nucleosome, Fundamental Particle of the Eukaryote Chromosome, http://www.rpgroup.caltech.edu/courses/aph161/Handouts/Kornberg1999.pdf
- ↑ Error en la cita: Etiqueta
<ref> inválida;
no se ha definido el contenido de las referencias llamadas FCA
- ↑ Isenberg, Annual Reviews in Biochemistry
- ↑ Grunstein ,Histone Function in Transcription, Annual Reviews in Cell BiologyfckLR
- ↑ Histone Genes and Histone Messengers,Annual Reviews in Biochemistry,volume 48,pages = 837–870fckLR
- ↑ Error en la cita: Etiqueta
<ref> inválida;
no se ha definido el contenido de las referencias llamadas Christensen2002
- ↑ The Making of the Mitotic Chromosome: Modern Insights into Classical Questions,Molecular CellfckLR,http://www.molecule.org/cgi/content/full/11/3/557fckLR
- ↑ The Bending Rigidity of Mitotic Chromosomes, Molecular Biology of the CellfckLR,http://www.molbiolcell.org/cgi/reprint/01-08-0382v1.pdffckLR
- ↑ Mitotic chromosomes are chromatin networks without a mechanically contiguous protein scaffoldfckLR,http://www.physics.ohio-state.edu/~mpoirier/papers/chromosome-no-scaffold.pdffckLR
- ↑ Higher order metaphase chromosome structure: evidence for metalloprotein interactions,http://www.ncbi.nlm.nih.gov/pubmed/7105181fckLR
- ↑ 12,0 12,1 fckLR A heterodimeric coiled-coil protein required for mitotic chromosome condensation in vitro,fckLRhttp://www.ncbi.nlm.nih.gov/pubmed/7954811fckLR
- ↑ Condensins, Chromosome Condensation Protein Complexes Containing Xcap-c, Xcap-e and a Xenopus …,fckLRhttp://cat.inist.fr/?aModele=afficheNfckLR
- ↑ 14,0 14,1 14,2 Panzera, F., Ruben Pérez y Yanina Panzera. Identificación cromosómica, cariotipo. Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata.
- ↑ 15,0 15,1 15,2 15,3 Facultad de Ciencias Agropecuarias. Universidad Nacional de Córdoba (Argentina). Genética. Capítulo 2. Forma y tamaño cromosómico. Cariotipo. [1]
- ↑ Gunderina, L. I. (2005) Divergence patterns of banding sequences in different polytene chromosome arms reflect relatively independent evolution of different genome components. Russian Journal of Genetics 41(4)
- ↑ Flemming W. 1882. Zellsubstanz, Kern- und Zelltheilung. Vogel, Leipzig.
- ↑ 18,0 18,1 Macgregor, H. Lampbrush chromosomes . School of Biosciences, University of Exeter.
- ↑ Rückert, J. 1892. Zur Entwicklungsgeschichte des Ovarialeies bei Selachiern. Anat Anz 7: 107-158.
- ↑ Basu, J. and Huntington F. Willard. Artificial and engineered chromosomes: non-integrating vectors for gene therapy. Trends in Molecular Medicine, Volume 11, Issue 5, May 2005, 251-258.
- ↑ Murray AW, Szostak JW (1983): Construction of artificial chromosomes in yeast, Nature 305, 2049-2054.
- ↑ Larin Z, Monaco AP, Lehrach H (1991): Yeast artificial chromosome libraries containing large inserts from mouse and human DNA, Proceedings of the National Academy of Sciences (USA) 88, 4123-4127.
- ↑ Bellanné-Chantelot C et al. (1992): Mapping the whole human genome by fingerprinting yeast artificial chromosomes, Cell 70, 1059-1068
- ↑ César Paz y Miño. 1999. Citogenética humana: manual de prácticas. Práctica 5: CULTIVO Y PREPARACION DE LINFOCITOS PARA ANALISIS CROMOSOMICO. Laboratorio de Genética Molecular y Citogenética Humana, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales y Facultad de Medicina. PONTIFICIA UNIVERSIDAD CATOLICA DEL ECUADOR.
Bibliografía
- Adolph, K. (ed.) 1988.Chromosomes and chromatin, Vols. 1-3, Boca RAton, FL; CRC Press.
- Hsu, T.C. 1979.Human and mammalian cytogenetics: an historical perspective. New York, Springer Verlag.
- Stewart, A. 1990. The functional organization of chromosomes and the nucleus, a special issue. Trends Genet. 6:377-379
- Price, C.M. 1992. Centromeres and telomeres. Curr. Opin. Cell Biol. 4: 379-384.
- Gall, J.G. 1981.Chromosome structure and the C-value paradox. J. Cell Biol. 91:3-14
- Blackburn, E.H., Szostak, J.W. 1984. The molecular structure of centromeres and telomeres. Annu. Rev. Biochem. 53: 163-194.
Enlaces externos
