Estructura atómica de la materia
| ||||
La Sustancia y la Estructura Atómica. La formación del sistema terrestre surge millones de años antes que el hombre, por lo que la materia antecede a su existencia. ¿Qué se conoce sobre este término? ¿Qué grado de generalidad y universalidad se le concede?. El micro mundo de la sustancia y el átomo.
Sumario
Materia
Al alrededor se observa, quizás, una mesa, un vaso, la sal de cocina (cloruro de sodio), el agua, una lámpara encendida, y surjan las siguientes interrogantes.
- ¿Qué hay de común entre ellas?
- ¿Son objetivas o subjetivas?
- ¿Pueden ser reflejadas por la conciencia?
La materia es lo común a todas ellas, así se define materia como: “categoría filosófica que sirve para designar la realidad objetiva, que es dada al hombre en sus sensaciones, copiada, fotografiada, reflejada por nuestras sensaciones y que existe independientemente de ellas”4. [1].
Para los físicos la materia es todo aquello que se extiende en cierta región del espacio-tiempo, que posee energía y está sujeto a cambios en el tiempo y a interacciones con aparatos de medida. Se considera que es lo que forma la parte sensible de los objetos perceptibles o detectables por medios físicos.
La diferencia entre los ejemplos referidos, al inicio, se encuentra en las partículas que lo forman. Así en las tres primeras las partículas o entidades elementales fundamentales que la forman son el protón (p), el neutrón (n), y el electrón (e) que poseen masa en reposo. La partícula que caracteriza a la luz, emitida por la lámpara es el fotón, la que se encuentra en continuo movimiento
El científico alemán Albert Einstein en 1903 estableció la relación entre la masa en movimiento y la masa en reposo, demostrando que la masa de un cuerpo en movimiento supera su masa en estado de reposo.
Einstein demostró, a su vez, que el movimiento conlleva a un aumento de la energía, derivando una de las más importantes expresiones: ∆E = ∆ mc2.
Donde E = energía, m = masa y c = velocidad de la luz.
Su interpretación cualitativa nos informa que a cada masa le corresponde una cantidad definida de energía. Los fotones tienen masa en dependencia de la frecuencia de ondas o número de oscilaciones por segundo.
Define, por tanto, el tipo de partícula la variedad cualitativa de la materia, la sustancia y el campo. De las dos variedades de la materia, es la sustancia la más importante en los estudios químicos.
La Sustancia
Sustancia, una clase particular de materia homogénea cuya composición es fija y químicamente definida. A la luz de los ejemplos analizados se conceptualiza como una variedad cualitativa de la materia caracterizada por tener masa en reposo.
Una característica de la sustancia es su discontinuidad, aspecto que hace posible se perciba, a distancia el olor de un perfume, u otro tipo de sustancia, o también el porqué si a un vaso rebosante de agua se le coloca un papel humedecido y se le colocan unos cristales de permanganato de potasio, su color violeta comienza a descender poco a poco, hasta que toda el agua toma su color, la discontinuidad de las partículas que forman al agua y las del permanganato hacen posible que se entre mezclen.
Esta característica de la sustancia permite la demostración de determinadas propiedades, las cuales pueden ser estudiadas bajo dos criterios: el de la estructura interna y el de la masa.
De la estructura interna, se encuentran las propiedades físicas y químicas, siendo las físicas, aquellas que no provocan cambios en la estructura interna de la sustancia, ejemplos de ellas densidad, calor, fusión, tanto por ciento. Químicas, son las que provocan cambios en la estructura interna de la sustancia, como ejemplo la oxidación de un clavo de hierro, correspondiente a la reacción del metal con el dioxígeno, en ellas se evidencia, de forma general, una manifestación externa.
De la masa, clasificadas a su vez como extensivas, aquellas propiedades que dependen de la masa o del tamaño del cuerpo, entre las que se pueden citar, la capacidad calorífica, el volumen, entre otras; y las intensivas, las que no dependen de la masa o del tamaño de un cuerpo, encontrándose entre estas la densidad, temperatura, presión.
Las sustancias están constituidas por especies químicas diferentes, en dependencia de determinados parámetros, como son las características de los componentes (elementos químicos) que la forman, su interrelación y enlace adoptan diferentes estructuras de la que dependen sus propiedades y de ellas las aplicaciones.
Desde la antigüedad más de 400 años antes de nuestra era, filósofos griegos como, Demócrito (470-360 a.n.e.), Epicuro (372-271), Lucrecio (95-55), dedicaron su tiempo a dilucidar la composición de las sustancias, explicaron que el mundo está formado por partículas en continuo movimiento y que componen a todas las sustancias.
Las ideas de estos filósofos, revolucionarias para su tiempo y de basamento materialista, se oponían a las creencias oscurantistas de la época y fueron tildados de herejes, condenados, muchos de ellos, a morir en la hoguera.
Demócrito en su teoría defiende seis ideas básicas, por su importancia y grado de generalización se citan tres de ellas:
- Nada proviene de la nada. Nada de lo que existe puede ser destruido. Todos los cambios se deben a uniones y separaciones de moléculas.
- Las únicas cosas existentes son los átomos y el vacío, todo lo demás es una mera opinión.
- Los átomos son infinitos en números e infinitamente variados en forma, chocan entre si y las traslaciones y rotaciones así provocadas, son el comienzo de los mundos.
En estas ideas, se deja sentado la importancia de la sustancia y su transformación como ente promotor de la evolución de la ciencia y el mundo y como centro de las mismas la introducción de un nuevo término: átomo.
El Átomo
Etimológicamente la palabra átomo proviene del griego y significa a (sin) tomo (división), en esa época se consideraba al átomo indivisible.Se define al átomo como la más pequeña partícula no elemental que puede intervenir en una transformación química.
Los conceptos atomísticos fueron remplazados por las ideas aristotélicas, quién recibió el apoyo de la iglesia, pero no fue hasta el siglo XVII que se ve reconocido el trabajo de los científicos griegos, con los trabajos del químico ruso Lomonosov que da un impulso significativo a la teoría atómica, fue el primero en diferenciar las moléculas de los átomos.
El mundo subatómico comenzó a salir a la luz con los trabajos de G.J.Stoney, 1874 quien definió a la menor carga de una partícula de electricidad que puede ser transportada, con el nombre de electrón, luego los trabajos del físico inglés J.J. Thomson utilizando los tubos catódicos y sus conocimientos de la teoría electromagnética determinó la relación carga masa (q/m). En 1897-1900 el físico estadounidense R.A. Millikan determina la carga de 1, 6020. 10 -19 y a través de la relación q/m, se determinó su masa 9, 1095. 10-28 g.
Al conocerse que el átomo era neutro se suponía la existencia de otra partícula de carga contraria que neutralizaba el efecto negativo de los electrones. Son los experimentos de Thomson y el químico-físico inglés Rutherford, 1906 en los tubos de descarga de los rayos catódicos, descubren la existencia, en un punto minúsculo del átomo, una zona que desviaba los rayos negativos o viajaban en dirección opuesta a estos, por lo que tendrían carga positiva denominándola protón y posteriormente se determinó su masa era de 1, 67252. 10-24 g mucho más superior que la del electrón.
El científico inglés J. Chadwick en 1932, comprueba la existencia de otra partícula de masa similar al protón pero que carecía de carga y se concentraba también en una zona del átomo, a la que llamó neutrón.
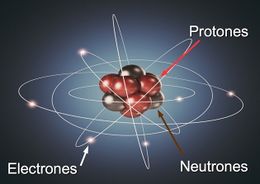
Es el modelo planteado por Rutherford en su estudio con materiales radioactivos, en 1914, quién demuestra la existencia de dos zonas en el átomo, el núcleo donde se concentra su masa y carga positiva y una envoltura de masa despreciable y de carga negativa.
Así se reconoce en el átomo al núcleo centro o corazón del átomo que está compuesto fundamentales por las partículas protón y neutrón y la nube electrónica rodeando al núcleo, donde se encuentran los electrones en una especie de nube, pero organizados, según la teoría cuántica en capas energéticas, que determinan en las propiedades de los átomos y elementos químicos.
Así se identifican entre las partículas elementales del átomo, el electrón, partícula con carga eléctrica negativa de masa despreciable y que se encuentra en la envoltura del átomo.
Neutrón, partícula elemental que se encuentra en el núcleo del átomo con carga eléctrica neutra y masa ligeramente superior y al protón: partícula elemental de carga positiva y masa considerable.
Los modelos atómicos de Bohr y Schrödinger, al introducirse la teoría cuántica, en la segunda década del Siglo XX, completan el conocimiento del átomo existiendo en él mismo zonas de probabilidad de encontrar al electrón denominadas como orbital atómico y declarando que la energía del átomo está cuantificada, caracterizada por los valores de los números cuánticos. Los átomos se enlazan y forman infinidad de sustancias o agregados atómicos.
Unión estructural de los átomos
La unión estructural que puede surgir entre los átomos, en infinidad de ellas, se define como molécula, hoy debemos añadir que estas definiciones se caracterizan por presentar enlace covalente entre los mismos y la estructura que la caracteriza es simétrica en relación a la polaridad de la misma. Las sustancias donde la diferencia de electronegatividad de los átomos que la forman es mayor de 1,5 y/o la estructura es asimétrica, en su polaridad eléctrica, se denominan sustancias iónicas siendo las partículas que la forman iones. El ion se conoce como un átomo o grupos de ellos que posee carga eléctrica, pudiendo ser positivas y se llaman cationes o negativas y se nombran aniones.
En la tabla periódica, más actualizada, pudieran aparecer reflejado hasta 107 tipos de átomos, identificados por los elementos químicos, sin embargo, se conocen hasta nuestros días 600 variedades de átomos, es debido que todos los átomos que forman al elemento químico no tienen la misma composición elemental, así se encuentran los denominados:
- Isótopos: núclidos de un mismo elemento que poseen, por ello, igual número atómico (z) i diferente índice de masa (A).
- Isóbaros: núclidos de diferente elemento que, por ello, poseen diferente z pero igual A.
- Isótonos: núclidos que presentan diferentes A, diferente Z pero igual número de neutrones (n).
Donde el índice de masa está determinado por el número de protones y neutrones que tiene el átomo (A = p + n).
Hoy se identifica al elemento químico como el conjunto de átomos que posee igual número atómico, siendo este concepto, número atómico fundamental en las propiedades del mismo, y determinado por el número de electrones que posee el átomo en su envoltura y de protones en el núcleo por su condición de neutralidad eléctrica.
Valores cuantitativos del átomo
Para realizar los cálculos de las masas atómicas y se toma la doceava parte del núclido más ligero y abundante del carbono, el 12C para calcular la unidad de masa atómica (u), así se llega a:
1u = m (12C)/ 12 = 1,992 685. 10-26/ 12
1u = 1, 660 57. 10-27 kg
Este número es conocido como número de Dalton en honor al científico que realiza el estudio. Se conformaron las masas atómicas relativas de todos los restantes núclidos dividiendo sus masas atómicas absolutas entre la unidad de masa atómica (u): Ar(ZAX)/ u
Como se conoce que los elementos están formados por varios núclidos, para obtener la masa atómica relativa de cada uno de ellos se hizo necesario tener en cuenta la masa de cada uno y su abundancia en un promedio de los mismos, de ahí que se diga que las masas atómicas de los elementos son masas relativas y promedio.
Para el oxígeno se tienen los siguientes resultados.
| Núclidos | Ar(8AO) | Composición isotópica
(% en abundancia) |
|---|---|---|
| 16O | 15, 994 9 | 99, 758 7 |
| 17O | 16, 999 1 | 0, 037 4 |
| 18O | 17, 999 2 | 0, 203 9 |
Ar(O) = (15, 994 9 .99, 758 7 + 16, 999 1 . 0, 037 4 + 17, 999 2 . 0, 203 9) 100 Ar(O) = 15, 999 4 u
De igual forma se conformó la masa atómica relativa de todos los elementos conocidos.
Las masas fórmulas relativas estaría en dependencia de la composición del compuesto, así para el agua (H20),
Mr(H2O)= (2Ar(H) + Ar(O) = (2.1 + 15,999) Mr(H2O)= 17,999 u
Se hizo posible el cálculo químico, aspecto de trascendental importancia en el trabajo de laboratorio y de las industrias para lograr elevar la eficiencia de los ensayos y procesos. Para ello es necesario conocer y tener bien definido un grupo de conceptos y magnitudes químicas que permiten la solución de problemas químicos en el orden cuantitativo.
La masa molar es un concepto asociado numéricamente a la masa fórmula relativa referida en el párrafo anterior, M(X) = Mr(X). Solo que está expresada en g/mol pues resulta de la ecuación de definición de una de las magnitudes químicas reconocidas por el sistema internacional de unidades la de cantidad de sustancia, denotada por la letra n. Masa Molar M(X) se define, por tanto, como la masa contenida en un mole de sustancia numéricamente igual a la masa fórmula relativa.
La ecuación de definición de la cantidad de sustancia viene dada por la expresión: n(X) = m(X) / M(X), realizando el análisis dimensional de la misma su unidad de medida sería: g/g.mol- = mol.
¿Cómo se define a la cantidad de sustancia y a su unidad el mole?
Cantidad de sustancia n(X): “valora el número de partículas o entidades elementales(X) que hay en una muestra dada de sustancia”. ¿Por quién vienen dadas las partículas o entidades elementales? Están dadas por átomos, moléculas, iones, electrones, según las características de la sustancia o entidad a referirse.
El mole: “cantidad de sustancia de un sistema que contiene tantas partículas o entidades elementales como átomos hay en 0,012 kg de carbono 12 (12C)”.
¿Cuál es el valor de los átomos de 12C contenidos en esos 0,012 kg?
Como ya se conoce un átomo de carbono pesa 1, 992 685. 10-26kg, si se divide 12.10-3 kg / 1, 992 685. 10-26kg se obtiene el valor 6,02.1023 adimensional. Este número, en honor al científico investigador se conoce como número de Avogadro (N0).
Así en cada mole de sustancia habrá ese número de entidades elementales, por lo que si se expresa 6,02.1023/ 1 mol tendríamos una constante 6,02.1023 mol-1 denominada constante de Avogadro y representada por NA = 6,02.1023 mol-1
Pudiendo representar la ecuación de definición de la cantidad de sustancia en función del número de partículas o entidades elementales quedando que: n(X) = N(X) / NA
En el trabajo con el cálculo, en especial para sustancias en estado gaseoso, hay otro número de extraordinaria importancia reconocido como el volumen molar (vm): “volumen que ocupa un mol de un gas en condiciones específicas”.
Estas condiciones pueden darse a temperatura y presión estándar ambiental (TPEA=105Pa y 25oC) o temperatura y presión normal (TPN=105Pa y 0oC), el valor del volumen molar sería para las condiciones TPEA = 24,8 L.mol-1 y TPN= 22,4L.mol-1
La cantidad de sustancia puede, entonces quedar expresada también en función del volumen y sería su ecuación de definición: n(X) = v(X) / vm
Ecuaciones de definición magnitud química: cantidad de sustancia
La cantidad de sustancia, es una magnitud química de gran importancia para los cálculos químicos matemáticos, puede expresarse atendiendo a tres ecuaciones diferentes, en dependencia del concepto químico y magnitud física a utilizar, quedando expresada en:
n(X) = m(X) / M(X) n(X) = N(X) / NA n(X) = V(X) / vm
Entre todas es posible establecer una relación, que permite una solución más factible en el cálculo matemático, quedando de la siguiente forma:
n(X) = m(X) / M(X) = N(X) / NA = V(X) / vm
Obsérvese, en la solución a un problema, la utilidad en el cálculo de algunas de estas magnitudes. Calcular en una muestra de 14,62 g de cloruro de sodio el número de iones sodio y cloruro que están contenidos en la misma.
a) ¿A qué cantidad de sustancia de cloruro de sodio se refiere dicha muestra?
Datos: M(NaCl) = 58,5 g/mol
m(NaCl) = 14,62 g
NA = 6,02.1023mol-1
1 mol NaCl = 1 mol iones Na+1= 1mol de Cl-1
Ecuación de definición según los datos: m(X) / M(X)= N(X) / NA
Sustituyendo los valores: 14,62 g/ 58,5 g.mol-1 = N(NaCl) / 6,02.1023mol-1
Despejando y operacionalizando: N(NaCl) = 14,62 g. 6,02.1023mol-1 / 58,5 g.mol-1
Calculando: N(Na+) = N(Cl-) 1,5 . 1023 iones
b) Ecuación de definición según interrogante: n(X) = m(X) / M(X)
Sustituyendo los datos: n(X) = 14,62 g / 58,5 g.mol-1
Calculando: n(X) = 0,249 mol
Referencias bibliográficas
- ↑ « León, R. (1991). ”Química General Superior. Caps.10 y 11. Págs. 425 – 537. Editorial Pueblo y Educación. La Habana Cuba. »
Fuente
- Alfa Rosa de Lara Piñeiro, et. al. (1987). Química General. Cap. 1. Editorial Félix Varela. La Habana Cuba.
- Cedrón. M.H. et. al. (2010). “Química General”. Cap.1. Págs. 11 – 61. Editorial Félix Varela. La Habana Cuba.
- Diccionario de la Real Academia de España. 23 ediciones. 2014. ISBN 978.84-670-4180-7. » </ref>
- León, R. (1991). ”Química General Superior. Caps.10 y 11. Págs. 425 – 537. Editorial Pueblo y Educación. La Habana Cuba.
- Zita, A. (2016). “El Átomo”. Universidad central de Venezuela. https//www.toda materia.com/átomo/