Tabla periódica de elementos
| ||||||||
Tabla Periódica de Elementos Químicos. Esta clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características. La misma se le atribuye al químico ruso Dimitri Ivanovich Mendeléiev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléiev, fue diseñada por Alfred Werner.
Sumario
Historia
Ya desde la antigüedad eran conocidos algunos elementos químicos, siendo los alquimistas los artífices fundamentales de estos conocimientos químicos antes de llegar a definirse esta ciencia como tal. El oro (Au), la plata (Ag), el plomo (Pb) y otros elementos como el mercurio (Hg), el azufre (S), el arsénico (As), el estaño (Sn) y otros desde épocas antiguas, hasta descubrimientos más actuales como el fósforo (P) en 1669. Esto permitió que Antoine Lavoisier escribiera una lista de sustancias simples de 33 elementos, pero en 1830 está lista estaba ampliada a 55 elementos simples la cual se amplio con la invención del espectroscopio.
El estudio de las propiedades comunes y su clasificación, el surgimiento de la noción de masa atómica fueron formando los cimientos bajos los cuales se hizo posible el descubrimiento de la periodicidad de los elementos químicos en base a su número atómico y propiedades químicas teniendo como base un número suficiente de elementos individuales de la misma.
Elemento Químico
El propio concepto de elemento en su noción moderna se consolido a lo largo del siglo XVII, donde se le denomina elemento a
Primeras Tablas
Ya en el siglo XVIII aparecen las tablas de afinidad, en un intento de entender la composición química y ordenar los elementos. Además permitió diferenciar en esa época que sustancias eran elementos químicos, y cuales no, así como sus propiedades y como obtenerlos.
Atomismo de Dalton
A principios del siglo XIX, comienza el desarrollo de una nueva concepción del atomismo gracias a los trabajos de John Dalton. los mismos se integraban a la definición de elementos dada por Lavoisier y otras leyes obtenidas empíricamente en aquellos tiempos. Dentro de ellas las leyes de las proporciones fueron utilizadas por Dalton para suponer como se combinaban los átomos estableciendo como unidad de referencia la masa de un átomo de hidrógeno (H) (además de usar como referencia la masa de un átomo de hidrógeno se utilizaron otros). y partir del mismo calculo el resto de las masas o pesos atómicos, por medio de esto pudo construir un sistema de masas atómicas relativas.
Clasificaciones de los Elementos Químicos
Clasificación de Lavoisier
El propio Lavoisier dio la primera clasificación de elementos agrupando los mismos en:
- metales
- no metales
- metaloides o metales de transición
el cual fue rechazado producto de que existían muchas diferencias entre las propiedades físicas como químicas de los elementos agrupados.
Triadas de Döbereiner
Otro intento por agrupar los elementos químicos con propiedades similares, fue dado por el químico alemán Johann Wolfgang Döbereiner, el cual puso de manifiesto el parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último, llamando a estos elementos triadas, hallándose en 1850 hasta 20 de estas manifestando la existencia de cierta regularidad entre los elementos químicos.
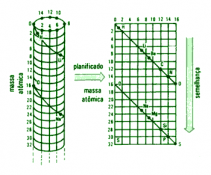
Hélices de Chancourtois
En 1864, Chancourtois construyó una hélice de papel, en la que se estaban ordenados por pesos atómicos los elementos conocidos, arrollada sobre un cilindro vertical. Se encontraba que los puntos correspondientes estaban separados unas 16 unidades. Los elementos similares estaban prácticamente sobre la misma línea vertical, lo que indicaba una cierta periodicidad, pero su diagrama pareció muy complicado y recibió poca atención.
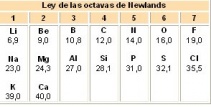
Ley de las Octavas de Newlands
En 1864 el químico inglés John A. Reina Newlands creo la ley de octavas, al percatarse que al ordenar los elementos en orden creciente de sus pesos atómicos (obviando el hidrógeno), el octavo elemento a partir de cualquier otro tenia propiedades muy similares al primero a partir del cual se contó.
Esta regularidad permitió la ordenación de los elementos en familias o grupos con propiedades muy parecidas entre sí y en periodos formados por ocho elementos cuyas propiedades iban variando progresivamente.
Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica.
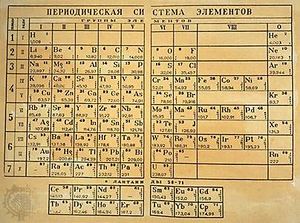
Tabla Periódica de Mendeleiev
En 1869 Mendeleiev pubicó su primera tabla de elementos en Alemania, un año después lo hizo Julius Lothar Meyes.
En esta tabla los elementos se colocaron por orden creciente de sus masas atómicas, así como en un mismo grupo los elementos con propiedades comunes como la valencia. La primera clasificación periódica de Mendeléiev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B. En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos. Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire. El químico ruso no aceptó en principio tal descubrimiento, ya que esos elementos no tenían cabida en su tabla. Pero cuando, debido a su inactividad química (valencia cero), se les asignó el grupo cero, la Tabla Periódica quedó más completa.
El gran mérito de Mendeléiev consistió en pronosticar la existencia de elementos. Dejó casillas vacías para situar en ellas los elementos cuyo descubrimiento se realizaría años después. Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka–aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka–sicilio; el escandio (Sc); y el tecnecio (Tc), que, aislado químicamente a partir de restos de un sincrotrón en 1937, se convirtió en el primer elemento producido de forma predominantemente artificial.
Además de su tabla, Mendeleiev propuso la ley periódica donde se establecía que: Todos los elementos deben acomodarse en forma ascendente a partir de su masa atómica, sin embargo, ésta presentó problemas, pues algunos elementos no parecían tener lugar adecuado en la tabla de acuerdo a sus masa atómicas, ya que sus propiedades no eran similares a las de los elementos que les precedían o eran diferentes a los de los elementos del grupo que les correspondía.
Más tarde al conocer mejor la estructura atómica de los elementos, encontró mayor periodicidad en las propiedades físicas y químicas, ordenando los elementos en forma creciente basándose en su número atómico. A partir de esta clasificación, se modificó la ley periódica de Mendeleiev, estableciéndose la ley periódica moderna.
Tabla de Elementos Químicos
La tabla o sistema periódico es la forma gráfica de la Ley periódica, es el esquema de todos los elementos químicos dispuestos por orden de número atómico creciente y en una forma que refleja la estructura de los elementos. Su base es la "Ley Periódica", la cual establece que las propiedades físicas y químicas de los elementos tienden a repetirse de forma sistemática conforme aumenta el número atómico. Todos los elementos de un grupo presentan una gran semejanza y, por lo general, difieren de los elementos de los demás grupos.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Periodo | ||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
| 6 | 55 Cs |
56 Ba |
* | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Uut |
114 Fl |
115 Uup |
116 Lv |
117 Uus |
118 Uuo |
| Lantánidos | * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|
| Actínidos | ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles y Transactínidos |
Tipos de tabla
Cada autor siente la tentación de dibujar una tabla donde, según él, se manejan mejor los conceptos de periodicidad química. Las tablas más importantes son las que comúnmente se conocen como: Tabla corta, Tabla larga y Tabla larga extendida
Tabla corta
Derivación directa de la Tabla periódica de 8 columnas propuesta original de Mendeleiev-Meyer; se le fueron introduciendo modificaciones a medida que se avanzaba en el tiempo y en el conocimiento; ya se advierte la presencia de un grupo vertical más; el grupo gases nobles, desconocidos por Mendeleiev.
Tabla larga
Modificación muy útil, que también suele ser conocida como tabla de Borh. Se construye de tal forma que refleja la teoría de Borh sobre la distribución electrónica. En las verticales se encuentran los elementos cuya distribución electrónica final es coincidente, en esencia la tabla larga deriva de la original de Mendeleiev, extendiendo los períodos largos (cuarto, quinto y sexto) y cortando en dos los períodos cortos para acomodar en el medio a las series de los elementos de transición. Así se generan períodos largos pero solo a partir del cuarto período.
En este tipo de tabla, cada periodo corresponde a la formación de una nueva capa de electrones. Los elementos alineados tienen estructuras electrónicas estrictamente análogas. El principio y el final de un periodo largo representan la adición de electrones en una capa de valencia; en la parte central aumenta el número de electrones de una capa subyacente.
La tabla de forma larga fue elaborada por Alfred Werner. Esta tabla está integrada por todos los elementos encontrados en la naturaleza, así como los sintéticos, y se encuentran acomodados en función de la estructura electrónica de sus átomos, observándose un acomodo progresivo de los electrones de valencia en los niveles de energía (periodos). Los elementos que presentan configuraciones electrónicas externas similares, quedan agrupados en columnas verticales llamadas familias o grupos. Además, por facilidad de representación, aparecen dos filas horizontales fuera de la tabla que corresponden a elementos que deberían ir en el sexto y séptimo periodo, tras el tercer elemento del periodo. Horizontalmente los elementos químicos se agrupan en Grupos, los cuales van desde el grupo IA hasta el VIIIA, agrupando cada uno elementos con propiedades similares, los mismos se distribuyen en 18 columnas (esta tabla también se le conoce como la tabla periódica de 18 columnas). Además verticalmente se ordenan en periódos de siete elementos, los mismos van desde el primer hasta el séptimo elemento.
Se han propuesto diferentes tipos de tablas de formas largas:
- Tabla Periódica de 18 columnas.
- Separación en bloques de elementos.
- De forma separada.
Tabla larga extendida
Representación moderna, con el inconveniente de que los gráficos se hacen muy extensos, la misma sigue al recorrerla por número atómico creciente el llenado de órbitas propuesto por Borh; posee
- Tabla periódica de 34 columnas,
- Tabla Periódica de 32 columnas, etc.
El primer periodo tiene dos elementos, el segundo y tercero tienen ocho, el cuarto y quinto tienen 18 elementos, el sexto período 32 elementos y el séptimo hasta el momento se agota con 106 elementos.
Nuevas versiones alternativas a la tradicional
En los últimos años han aparecido versiones alternativas a la Tabla Periódica. Hay que destacar la del profesor Dufour del Colegio Ahuntsic de Montreal, que ha desarrollado un sistema periódico tridimensional que pone de manifiesto la simetría fundamental de los elementos. Otras alternativas son las de William B. Jensen, de la Universidad de Cincinnati, con forma piramidal y la del ruso Agafoshin, en espiral, está ganando popularidad es el sistema de clasificación, que ha sido adoptado por la Unión Internacional de Química Pura y Aplicada (IUPAC). Este nuevo sistema enumera los grupos consecutivamente del 1 al 18 a través del sistema periódico.
También se han propuesto sistemas periódicos que se refieren a moléculas como la de Ray Hefferlin, de la Universidad Adventista del Sur en Collegedale, para moléculas diatómicas, y la de Jerry R. Días, de la Universidad de Missouri en Kansas City, para hidrocarburos aromáticos derivados del benceno. El sistema de clasificación de Días es análogo a las triadas de Döbereiner: el número de átomos de carbono e hidrógeno de la molécula en el centro de una triada es el promedio del que caracteriza a las moléculas que la flanquean, lo mismo en sentido vertical que horizontal.
Actualizaciones a la Tabla Periódica
La Asamblea General de la Unión Internacional de Física Pura y Aplicada (IUPAP), reunida en Londres, aprobado los nombres de tres nuevos elementos químicos: los 110, 111 y 112, que se nombraron darmstadtium (Ds), roentgenium (Rg) and copernicium (Cn), respectivamente.
El darmstadtium fue descubierto en 1994, en el Centro de Investigación de Iones Pesados, en Darmstadt (Alemania). No fue un descubrimiento convencional de algo que existe en la naturaleza sino que fue producido en laboratorio bombardeando un blanco de plomo 208 con iones de níquel 62. Se contaron cuatro átomos de este nuevo elemento químicos. Hasta 2001 no se reconoció oficialmente su existencia.
El Roentgenium fue descubierto el mismo año que el darmstadtium y en el mismo instituto alemán, pero los científicos en aquel momento sólo habían obtenido tres átomos y no se consideró suficiente para ser reconocido. Ocho años después se descubrieron otros tres átomos y se aceptó su existencia. Es uno de esos elementos que no existe en la naturaleza de forma natural, los científicos los crean mediante aceleradores de partículas para fusionar núcleos de otros elementos hasta conseguir los nuevos y se desintegran inmediatamente. Por ello, demostrar que se han producido resulta extremadamente complicado y se tardan años en lograr pruebas suficientes y convincentes.
El copernicium, también sintético, es extremadamente radiactivo. Se creó, en 1996, en el mismo instituto de Darmastadt, bombardeando núcleo de zinc-70 contra una blanco de plomo 208 en un acelerador de iones pesados, pero el resultado se consideró controvertido durante años y no fue reconocido como descubrimiento hasta su confirmación en 2009.
La Unión Internacional de Química Pura y Aplicada aprobó oficialmente el 31 de mayo de 2012 los nombres de los elementos 114 y 116, Flerovio (Fl) y Livermorio (Lv) respectivamente.
A mediaidos de 2011, los físicos pertenecientes al Instituto Central de Investigación Nuclear (JINR) de Dubna y el Laboratorio Nacional Lawrence Livermore en California acreditaban de manera oficial la sintentización de los dos elementos.El elemento 114, fue sintetizado en diciembre de 1998 bombardeando el núcleo de plutonio con núcleo de calcio, que tiene 94 y 20 protones respectivamente. El elemento 116 fue sintetizado en julio de 2000 tras bombardear el núcleo de curio, que tiene 96 protones, con núcleo de calcio.