Leptospirosis equina
| ||||
Leptospirosis equina: es una enfermedad infectocontagiosa de amplia distribución mundial, clasificada como una antropozoonosis, su transmisión por lo general va de los animales al hombre. Afecta a diferentes especies animales y al humano en forma accidental. Es causada por una espiroqueta patógena del género Leptospira, especie interrogans.
Sumario
Definición
Es una enfermedad generalizada, de curso agudo y de distribución mundial, producida por diversa serovariedades de la bacteria Leptospira sp. Muchas especies de mamíferos son susceptibles, entre ellos, el hombre; los reservorios más comunes son el perro y los roedores. En los bovinos se caracteriza por provocar aborto, infertibilidad, agalectia, nefritis, anemia hemolítica y mastitis, entre otros signos.
Historia en Cuba
Los estudios de la leptospirosis en los animales comienzan con una comunicación de Guiares et al. en 1921 donde manifiestan haber encontrado leptospiras en 5 ratones.
El Dr. Pérez Vigueras, médico veterinario, en 1943 es el primer investigador que estudia la leptospirosis por métodos serológicos en perros (González et al., 1990).
En 1945 se comprueba serológicamente el primer caso humano y mediante la prueba biológica se demuestra la presencia de leptospiras (Programa Nacional de Control de la Leptospirosis Humana, 1995).
En una síntesis de la recopilación histórica de los Drs. González Gallo et al. (1990), consideramos como datos interesantes en la etapa de 1944 a 1973 los siguientes:
- Entre 1944 y 1946 se efectúan estudios dejando sentado el diagnóstico de la enfermedad en los humanos en Cuba.
- Curvelo y Sotolongo en 1949 la encontraron en un ratón doméstico capturado en la vivienda de un caso humano.
- En 1964 el Dr. Pérez Carril hace estudios de la enfermedad en oriente norte. En este año realiza un estudio clínico – epidemiológico en trabajadores que laboran en terrenos pantanosos extraordinariamente poblados de ratas.
- Kurokov en 1971 estudia 172 perros en La Habana y logra el aislamiento de 24 cepas.
- En 1971 y 1973 realizaron investigaciones logrando el aislamiento en perros, ratas, cerdos y fuentes de agua naturales, además encontró altos títulos en bovinos con síntomas compatibles con leptospirosis.
- El primer estudio en equinos lo realizó Mezaros et al. en 1973, encontrando un 39.1 % de casos positivos.
- Sosa y González Gallo en 1973 aislaron dos cepas de leptospiras en cerdas abortadas.
Según informan en el programa nacional para el control de la leptospirosis (1995) vigente, en la década de los años ’70 se originan varios brotes de leptospirosis humana. En 1980 ocurrió un brote de gran magnitud en Camagüey, derivándose del estudio epidemiológico el programa nacional de control de la enfermedad el cual se pone en vigor en 1981. La evolución de la leptospirosis humana durante el período comprendido entre 1981 y 1994 se ha caracterizado por manifestar una tendencia ascendente con respecto a la morbiletalidad.
Etiología
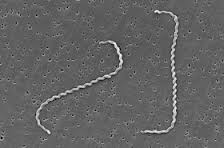
La leptospira es una bacteria helicoidal de la familia de las espiroquetáceas. Todas las leptospira patógenas se encuentran clasificadas bajo una sola especie: Leptospira interrogans, de la cual se distinguen 212 serovariedades, que se encuentran en 23 serogrupos.
Patogenia
La presentación de la enfermedad puede ser aguda, subaguda o crónica.
Después de penetrar por la piel o por la mucosa, el microorganismo tiene un periodo de incubación de 4-10 días, en el cual se multiplica rápidamente y se disemina en ciertos órganos –hígado, riñones, pulmones, tracto reproductor (como en el caso de la placenta) y líquido cefalorraquídeo-, después migra y puede aislarse en la sangre periférica durante varios días, hasta que cesa la fiebre. Seis días después de iniciada la leptospiremia, se observan anticuerpos en el torrente sanguíneo y a la bacteria en la orina.
- Forma aguda: durante el período temprano de septicemia puede producirse suficiente hemolisina para causar hemoglobinuria, producto de la hemóliosis intravascular extensa, esto es frecuente en terneros, no así en animales adultos.
Si el animal sobrevive a esta fase, es probable el inicio de un proceso infeccioso en el riñón. El hecho de que se produzca o no hemólisis, depende de que el serotipo particular produzca hemolisina.
El daño capilar es común a todos los serotipos y, durante la fase septicémica, las hemorragias petequiales en la mucosa constituyen la expresión de ese daño. Por otra parte, también ocurre daño vascular en el riñón cuando la hemólisis es intensa, anemia y nefrosis hemoglobinúrica.
La lesión renal se debe a que la infección persiste en este órgano tiempo después de haber desaparecido en otras localizaciones tisulares. En la fase aguda, el animal puede morir de septicemia, anemia hemolítica o por combinación de ambas. La muerte se deberá a una uremia causada por nefritir intersticial.
- Forma subaguda (infección oculta): la patogenia es similar a la forma de septicemia aguda, excepto porque la reacción es menos grave. Se observa en todas las especies, pero es más común entre bovinos y equinos adultos.
- Forma crónica: una secuela frecuente, después de la invasión generalizada, es el aborto provocado por la muerte del feto con degeneración placentaria o sin ella; en ambos casos, se trata de los efectos resultantes de la invasión al producto durante la fase septicémica de la enfermedad.
El aborto ocurre con mayor frecuencia en la segunda mitad de la preñez - quizá porque es más fácil la invasión de la placenta en esta etapa- pero puede ocurrir en cualquier momento, a partir de los cuatro meses de la gestación.
Aunque el aborto ocurre frecuentemente en bovinos y equinos después de la forma aguda o subaguda, también es posible que se produzca si enfermedad clínica previa.
Signo clínico
Los signos clínicos en la leptospirosis son muy parecidos en todas las especies animales (no varían mucho, independientemente de la especie de leptospira de que se trate) salvo que la infección por L. interrogans, serovariedad icterohaemorrhagiae, produce septicemia grave. Además, algunos serotipos también tienen la capacidad de producir hemólisis.
Son más susceptibles a contraer la enfermedad los terneros de un mes o menos. Esta enfermedad se caracteriza por septicemia, fiebre de 40.5 a 41.5, anorexia, congestión pulmonar, petequias en mucosas, depresión y anemia hemolítica con hemoglobinuria, ictericia y palidez de la mucosa; ocasionalmente, meningitis, en la cual el animal muestra incoordinación, sialorrea, conjuntivitis y rigidez muscular.
Como consecuencia de la anemia, se registra un amento en la frecuencia cardíaca y de la intensidad absoluta de los ruidos cardíacos, siendo más fácil percibir el latido de punta. La disnea es manifiesta. Con frecuencia, el aborto se debe a la reacción general en la etapa aguda del padecimiento. En algunos animales se registra cojera intensa por sinovitis; en otros animales dermatitis necrótica, probablemente debida a fotosensibilización.
En los casos de infección crónica, los signos quedan restringidos a reabsorción embrionaria, momificación, mortinatos y aborto, el cual, puede ocurrir seis semanas después de la infección; los brotes suelen ser más frecuentes en grupos de bovinos que se hallan en la misma etapa de gestación o al nacimiento prematuro de becerros débiles e infectados. La retención placentaria –posterior al aborto o parto se hace presente como consecuencia de la infección. En algunas investigaciones se ha reportado una subsecuente infertilidad por la persistencia del microorganismo en el útero y el oviducto.
Fuentes de infección
- La orina de animales infectados, asintomáticos y portadores.
- Agua
- Leche
- Forrajes
- Pastos
- Tejidos de animales, descargas posparto
- Saliva
- Semen
- Vectores
- Insectos como; moscas y mosquitos.
Hallazgos a la necropsia
En la forma aguda de la enfermedad es común encontrar signos de anemias, ictericia, hemoglobinuria y hemorragias submucosas y subserosas. Puede haber úlceras y hemorragias en la mucosa del abomaso en bovinos y, si la hemoglobinuria es intensa, se asocia a menudo con edema pulmonar y enfisema.
Desde el punto de vista histológico, existe nefritis intersticial difusa y focal, necrosis hepática centrolobulillar y, en algunos casos, lesiones vascular en meninges y cerebro. En etapas tardías, el hallazgo característico consiste en nefritis intersticial pogresiva que se manifiesta por zonas elevadas blanquecina de pequeño tamaño en la corteza renal.
Diagnósticos
El diagnóstico de leptospirosis depende de la combinación de una buena historia clínica y del apoyo de un buen laboratorio. Es necesario identificar la variedad o serovariedades que estén afectando a un hato ganadero.
El método de laboratorio posee gran importancia en el diagnóstico de la enfermedad e incluye aislamiento del microorganismo con el auxilio de pruebas serológicas, pruebas de inoculación en hámster y de la inhibición del crecimiento. Durante la etapa septicémica existen leptospiras solamente en la sangre, anemia hemolítica aguda y aumento en la fragilidad de los eritrocitos, lo que repercute en una hemoglobinuria. Sin embargo, la única medida diagnóstica positiva en esta etapa de la enfermedad es el cultivo en sangre. Si sobrevive el aborto, debe examinarse el riñón y los líquidos pulmonares y pleurales, en busca del microorganismo.
El diagnóstico de leptospirosis es mucho más fácil en un hato, porque se tienen diferentes animales con títulos altos y la probabilidad de identificar o aislar al microorganismo a partir de orina o leche, que aumenta con las muestras que se tomen de varios especímenes; sin embargo, en un solo animal – según el momento en que haya ocurrido la infección-, es probable el descenso del título a un nivel bajo la que dificultaría la interpretación.
En la actualidad existe un sinnúmero de pruebas de laboratorio para el diagnóstico de la leptospirosis; probablemente el examen de muestras de orina es la mejor oportunidad para comprobar la presencia de la infección, esto es de gran utilidad a nivel de campo, ya que el muestreo de orina y su visualización en un microscopio de campo oscuro puede indicar el inicio de un tratamiento rápido de ataque. Sin embargo, como ya se ha visto anteriormente, el éxito de esta prueba depende de la evolución de la enfermedad en el animal.
Para esto, se cuenta con pruebas específicas y sofisticadas, con las que no sólo se puede aislar el agente, sino que se puede identificar el serotipo que está afectando al ganado. Entre éstas se encuentra la prueba de aglutinación microscópica (MAT, por sus siglas en inglés), que es el método más común para detectar la leptospirosis; los títulos registrados con valores 2100 son clasificados como “significativos”.
La prueba ELISA-antiglobulina es mucho más exacta que las otras y tiene muchas ventajas desde el punto de vista de la práctica de laboratorio.
También las tinciones fluorescentes de anticuerpos en orina y cultivo de la misma es un método de diagnóstico rápido y exacto para descubrir la presencia de leptospirosis e identificar serotipos.
Deberá someterse a examen el suero de cada animal clínicamente afectado –en estado agudo o convaleciente- tomando muestras a intervalos de 7 a 10 días, así como el de aquellos animales que tengan antecedentes de aborto y deberá tomarse suero de 15 a 25% de los animales aparentemente sanos.
En la actualidad se cuenta con pruebas más específicas como la reacción en cadena de la polimerasa (PCR), la cual tiene una alta especificidad.
Diferencial
Las formas agudas y subagudas de la leptospirosis en el ganado bovino deberán ser diferenciadas de la babesiosis, anaplasmosis, intoxicación por nabo silvestre, hematuria enzoótica, intoxicación por cobre, hemoglobinuria bacilar y sobrehidratación.
Cuando el aborto es el único signo debe tenerse en cuenta un diferencial con: brucelosis, campilobacteriosis, listerosis, ureaplasmosis, tricomoniasis, haemophilosis, rinotraqueítis infecciosa bovina y diarrea viral bovina.
El cambio de color o la presencia de sangre en la leche son las anormalidades más importantes que permiten diferenciar clínicamente a la leptospirosis de otras enfermedades infecciosas hemolíticas, las cuales se diferencian a su vez del grupo de enfermedades no infecciosas por la aparición de fiebre. La ausencia de inflamaciones de la ubre suele ser suficiente para diferenciar esta anomalía de la mastitis.
Tratamiento
El objetivo de la terapéutica en todas las infecciones por leptospirosis consiste en controlar la infección antes de que se presenten daños irreparables en el hígado y los riñones. Esto puede lograrse mediante la administración de estreptomicina a razón de 12 mg/kg por 3-5 días, tan pronto como aparezcan los primeros signos.
El objetivo secundario de la terapéutica es controlar la leptospirosis de los animales portadores y hacer más segura permanencia en el hato. En varios experimentos se ha comprobado que la administración de dehidroestreptomicina a 25 mg/kg PV, puede contrarrestar la eliminación del microorganismo en la orina.
Control
El control de la enfermedad se basa en la utilización de un antibiótico, de preferencia dehidroestreptomicina, y la vacunación. Como ya se mencionó, la dehidroestreptomicina a 25 mg/kg es muy efectiva para la reducción del número de leptospiras por orina, y es la base de varios programas de control.
El control de la leptospirosis en un hato aislado puede adoptar la forma de erradicación, limitación o contención del número de casos.
Todo programa encaminado a limitar la frecuencia de casos a nivel aceptable, desde el punto de vista financiero, se basa en la higiene y la vacunación.
El problema derivado de la aplicación de este método es la persistencia ambiental del microorganismo, así como la infección renal residual, lo que puede evitar un resultado satisfactorio.
Actualmente la vacunación es el método de elección para el control de la enfermedad, sin embargo, en brotes de abortos, la combinación de los dos métodos (vacunación y antibioterapia) arroja mejores resultados.
La serovariedades hardjo es exclusiva del ganado bovino; no parece haber ningún reservorio silvestre y parece que los vacunos son los hospedadores específicos de dicha serovariedad en muchas partes del mundo.
En hatos infectados o susceptibles a la exposición, la vacunación debe efectuarse cada tres meses durante dos o más años, a fin de prevenir la propagación de la infección.
Fuente
- http://mundo-pecuario.com/tema57/generalizadas/leptospirosis-242.html
- http://www.ms.gba.gov.ar/sitios/laboratorio/files/2012/06/Ficha_epidemilogica_equina.pdf
- http://sian.inia.gob.ve/repositorio/revistas_tec/ceniaphoy/articulos/n6/arti/alfaro_c/arti/alfaro_c.htm
- http://www.sag.gob.cl/sites/default/files/f_tecnica_leptospirosis.pdf
- http://www.monografias.com/trabajos25/leptospira-interrogans/leptospira-interrogans.shtml#ixzz3H2doxHY3