Diferencia entre revisiones de «Paramyxoviridae»
(Etiqueta: nuestro-nuestra) |
(Etiqueta: nuestro-nuestra) |
||
| (No se muestran 17 ediciones intermedias de 5 usuarios) | |||
| Línea 1: | Línea 1: | ||
| − | {{ | + | {{Sistema:referencia}} |
{{Ficha de virus | {{Ficha de virus | ||
|orden=Mononegavirales | |orden=Mononegavirales | ||
| Línea 19: | Línea 19: | ||
|enfermedades en animales=Moquillo canino, Fiebre epizoótica de los bovinos, Neumonía del ratón | |enfermedades en animales=Moquillo canino, Fiebre epizoótica de los bovinos, Neumonía del ratón | ||
|notas=Son los agentes más importantes de las infecciones respiratorias en lactantes y niños pequeños. | |notas=Son los agentes más importantes de las infecciones respiratorias en lactantes y niños pequeños. | ||
| − | }} | + | }}'''Paramyxoviridae.''' Familia de [[virus]] del orden de los [[Mononegavirales]] con características similares a las del [[virus de la influenza]] pero de mayor tamaño y más pleomórficos. Todos lo virus de esta familia se caracterizan por ser virus envueltos, con [[ARN]] de cadena negativa y no segmentados<ref >Daniel Kolakofsky, Thierry Pelet, Dominique Garcin, Stéphane Hausmann, Joseph Curran, y Laurent Roux. Revista de Virología. Paramyxovirus RNA Synthesis and the Requirement for Hexamer Genome Length: the Rule of Six Revisited (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC124558/?tool=pubmed www.ncbi.nlm.nih.gov]</ref >. Poseen un [[virión]] esférico de aproximadamente 250 [[nm]] de diámetro y una [[nucleoclápside]] helicoidal de 18 nm. El mayor por ciento de su composición está ocupado por [[proteína]]s (73%), aunque también presenta ARN (1%), [[carbohidrato]]s (6%) y [[lípido]]s (20%). Su replicación ocurre en el [[citoplasma]] por gemación de partículas en la [[membrana plasmática]] y poseen un [[genoma]] de ARN de cadena simple, lineal, que no está segmentada y en sentido negativo de aproximadamente 18 [[kb]]. |
| − | + | ||
| − | Muchas | + | Muchas de las especies pertenecientes a esta familia son de gran importancia biomédica, pues constituyen el principal agente causal de las infecciones respiratorias en [[lactante]]s y [[niño]]s pequeños, su investigación ha permitido desarrollar un número significativo de [[fármaco]]s para combatir dichos trastornos inducidos, también se han registrado como agente causante de enfermedades en animales de corral de importancia económica como las [[gallina]]s y los [[pavo]]s, ejemplo de estas afecciones es la [[enfermedad de Newcastle]]<ref >M.V. Marialys Navarro Bravo. Enfermedad de Newcastle (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://monografias.umcc.cu/monos/2011/AGRONOMIA/mo11fa6.pdf monografias.umcc.cu]</ref >. |
| − | + | ||
| − | Recientemente se ha | + | Recientemente se ha demostrado que los miembros de la subfamilia Paramixovirinae, al igual que otros géneros de virus, poseen la capacidad de inhibir la respuesta defensiva del [[Sistema inmunológico]] del huésped mediante el bloqueo del [[interferón]] ([[IFN]]). Con este propósito poseen en su estructura un a [[proteína]] nombrada genéricamente proteína V que inhibe al interferón; aunque existen excepciones como el virus parainfluenza tipo 4. <ref name="VPI tipo 4"> Machiko Nishio, Masato Tsurudome, Morihiro Ito, and Yasuhiko Ito. Revista de Virología. Human Parainfluenza Virus Type 4 Is Incapable of Evading the Interferon-Induced Antiviral Effect (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1287573/?tool=pubmed www.ncbi.nlm.nih.gov]</ref > |
| − | + | ||
== Características morfológicas == | == Características morfológicas == | ||
| − | + | ||
| − | En | + | En su envoltura contiene a la [[glicoproteínas|glicoproteína]] viral [[hemaglutinina]] ([[HN]]), la que algunas veces posee una actividad de neuroaminidasa, y a la glicoproteína de fusión (F). Son antigenamente estables, poseen partículas lábiles, pero muy infectantes. Se ha podido comprobar que, al menos, seis proteínas estructurales de esta familia son análogas a las del virus de la influenza. La [[nucleoproteína]] (NP), que forma la [[nucleocápside]] helicoidal, forma un complejo con el ARN viral, representando la principal proteína interna; además de ella se unen al complejo dos proteínas grandes designadas como P y L, que probablemente realicen la actividad de polimerasa viral. En la formación de la envoltura viral participan tres proteínas importantes: una proteína matriz (M) que tiene afinidad por la NP y las glicoproteínas de la superficie viral. |
| − | + | ||
| − | La | + | La nucleocápside se rodea de una envoltura lipídica con [[espícula]]s formadas por dos glicoproteínas diferentes. La actividad de estas glicoproteínas de superficie ayuda a distinguir el género de la familia Paramixoviridae. Existe una glicoproteína mayor denominada HN o solo H que puede mostrar actividad de hemaglutinima o neuroaminidasa y que media la unión entre el virus y el receptor en la célula huésped mientras que la otra glicorproteína media la fusión de la membrana mostrando una actividad hemolítica. |
| − | + | ||
| − | === | + | === Clasificación === |
[[Archivo:Morbilivirus.JPG|thumb |right |Microfotografía electrónica de un miembro del género Morbilivirus. ]] | [[Archivo:Morbilivirus.JPG|thumb |right |Microfotografía electrónica de un miembro del género Morbilivirus. ]] | ||
| − | Basándose | + | Basándose en características morfológicas, organización del genoma, actividad biológica de las proteínas y en las secuencias de las proteínas relacionadas, esta familia fue dividida en dos subfamilias: la subfamilia [[Pneumovirinae]], que está integrada por un solo género nombrado Pneumovirus y la subfamilia [[Paramixovirinae]] que contiene a tres géneros, los [[Morbilivirus]], los [[Paramixovirus]] y, por último, los [[Rubulavirus]]. |
| − | + | ||
| − | El | + | El género Paramixovirus incluye el [[virus parainfluenza humano]] tipo 1 tipo 3, el [[virus Sendai]] (parainfluenza tipo 1 de los ratones) y el parainfluenza tipo 3 bovino. El género Rubulavirus contiene al virus de la [[parotiditis]] humana, el virus de la paraifluenza humana tipo 2. 4a y 4b y el virus parainfluenza; también tiene por huésped a algunos animales, entre ellos: los [[perro]]s y [[cerdo]]s<ref>Rubulavirus. Molecular biology. ViralZone (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://viralzone.expasy.org/viralzone/all_by_species/88.html viralzone.expasy.org]</ref>. El género Morbilivirus incluye el virus del sarampión humano, el virus del moquillo canino, el virus de la fiebre epizoótica de los bovinos, el morbilivirus acuático que infecta a mamíferos marinos<ref>Morbillivirus. Molecular biology. ViralZone (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://viralzone.expasy.org/all_by_species/86.html viralzone.expasy.org]</ref>. Estos virus se vinculan antigéneticamente pero no muestran reacción cruzada con miembros de otros géneros. La proteína F parece estar muy conservada entre los Morbilivorus mientras que la proteína H muestra mayor variabilidad. El virus del [[sarampión]] posee una hemaglutinina pero carece de actividad neuroaminidasa. |
| − | + | ||
=== Pneumovirus === | === Pneumovirus === | ||
| − | + | ||
| − | El | + | El género Pneumovirus posee un virión pleomórfico generalmente esférico y de 150 a 200 nm de diámetro, aunque han sido descritos filamentos de hasta 400 nm de extensión. El genoma de los pneumovirus posee alrededor de 15 000 [[nucleótido]]s en extensión. Las proteínas NS1 y NS2 son relativamente pequeñas y exclusivas de los pneumovirus y participan en los proceso de replicación de estos<ref>Andrew J. Easton, Joseph B. Domachowske, y Helene F. Rosenberg. Ensayos en Microbiología Clínica. Pneumovirus en animales: Genética molecular y patogenia (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC387412/ www.ncbi.nlm.nih.gov]</ref>. Este género está integrado por el [[virus sincitial respiratorio]] humano, el virus sincitial respiratorio bovino, y el virus de la [[neumonía]] del [[ratón]]. Inmunológicamente no se vinculan con miembros de los demás géneros, su nucleocápside es más pequeña. La glicoproteína de superficie más grande carece de actividades hemaglutinantes y neuroaminidasa, por lo que recibió el nombre de [[proteína G]]. La proteína F del virus sincitial respiratorio presenta actividad de fusión a membranas, pero carece de actividad de hemolisina. |
== Estructura y función de las proteínas virales == | == Estructura y función de las proteínas virales == | ||
| − | + | ||
=== Nucleoproteína (NP) === | === Nucleoproteína (NP) === | ||
| − | + | ||
| − | Alrededor | + | Alrededor de 489 y 553 [[aminoácido]]s están contenidos en los NPs, mediante la comparación de proteínas y datos obtenidos por digestión con proteasas se ha podido llegar a la conclusión de que los NPs tienen dos dominios. Entre los virus relacionados alrededor del 80% de la región del anillo terminal de la proteína se encuentra bastante conservado, mientras que el 20% de la región carboxilo terminal es pobremente conservado. En las replicación viral los NP tiene varias funciones, intervienen en la encapsidación del ARN genómico, se asocia con la P-L polimerasa durante la transcripción y la replicación, y es muy probable que interactúe con la proteína M durante el ensamblaje del virus. |
| − | + | ||
=== Fosfoproteína (P) === | === Fosfoproteína (P) === | ||
| − | + | ||
| − | Esta | + | Esta denominación la recibe por el alto nivel de [[fosforilación]] que presenta, esta es una proteína muy variable en su longitud dentro de los virus de la familia y está compuesta por dos dominios, el N-terminal y el C-terminal, separados por una región hipervariable. La proteína P desempeña un papel importante en la síntesis de ARN, pues junto con la proteína L forman la polimerasa viral (P-L) y junto a la NP forman un complejo que se supone active la encapsidación del ARN. |
| − | + | ||
=== Proteína L === | === Proteína L === | ||
| − | + | ||
| − | Esta | + | Esta proteína tiene una longitud aproximada de 2200 aa. De todas las proteínas estructurales es la menos abundante lo que se debe a su tamaño, longitud y localización activa en la transcripción viral; se sugiere que podría ser la polimerasa viral. El complejo formado por la proteína L y la proteína P es requerido para la actividad polimerasa con la NP y la cadena molde de ARN. |
| − | + | ||
=== Proteína Matrix (M) === | === Proteína Matrix (M) === | ||
| − | + | ||
| − | Esta | + | Esta es la proteína más abundante en el virión, posee de 341 a 375 aa. Es una proteína básica y algo hidrofóbica. La asociación entre ellas y su contacto con la nucleocápside ayuda en la formación de la partícula viral. |
| − | + | ||
=== Glicoproteínas de la envoltura === | === Glicoproteínas de la envoltura === | ||
| − | + | ||
| − | Los | + | Los paramixovirus poseen dos proteínas integrales de membrana, una de ellas está involucrada en la unión del virus a la [[célula]] y la otra media la fusión de la envoltura viral con la membrana celular. La proteína de superficie en los parainfluenzavirus y los rubulavirus se denomina HN, constituyendo el mayor determinante antigénico y una proteína multifuncional. Es la responsable de la absorción del virus al ácido siálico contenido en la membrana celular. Tiene actividad hemaglutinanate y neuroaminidasa. La HN contiene de 565 a 582 aa y es una proteína integral de membrana de tipo dos. Esta proteína contiene un dominio hidrofóbico localizado en el N-terminal que actúa como señal de anclaje a la membrana. La proteína de unión a los Morbilivirus (H) tiene actividad hemaglutinante y carece de actividad neuroaminidasa, es también una proteína integral de membrana tipo dos. |
| − | + | ||
=== Proteína de fusión (F) === | === Proteína de fusión (F) === | ||
| − | + | ||
| − | Esta | + | Esta proteína es un factor crítico en la infección y la patogenia de la familia Paramixoviridae. Induce la fusión de la envoltura viral con la membrana plasmática de la célula huésped, también se encarga de la fusión entre células lo que permite la propagación del virus, induciendo la formación de grandes [[sincitio]]s. Se caracteriza como una proteína integral de membrana tipo dos que se sintetiza como un precursor inactivo de Fo. El precursor debe escindirse por acción de una proteasa para adquirir actividad biológica y generar dos subunidades, las que permanecen unidas por un [[puente disulfuro]]. |
| − | + | ||
| − | === Proteínas no estructurales de los Pneumovirus (NS1) y (NS2) | + | === Proteínas no estructurales de los Pneumovirus (NS1) y (NS2) === |
| − | + | ||
| − | Los | + | Los Pneumovirus contienen dos genes NS1 y NS2 que codifican proteínas de 139 y 124 aa respectivamente y se expresan de forma abundante en las células infectadas. No se tienen muchos conocimientos acerca de la actuación de estas proteínas durante el ciclo viral. |
| − | + | ||
== Eventos genéticos == | == Eventos genéticos == | ||
| − | + | ||
=== Replicación === | === Replicación === | ||
[[Archivo:Enzima.png|thumb |right |Vista en 3D de una enzima del proceso de replicación.]] | [[Archivo:Enzima.png|thumb |right |Vista en 3D de una enzima del proceso de replicación.]] | ||
La replicación en esta familia se lleva a cabo en el citoplasma durantes tres etapas: | La replicación en esta familia se lleva a cabo en el citoplasma durantes tres etapas: | ||
| − | # | + | #Adhesión. |
#Penetración. | #Penetración. | ||
#Pérdida de la cubierta del virus. | #Pérdida de la cubierta del virus. | ||
| − | Los | + | Los Paramixovirinae se adhieren a la célula huésped a través de la proteína HN o H. En los paramixovirus y rubulavirus los receptores celulares son moléculas de [[ácido siálico]]. Para los morbilivirus el receptor es una proteína denominada CD<sub>46</sub>. En los pneumovirus se desconoce este receptor y la proteína G es la proteína que interviene en la unión del virus a la célula, después la envoltura del virión se fusiona con la membrana celular gracias a la acción de F<sub>1</sub>. La fusión tiene lugar a [[pH]] neutro lo que permite la liberación de la nucleocápside viral directamente en el interior de la célula. |
| − | + | ||
=== Transcripción, traducción y replicación del ARN === | === Transcripción, traducción y replicación del ARN === | ||
| − | + | ||
| − | Esta | + | Esta familia contiene un genoma de ARN de sentido negativo no segmentado. Complejos como el P-L polimerasa elaboran múltiples transcriptos de ARN mensajero en el citoplasma de la célula. No se requieren iniciadores exógenos y por tanto no depende de funciones del núcleo celular. El inicio y la terminación del proceso de transcripción son señalados por la secuencia reguladora de la transcripción el los límites del [[gen]]. El gen NP es transcripto de una forma más abundante que el L. Las proteínas virales son sintetizadas en el citoplasma y las glicoproteínas virales se sintetizan y glicosilan en las vías secretoras. El complejo anterior (P-L) también es el encargado de la replicación del genoma viral. Para lograr la síntesis de una cadena positiva antigenoma este complejo debe ignorar las señales de terminación interpuestas en los límites del gen, a partir del antigenoma se copian genomas progenia de longitud completa. |
| − | + | ||
=== Maduración === | === Maduración === | ||
| − | + | ||
| − | El virus | + | El virus madura mediante un proceso de gemación que ocurre en la superficie celular, las nucleocápsides hijas que se forman en el citoplasma migran a las superficie celular. Son atraídas a sitios sobre la membrana que se encuentran tachonados con espículas de glicoproteínas virales. La proteína M es esencial para la formación de las partículas. Durante la gemación la mayor parte de las proteínas del huésped son excluidas de la membrana. La proteína F activada produce la fusión de las membranas celulares adyacentes y como resultado se forma un sincitio extenso. La formación de sincitios es una respuesta común a la infección por paramixovirus. |
| − | + | ||
== Paramixovirus del ojo azul == | == Paramixovirus del ojo azul == | ||
| − | + | ||
| − | La | + | La [[enfermedad del ojo azul]] es calificada como una infección viral que solo afecta a los porcinos y cuyo agente etiológico pertenece a la familia paramixoviridae. Este trastorno se caracteriza por [[encefalitis]], falla reproductiva y opacidad de la [[córnea]]. Su agente causal, el paramixovirus del ojo azul (POA), es sensible al [[éter]] y al [[cloroformo]]; sin embargo es resistente a la [[actinomicina D]]. Posee capacidades hemaglutinantes con [[eritrocito]]s de todas las especies domésticas y del ser humano. Este virus se encuentra ampliamente distribuido en países como [[México]]. Aunque los brotes de esta enfermedad suceden en los meses de [[marzo]] a [[julio]], puede decirse que está presente todo el año<ref>Edith Arellanes, Martha C. Fuentes,Rosalba Carreón, Humberto Ramírez. Inoculación experimental del Paramixovirusdel ojo azul en el gato doméstico (Felis catus) (en línea). Consultado: 13 de mayo de 2012. Disponible en: [http://www.medigraphic.com/pdfs/vetmex/vm-1994/vm943h.pdf www.medigraphic.com]</ref>. |
| − | + | ||
== Virus parainfluenza (VPI) == | == Virus parainfluenza (VPI) == | ||
| − | [[Archivo:Parainfluenza virus.jpg|thumb |right |Fotografía en | + | [[Archivo:Parainfluenza virus.jpg|thumb |right |Fotografía en microscopio de transmisión de electrones del VPI.]] |
| − | Conjunto | + | Conjunto de paramixovirus descritos por primera vez en el año [[1956]], cuyo virión posee aproximadamente 150-250 nanómetros de tamaño<ref>Kelly J. Henrickson. Clinical Microbiology Reviews. Parainfluenza Viruses (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC153148/?tool=pubmed www.ncbi.nlm.nih.gov]</ref>, con un diámetro de nucleocápside de 18 nm, en su envoltura están presentes dos glicoproteínas: la HN con actividad de hemaglutinina y neuraminidasa y la F, con actividad hemolítica y de fusión celular<ref >Luis E. Vega-Briceño, Dahiana Pulgar B., Marcela Potin S., Marcela Ferres G. e Ignacio Sánchez D. Revista chilena de infectología (versión impresa ISSN 0716-1018). Características clínicas y epidemiológicas de la infección por virus parainfluenza en niños hospitalizados (en línea). Consultado: 13 de mayo de 2012. Disponible en: [http://www.scielo.cl/scielo.php?pid=S0716-10182007000500005&script=sci_arttext www.scielo.cl]</ref>. El genoma de los VPI es lineal, no segmentado, en sentido negativo y contiene alrededor de 15 000 nucleótidos: 15 463 los PIV3, 15 285 los Sendai, 15 156 en el causante de la enfermedad de Newcastle. Consisten de cinco o seis genes que engloban ocho o nueve proteínas, algunas de las cuales no son detectadas en el virión pero participan en el ciclo de replicación del virus en la célula. Su ARN genómico nunca es encontrado sin envoltura, siempre está fuertemente envuelto en NP<ref> Raija Vainionpaa, Timo Hyypia. Biología de los Virus Parainfluenza (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC358320/pdf/cmr00031-0133.pdf www.ncbi.nlm.nih.gov]</ref>. Debido a recientes descubrimientos los VPI han sido divididos en dos géneros: Respirovirus (VPI tipo 1 y tipo 3) y Rubulavirus (VPI tipo 2 y tipo 4)<ref>Public Health Agency of Canada. Human Parainfluenza Virus (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.phac-aspc.gc.ca/lab-bio/res/psds-ftss/parainfluenza-eng.php#tphp www.phac-aspc.gc.ca]</ref>. Se han encontrado cuatro serotipos de virus parainfluenza, que se relacionan de forma antigénica entre sí, con el virus causante de la parotiditis y con otros miembros de la familia Paramixoviridae: |
| − | #Virus parainfluenza tipo 1 (VPI-I): Se relaciona con el paramixovirus Sendai, causante de infecciones en ratones y cerdos. En niños es la principal causa de [[laringotraqueobronquitis]] o croup<ref name="Parainfluenza Tipos"> Human Parainfluenza Viruses. Clinical Features of human parainfluenza viruses (HPIVs) (en Inglés) (en línea). | + | #Virus parainfluenza tipo 1 (VPI-I): Se relaciona con el paramixovirus Sendai, causante de infecciones en ratones y cerdos. En niños es la principal causa de [[laringotraqueobronquitis]] o croup<ref name="Parainfluenza Tipos"> Human Parainfluenza Viruses. Clinical Features of human parainfluenza viruses (HPIVs) (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.cdc.gov/ncidod/dvrd/revb/respiratory/hpivfeat.htm www.cdc.gov]</ref>. |
| − | #Virus | + | #Virus parainfluenza tipo 2 (VPI-II): Se relaciona con el virus SV-5 y SV-41, y virus de la parotiditis. Produce infecciones en [[mono]]s. Al igual que el tipo 1 es agente causal del croup<ref name="Parainfluenza Tipos"></ref>. Posee un compuesto denominado [[proteína V]] que inhibe los [[anticuerpo]]s de tipo interferón del huésped favoreciendo el crecimiento del virus<ref>Machiko Nishio, Junpei Ohtsuka, Masato Tsurudome, Tetsuya Nosaka, y Daniel Kolakofsky. Revista de Virología. Human Parainfluenza Virus Type 2 V Protein Inhibits Genome Replication by Binding to the L Protein: Possible Role in Promoting Viral Fitness (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2447057/?tool=pubmed www.ncbi.nlm.nih.gov]</ref>. |
| − | #Virus parainfluenza tipo 3 (VPI-III): Se relaciona con el virus SF-4. Es el causante de infecciones en bóvidos. En humanos, es | + | #Virus parainfluenza tipo 3 (VPI-III): Se relaciona con el virus SF-4. Es el causante de infecciones en bóvidos. En humanos, es comúnmente asociado con [[bronquiolitis]] y [[neumonía]]<ref name="Parainfluenza Tipos"></ref>. |
| − | #Virus | + | #Virus parainfluenza tipo 4 (VPI-IV): Contiene dos [[serotipo]]s denominados 4A y 4B. No constituye una causa frecuente de enfermedades graves y es poco detectado en humanos<ref name="Parainfluenza Tipos"></ref>. Constituye el único tipo de los VPI que no es capaz de escapar a la acción del interferón del organismo huésped, aunque es capaz de formar un complejo con sus moléculas no logra disminuir sus niveles de concentración intracelular<ref name="VPI tipo 4"></ref>. |
| − | + | Poseen también otras espículas responsables de la acción hemolítica y de fusión (proteína F), lo cual los hace capaces de fusionar células y hemolizar ciertos tipos de eritrocitos, esto los diferencia de los virus influenza. Estos virus se reconocen por la acción citopática en las células infectadas o por las reacciones de hemabsorción con glóbulos rojos de cobayo en monocapas de células infectadas. Estos virus causan infecciones respiratorias frecuentes y de gravedad variable, que dependen del tipo de virus y sobre todo de la edad del huésped, en relación directa con la producción de primoinfecciones o reinfecciones. Los tipos 1, 2 y 3 se reconocen como los principales agentes causales del croup, aunque también pueden causar neumonías y bronquiolitis. Los virus parainfluenza, especialmente los tipos 1 y 2 son responsables de más de 50% de los casos de croup o laringitis obstructiva. Las bronquiolitis asociadas al tipo 3, pueden presentarse a partir del primer mes de vida, ocurren durante todo el año y aparecen en brotes epidémicos. Los virus parainfluenza tienen una distribución geográfica mundial. En general, la enfermedad que causan es leve, los síntomas varían dependiendo del tipo de infección y es común que se presenten síntomas similares al [[resfriado]], como [[rinorrea]] y [[tos]] leve. Los síntomas respiratorios potencialmente mortales se pueden observar en bebés más pequeños que tienen bronquiolitis y en aquéllos con sistemas inmunitarios debilitados<ref>Parainfluenza. MedlinePlus (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.nlm.nih.gov/medlineplus/spanish/ency/article/001370.htm www.nlm.nih.gov]</ref>. | |
| − | Poseen | + | |
| − | + | Los cuatro tipos son capaces de causar infecciones respiratorias habiéndose demostrado reinfecciones en adultos y niños, particularmente causadas por el serotipo 3. Estos agentes generalmente infectan a individuos de corta edad. Los tipos 1 y 2 causan epidemias en [[otoño]]. El tipo 3 causa enfermedad todo el año. En un estudio serológico se indica que 60% de los niños se infecta por parainfluenza 3 en el transcurso de los 2 primeros años de vida y aproximadamente 80% se infecta antes de los 4 años, la mayoría en forma asintomática. La alta tasa de infección sugiere una diseminación rápida. Puede causar enfermedad grave en lactantes como lo hace el VSR, pero esa gravedad disminuye a partir de los 3 años. Es poco frecuente una enfermedad tan grave que requiera internación hospitalaria. Por lo general la excreción de virus es de corta duración, por lo cual estos virus deben aislarse de aspirados traqueales o nasofaríngeos tomados tempranamente. La muestra clínica se inocula en diferentes líneas celulares, especialmente líneas primarias de [[riñón]] de mono (aunque también pueden usarse líneas establecidas LLC-MK2 o MDCK), manteniendo las células en medio libre de [[suero]]. Algunas veces pueden presentar efecto citopático y en otras es necesario reconocer la presencia viral en los cultivos con pruebas de hemadsorción (Had), con eritrocitos de cobayo a 4° C. La identificación del virus puede realizarse por IF, inhibición de la hemadsorción o neutralización con antisueros específicos<ref>Mercedes C. Weissenbacher, Dra. María M. Ávila. Los virus como causa de IRA alta y baja en niños: características generales y diagnóstico (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.paho.org/spanish/ad/dpc/cd/aiepi1-1-5.pdf www.paho.org]. </ref>. El virión de este género es inestable en el medioambiente por lo que logra sobrevivir solo unas pocas horas en superficies expuestas y se inactiva fácilmente con [[jabón]] y [[agua]], de ahí la importancia del lavado de manos en su prevención<ref>Definition of Human parainfluenza virus. MedicineNet (en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://www.medterms.com/script/main/art.asp?articlekey=31631 www.medterms.com]</ref>. | |
| − | Los | + | |
| − | |||
| − | |||
==Virus sincitial respiratorio (VSRH) == | ==Virus sincitial respiratorio (VSRH) == | ||
| − | [[Archivo:Virus.jpeg|thumb |right |Microfotografía electrónica del VSR. ]] | + | [[Archivo:Virus Sincitial Respiratorio.jpeg|thumb |right |Microfotografía electrónica del VSR. ]] |
| − | El | + | El VSR fue descrito en 1956<ref>Dra. Clara Savón Valdés. Virus respiratorio sincitial humano (en línea). Consultado: 13 de mayo de 2012. Disponible en: [http://www.paho.org/spanish/ad/ths/ev/labs_ipk_8.pdf www.paho.org]</ref>por J.A. Morris en [[Estados Unidos de Norteamérica]], posee como material genético al ARN. Las partículas virales son pleomórficas, miden entre 90 y 130 nm y característicamente inducen la formación de sincitios (agrupación de células) en tejidos celulares. Han sido descritos dos grupos de VRS: A y B, dentro de los cuáles existen subgrupos, pertenece al género pneumovirus y a la familia paramixoviridae<ref>Dr. Marte Hernández Porras, Dra. Patricia Saltigeral Simental. Revista de Enfermedades Infecciosas en Pediatría Vol. XXI Núm. 84. La importancia del virus sincicial respiratorio (en línea). Consultado: 13 de mayo de 2012. Disponible en: [http://www.medigraphic.com/pdfs/revenfinfped/eip-2008/eip082a.pdf www.medigraphic.com]</ref>, es un virus no segmentado, con una cadena simple de ARN en sentido negativo; contiene 10 genes que encodan 11 proteínas, sobresaliendo las proteínas G y F. Ambas son de importancia fisiopatológica, la proteína G<ref>Kalina T. Zlateva, Philippe Lemey, Elien Moës, Anne-Mieke Vandamme, y Marc Van Ranst. Revista de Virología (2012). Variabilidad genética y evolución molecular del Virus sincitial respiratorio humano, subgrupo B. Proteína G. (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://jvi.asm.org/content/79/14/9157.long#content-blo jvi.asm.orgck]</ref>se adhiere al [[epitelio respiratorio]] y la proteína F facilita la penetración del virus, la inserción del ARN dentro de la célula del huésped y la formación de sincicios, además estas proteínas constituyen los mayores determinantes antigénicos virales que inducen la formación de anticuerpos neutralizantes. Las variantes antigénicas de la proteína G y de las proteínas F, N y P, son las que determinan los dos tipos distintos de VSR: A y B. Por otra part |
| − | + | e, en el año [[2001]] se aisló por primera vez un agente viral llamado [[ metaneumovirus humano]] (MNVH), aunque existe un reporte original que data de 1958, en que fue aislado de muestras serológicas de niños. Este virus comparte características muy importantes con el VSR, ya que también es un virus ARN, que pertenece al mismo género y familia, el índice de incidencia de infecciones provocadas por el MNVH es menor que las ocasionadas por el VSR<ref> Respiratory Syncytial Virus (RSV) and Human Metapneumovirus Infections. The Merck Manual (en Inglés)(en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://www.merckmanuals.com/professional/infectious_diseases/respiratory_viruses/respiratory_syncytial_virus_rsv_and_human_metapneumovirus_infections.html?qt=Parainfluenza&alt=sh www.merckmanuals.com]</ref>. | |
| − | + | ||
=== Morfología === | === Morfología === | ||
| − | + | ||
| − | El | + | El VSR mide entre 100 y 300 nm y posee un manto - [[bicapa lipídica]] que deriva de la membrana citoplasmática de la célula huésped- que recubre una cápsula de simetría helicoidal. Esta contiene al genoma viral constituido por una hebra de ARN lineal de polaridad negativa de 15,2 kb de longitud, que codifica para 10 proteínas. Entre ellas se encuentran las glicoproteínas (gp) F y G que forman las espículas que sobresalen del manto; la proteína hidrofóbica pequeña no glicosilada -SH- de función desconocida; las proteínas no glicosiladas M (28 kDa) y M2 (22 kDa) que constituyen la capa proteica entre la cápsula y el manto, denominada matriz viral; la nucleoproteína N, la [[fosfoproteína]] P y la polimerasa L que conforman la cápsula del virus y se asocian al ARN genómico, y dos proteínas no estructurales - NS1 (15 kDa) y NS2 (14 kDa), capaces de inhibir la acción del interferón, presentes en muy pequeña cantidad en los viriones, pero que se acumulan en las células infectadas. |
| − | del virus y se asocian al | + | |
| − | + | La proteína de fusión F es muy conservada entre las distintas cepas de VRS, siendo fundamental para el ingreso del virus a la célula y su diseminación entre ellas al fusionar las membranas, determinando los característicos sincitios (células gigantes multinucleadas) de esta infección. La proteína G participa en la unión al receptor celular y varía entre los VRS, especialmente en su porción extracelular. Existe sólo un serotipo de VRS, aunque a nivel antigénico y genético se diferencian dos grupos virales, A y B(1,2), principalmente en base a los cambios en la proteína G. Asimismo, dentro de cada grupo existen variantes virales identificadas por distintos métodos, como la digestión enzimática de los genes N y G, | |
| − | La proteína de fusión F es muy conservada | + | obteniéndose patrones de restricción (NP1-11), y por los análisis filogenéticos de la secuencia nucleotídica del gen de la gpG, estableciéndose genotipos virales. Se han definido 8 genotipos (GA1-GA5) entre los VRS del grupo A y 10 genotipos (GB1-GB4, URU1, URU2, BA) entre los B. Su importancia clínica reside en que la coinfección con el VSR, produce cuadros clínicos más severos. Esto tiene trascendencia clínica y epidemiológica pues estudios serológicos revelan que la mayoría de los niños a los 5 años de edad ya se han expuesto al MNVH10<ref>Dra. Vivian Luchsinger PhD. Conociendo al VRS (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.neumologia-pediatrica.cl/pdf/200832/ConociendoVRS.pdf www.neumologia-pediatrica.cl]</ref>. |
| − | membranas, | + | |
| − | especialmente en su | ||
| − | base a los cambios en la proteína G. Asimismo, | ||
| − | obteniéndose | ||
| − | genotipos (GA1-GA5) entre los VRS del | ||
| − | |||
=== Patogenia === | === Patogenia === | ||
| − | + | ||
| − | Afecta | + | Afecta al 50-65% de niños durante el primer año de vida y a los tres años de edad se estima que el 100% han tenido contacto con el VRS en algún momento. Entre 25-40% de niños infectados por VRS desarrollan infección del tracto respiratorio inferior. Aunque las tasas de mortalidad son bajas (<1%) en ciertas poblaciones de riesgo llegan hasta un 3%<ref >O. RAMILO. Southwestern Medical Center. Dallas. EE.UU. Virus respiratorio sincitial: antiguos retos y nuevas estrategias (en línea). Consultado: 13 de mayo de 2012. Disponible en: [http://www.sccalp.org/boletin/184/BolPediatr2003_43_189-190.pdf www.sccalp.org]</ref>. Se considera que VSR es el causante del 50 a 90% de las bronquiolitis en el lactante, y del 5 al 40% el desarrollo de la técnica de PCR múltiple, en un mismo proceso puede realizarse la amplificación simultánea de varios virus, lo que disminuye el costo de la prueba. Es conveniente señalar que la detección de antígenos y cultivos utilizados hasta ahora para identificar VSR, y virus de la influenza y parainfluenza no son suficientemente rápidos o sensibles para el [[diagnóstico]] de muestras que contienen mínimo material celular. Además, la detección de antígenos puede no ser capaz de identificar nuevas variantes de virus emergentes que tengan alteraciones en la secuencia de aminoácidos, proteínas de la cubierta o cápside externa. |
| − | + | ||
| − | Actualmente | + | Actualmente existen dos opciones de [[inmunoprofilaxis]] para el VSR en pacientes pediátricos de alto riesgo. La primera es el uso de la [[inmunoglobulina]] intravenosa contra VSR (VSR-IGIV). Esta fue autorizada por la [[Administración de Alimentación y Drogas]] ([[FDA]]) por sus siglas en Inglés, en [[enero]] de [[1996]] para la prevención de infecciones severas por VSR en niños menores de 24 meses de edad con enfermedad pulmonar crónica, o en prematuros de menos de 35 semanas de gestación. La VSR-IGIV se obtiene de [[plasma]] de donadores con títulos elevados de anticuerpos neutralizantes para VSR, y se administra mensualmente cuidadosos ensayos clínicos en hospitales de nuestro medio<ref >Manuel Alberto Cano-Rangel, Gerardo Álvarez-Hernández, Roberto Dorame-Castillo, Jesús Contreras-Soto. Infecciones por Virus Sincicial Respiratorio en Pediatría (en línea), [[2007]]. Consultado: 13 de mayo de 2012. Disponible en: [http://www.medigraphic.com/pdfs/bolclinhosinfson/bis-2007/bis072f.pdf www.medigraphic.com]</ref>. En individuos adultos solo produce síntomas similares a los de la [[gripe]] común: congestión nasal, [[dolor]] en la [[garganta]], dolor de [[cabeza]], tos, [[fiebre]] y malestar general<ref>Acerca del virus respiratorio sincitial. FamilyDoctor (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://kidshealth.org/PageManager.jsp?lic=44&dn=American_Academy_of_Family_Physicians&article_set=56702&cat_id=20256# kidshealth.org]</ref>. |
| − | + | ||
== Virus del sarampión == | == Virus del sarampión == | ||
| − | [[Archivo:Virus sarampion.gif|thumb |right |Fotografía al | + | [[Archivo:Virus sarampion.gif|thumb |right |Fotografía al microscopio de transmisión de electrones del virus del sarampión. ]] |
| − | El | + | El virus del sarampión (VS) pertenece al género de los Morbillivirus, que agrupa a los virus del [[moquillo canino]], virus de la peste bovina, virus de los pequeños [[rumiante]]s, morbillivirus de los fócidos, y al morbillivirus de los delfines. El genoma de los virus salvajes del sarampión es una molécula de RNA de 15984 nucleótidos, codifica por las proteínas estructurales: N (nucleocápsida), P (fosfoproteína), L (polimerasa), M (matriz), H (hemaglutinina) y F (de fusión) que se incorporan a las partículas víricas, y otras no estructurales V y C que se encuentran solamente en las células infectadas<ref > Rafael Fernández-Muñoz, Juan Carabaña, Montserrat Caballero, Paloma B. Liton, Beatriz M Duque, Dolores García-Villalón y María Luisa Celma. Revista Española de Salud Pública (versión impresa ISSN 1135-5727). Epidemiología molecular del virus del sarampión (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://scielo.isciii.es/scielo.php?pid=S1135-57271999000500010&script=sci_arttext&tlng=pt scielo.isciii.es]</ref>. Tiene dos glicoproteínas: la hemoaglutinina (H) y la [[aglutinina]] fusión (F) que son muy importantes para la respuesta de protección inmune. |
| − | + | ||
| − | + | ||
| − | Dicha | + | Dicha respuesta incluye en los niños infectados anticuerpos a la glicoproteína H y la fusión de las células nucleadas con formación de células gigantes multinucleadas (F). Las proteínas H y F son las proteínas responsables de la fusión del virus con la célula huésped y la inclusión dentro de éste mientras que los receptores de la célula humana son el CD46 y CD150. La [[vacuna]] aplicada para esta enfermedad produce en el individuo anticuerpos dirigidos contra las proteínas de la superficie del virus, en particular, contra la proteína H. Han sido reportados 23 [[genotipo]]s o variantes genéticas por parte de la OMS, agrupados en ocho serotipos (A-H) y la tasa de mutación de los genomas es comparativamente baja. Es responsable de más del 10 % del total de defunciones de menores de 5 años que se producen en el mundo anualmente, de las cuales la mitad corresponde a menores de 1 año. El virus del sarampión puede ocasionar diversas complicaciones asociadas con neumonía, diarrea y desnutrición. También puede producir, especialmente en los países en desarrollo, discapacidades permanentes como lesiones cerebrales, [[ceguera]] y [[sordera]]<ref>Lic. María Teresa Carballo López, Lic. Milady García Torres y Dr. Miguel Ángel Galindo Sardiña. Revista Cubana de Higiene y Epidemiología (versión On-line ISSN 1561-3003). El sarampión: una realidad y un desafío (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-30031998000300001 scielo.sld.cu]</ref>. |
| − | + | ||
== Mixovirus parotiditis == | == Mixovirus parotiditis == | ||
| − | + | ||
| − | [[Archivo:Virus papera.jpg|thumb |right |Fotografía al | + | [[Archivo:Virus papera.jpg|thumb |right |Fotografía al microscopio de transmisión de electrones del Mixovirus parotiditis. ]] |
| − | El Mixovirus parotiditis, es un virus con ARN como material genético que | + | El [[Mixovirus parotiditis]], es un virus con ARN como material genético que pertenece al género Rubulavirus, subfamilia Paramyxovirinae y a la familia Paramyxoviridae. El virión tiene una configuración redondeada con un contorno irregular y mide aproximadamente 150 nm recubierto de una cápside lipídica. Se ha descrito un solo un serotipo con diferentes subtipos en todo el mundo del cual el hombre es el único reservorio. Causada por este virus, descrita por [[Hipócrates]] en el siglo V antes de [[Cristo]] y conocida tradicionalmente como paperas, la parotiditis es una enfermedad contagiosa aguda caracterizada por aumento de volumen sin supuración de una o ambas [[glándula]]s parótidas. Pueden ocurrir afectaciones en otros órganos como son los [[testículo]]s, [[ovario]]s y el [[Sistema Nervioso Central]] ([[SNC]]). |
| − | + | ||
| − | Para | + | Para que se produzca el contagio de esta enfermedad es necesario un contacto directo con la persona afectada. La infección natural se inicia por aerosoles de secreciones respiratorias de una persona infectada a una susceptible, iniciándose la replicación del virus a nivel del epitelio de la [[mucosa]] del [[aparato respiratorio]] superior. Posteriormente el virus pasa a los [[ganglios]] regionales con la subsecuente diseminación a la [[sangre]]; produciéndose, de esta forma, una viremia primaria y la aparición de la inflamación de las glándulas salivales. Luego de esta etapa se inicia una viremia secundaria que permita la infección de otros órganos y tejidos del cuerpo. Esta enfermedad puede ser prevenida mediante vacunación y su aplicación se realiza comúnmente en combinación con la del sarampión y la [[rubéola]] mediante la [[vacuna triple viral]] o MMR<ref>Paperas. MedlinePlus (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://www.nlm.nih.gov/medlineplus/spanish/ency/article/001557.htm www.nlm.nih.gov]</ref>. |
== Enlaces externos== | == Enlaces externos== | ||
| − | + | ||
| − | *[http://www.utmb.edu/virusimages/ | + | *[http://www.utmb.edu/virusimages/ Imágenes de virus en: Virus Images. Foundations of Virology (sitio en Inglés).] |
| − | *[http://www.diseasesdatabase.com/ddb30631.htm | + | *[http://viralzone.expasy.org ViralZone (sitio en Inglés).] |
| − | *[http://www.cdc.gov/ncidod/dvrd/revb/respiratory/hpivfeat.htm | + | *[http://www.ncbi.nlm.nih.gov/taxonomy Base de datos de taxonomía animal (sitio en Inglés).] |
| + | *[http://www.diseasesdatabase.com/ddb30631.htm Base de datos de enfermedades. Información sobre la Parainfluenza (sitio en Inglés).] | ||
| + | *[http://www.cdc.gov/ncidod/dvrd/revb/respiratory/hpivfeat.htm Centro Nacional para la inmunización y las enfermedades respiratorias. Parainfluenza (sitio en Inglés).] | ||
*[http://cmr.asm.org/content/16/2/242.full Recapitulaciones sobre Virología Clínica. Parainfluenza (sitio en Inglés).] | *[http://cmr.asm.org/content/16/2/242.full Recapitulaciones sobre Virología Clínica. Parainfluenza (sitio en Inglés).] | ||
| − | + | ||
| − | |||
| − | |||
== Referencias == | == Referencias == | ||
| − | + | ||
{{listaref|2}} | {{listaref|2}} | ||
| − | + | ||
== Fuentes == | == Fuentes == | ||
| − | + | ||
| − | *Xia-qing | + | *Alina Llop Hernández, Margarita Valdés-Dapena Vivanco, Jorge Luis Zuazo Silva. Microbiología y Parasitología Médicas II. Editorial Ecimed, [[La Habana]], [[2001]]. ISBN 959-7132-54-0 |
| − | + | *Diccionario Terminológico de Ciencias Médicas, undécima edición. Editorial Científico-Técnica. La Habana, [[1984]]. | |
| − | *Lic. | + | *Xia-qing Li, Zhen F. Fu1, Rene Alvarez, Christine Henderson, y Ralph A. Tripp. Revista de Virología (2012). Respiratory Syncytial Virus (RSV) Infects Neuronal Cells and Processes That Innervate the Lung by a Process Involving RSV G Protein (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://jvi.asm.org/content/80/1/537.long jvi.asm.org] |
| − | *ViralZone. Paramyxoviridae, biología molecular | + | *Lic. Duilia Tovar. Síndrome Respiratorio Agudo Severo. Aspectos virológicos y diagnóstico viral (en línea). Consultado: 13 de mayo de 2012. Disponible en: [http://caibco.ucv.ve/caibco/vitae/VitaeDieciseis/SRAS/SARSVIROLOGIA/ArchivosHTML/srasvirologia.pdf caibco.ucv.ve] |
| − | *Virus sincitial respiratorio, genoma | + | *ViralZone. Paramyxoviridae, biología molecular (sitio en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://viralzone.expasy.org/all_by_species/556.html viralzone.expasy.org] |
| − | *Virus Pathogen Resource (en Inglés) (en | + | *Virus sincitial respiratorio, genoma completo (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/nucleotide/NC_001781 www.ncbi.nlm.nih.gov] |
| − | *Philippa J. M. Jack, David B. Boyle, Bryan T. | + | *Virus Pathogen Resource (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.viprbrc.org/brc/vipr_allSpecies_search.do?method=SubmitForm&decorator=paramyxo www.viprbrc.org] |
| − | *Phillip Spencer Gould, Andrew John Easton. | + | *Philippa J. M. Jack, David B. Boyle, Bryan T. Eaton, y Lin-Fa Wang1. Revista de Virología (agosto de 2005). The Complete Genome Sequence of J Virus Reveals a Unique Genome Structure in the Family Paramyxoviridae (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1182632/ www.ncbi.nlm.nih.gov] |
| − | *Ah-Tye C, Schwartz S, Huberman K, Carlin E, | + | *Phillip Spencer Gould, Andrew John Easton. Coupled translation of the second open reading frame of M2 mRNA is sequence dependent and differs significantly within the subfamily Pneumovirinae (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1951343/?tool=pubmed www.ncbi.nlm.nih.gov] |
| − | + | *Ah-Tye C, Schwartz S, Huberman K, Carlin E, Moscona A. Virus-receptor interactions of human parainfluenza viruses types 1, 2 and 3 (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/pubmed/10545258?dopt=Abstract www.ncbi.nlm.nih.gov] | |
| − | *World Health Organization (WHO). Initiative for Vaccine Research (IVR), Acute Respiratory Infections (Update September 2009). Respiratory syncytial virus and parainfluenza viruses (en Inglés) (en línea). Consultado: | + | *World Health Organization (WHO). Initiative for Vaccine Research (IVR), Acute Respiratory Infections (Update September 2009). Respiratory syncytial virus and parainfluenza viruses (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: [http://www.who.int/vaccine_research/diseases/ari/en/index2.html# www.who.int] |
| − | + | *Paramyxoviridae. Registro taxonómico (sitio en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?mode=Undef&id=11158&lvl=3&keep=1&srchmode=1&unlock www.ncbi.nlm.nih.gov] | |
| − | *Paramyxoviridae. Registro taxonómico (sitio en Inglés) (en línea). Consultado: 19 de mayo | + | *Lodish H, Berk A, Zipursk. Molecular Cell Biology. Viruses: Structure, Function, and Uses (en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://www.ncbi.nlm.nih.gov/books/NBK21523/#1422 www.ncbi.nlm.nih.gov] |
| − | *Lodish H, Berk A, Zipursk. Molecular Cell Biology. Viruses: Structure, Function, and Uses (en Inglés) (en línea). Consultado: 19 de mayo | + | *Eugene V Koonin, Tatiana G Senkevich y Valerian V Dolja. The ancient Virus World and evolution of cells (en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://www.biology-direct.com/content/1/1/29 www.biology-direct.com] |
| − | *Eugene V Koonin, Tatiana G Senkevich y Valerian V Dolja. The ancient Virus World and evolution of cells (en Inglés) (en línea). Consultado: 19 de mayo | + | *A.M. Galazka, S.E. Robertson, y A. Kraigher. Mumps and mumps vaccine: a global review ( en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: [http://whqlibdoc.who.int/bulletin/1999/Vol77-No1/bulletin_1999_77%281%29_3-14.pdf whqlibdoc.who.int] |
| − | *A.M. Galazka, S.E. Robertson, y A. Kraigher. Mumps and mumps vaccine: a global review ( en Inglés) (en línea). Consultado: 19 de mayo | + | [[Category:Microbiología]][[Category:Virus]][[Category:Virología_animal]][[Category: Patógenos_virales]] |
última versión al 18:29 26 feb 2025
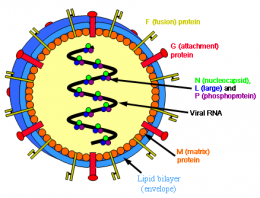
Paramyxoviridae. Familia de virus del orden de los Mononegavirales con características similares a las del virus de la influenza pero de mayor tamaño y más pleomórficos. Todos lo virus de esta familia se caracterizan por ser virus envueltos, con ARN de cadena negativa y no segmentados[1]. Poseen un virión esférico de aproximadamente 250 nm de diámetro y una nucleoclápside helicoidal de 18 nm. El mayor por ciento de su composición está ocupado por proteínas (73%), aunque también presenta ARN (1%), carbohidratos (6%) y lípidos (20%). Su replicación ocurre en el citoplasma por gemación de partículas en la membrana plasmática y poseen un genoma de ARN de cadena simple, lineal, que no está segmentada y en sentido negativo de aproximadamente 18 kb.
Muchas de las especies pertenecientes a esta familia son de gran importancia biomédica, pues constituyen el principal agente causal de las infecciones respiratorias en lactantes y niños pequeños, su investigación ha permitido desarrollar un número significativo de fármacos para combatir dichos trastornos inducidos, también se han registrado como agente causante de enfermedades en animales de corral de importancia económica como las gallinas y los pavos, ejemplo de estas afecciones es la enfermedad de Newcastle[2].
Recientemente se ha demostrado que los miembros de la subfamilia Paramixovirinae, al igual que otros géneros de virus, poseen la capacidad de inhibir la respuesta defensiva del Sistema inmunológico del huésped mediante el bloqueo del interferón (IFN). Con este propósito poseen en su estructura un a proteína nombrada genéricamente proteína V que inhibe al interferón; aunque existen excepciones como el virus parainfluenza tipo 4. [3]
Sumario
Características morfológicas
En su envoltura contiene a la glicoproteína viral hemaglutinina (HN), la que algunas veces posee una actividad de neuroaminidasa, y a la glicoproteína de fusión (F). Son antigenamente estables, poseen partículas lábiles, pero muy infectantes. Se ha podido comprobar que, al menos, seis proteínas estructurales de esta familia son análogas a las del virus de la influenza. La nucleoproteína (NP), que forma la nucleocápside helicoidal, forma un complejo con el ARN viral, representando la principal proteína interna; además de ella se unen al complejo dos proteínas grandes designadas como P y L, que probablemente realicen la actividad de polimerasa viral. En la formación de la envoltura viral participan tres proteínas importantes: una proteína matriz (M) que tiene afinidad por la NP y las glicoproteínas de la superficie viral.
La nucleocápside se rodea de una envoltura lipídica con espículas formadas por dos glicoproteínas diferentes. La actividad de estas glicoproteínas de superficie ayuda a distinguir el género de la familia Paramixoviridae. Existe una glicoproteína mayor denominada HN o solo H que puede mostrar actividad de hemaglutinima o neuroaminidasa y que media la unión entre el virus y el receptor en la célula huésped mientras que la otra glicorproteína media la fusión de la membrana mostrando una actividad hemolítica.
Clasificación
Basándose en características morfológicas, organización del genoma, actividad biológica de las proteínas y en las secuencias de las proteínas relacionadas, esta familia fue dividida en dos subfamilias: la subfamilia Pneumovirinae, que está integrada por un solo género nombrado Pneumovirus y la subfamilia Paramixovirinae que contiene a tres géneros, los Morbilivirus, los Paramixovirus y, por último, los Rubulavirus.
El género Paramixovirus incluye el virus parainfluenza humano tipo 1 tipo 3, el virus Sendai (parainfluenza tipo 1 de los ratones) y el parainfluenza tipo 3 bovino. El género Rubulavirus contiene al virus de la parotiditis humana, el virus de la paraifluenza humana tipo 2. 4a y 4b y el virus parainfluenza; también tiene por huésped a algunos animales, entre ellos: los perros y cerdos[4]. El género Morbilivirus incluye el virus del sarampión humano, el virus del moquillo canino, el virus de la fiebre epizoótica de los bovinos, el morbilivirus acuático que infecta a mamíferos marinos[5]. Estos virus se vinculan antigéneticamente pero no muestran reacción cruzada con miembros de otros géneros. La proteína F parece estar muy conservada entre los Morbilivorus mientras que la proteína H muestra mayor variabilidad. El virus del sarampión posee una hemaglutinina pero carece de actividad neuroaminidasa.
Pneumovirus
El género Pneumovirus posee un virión pleomórfico generalmente esférico y de 150 a 200 nm de diámetro, aunque han sido descritos filamentos de hasta 400 nm de extensión. El genoma de los pneumovirus posee alrededor de 15 000 nucleótidos en extensión. Las proteínas NS1 y NS2 son relativamente pequeñas y exclusivas de los pneumovirus y participan en los proceso de replicación de estos[6]. Este género está integrado por el virus sincitial respiratorio humano, el virus sincitial respiratorio bovino, y el virus de la neumonía del ratón. Inmunológicamente no se vinculan con miembros de los demás géneros, su nucleocápside es más pequeña. La glicoproteína de superficie más grande carece de actividades hemaglutinantes y neuroaminidasa, por lo que recibió el nombre de proteína G. La proteína F del virus sincitial respiratorio presenta actividad de fusión a membranas, pero carece de actividad de hemolisina.
Estructura y función de las proteínas virales
Nucleoproteína (NP)
Alrededor de 489 y 553 aminoácidos están contenidos en los NPs, mediante la comparación de proteínas y datos obtenidos por digestión con proteasas se ha podido llegar a la conclusión de que los NPs tienen dos dominios. Entre los virus relacionados alrededor del 80% de la región del anillo terminal de la proteína se encuentra bastante conservado, mientras que el 20% de la región carboxilo terminal es pobremente conservado. En las replicación viral los NP tiene varias funciones, intervienen en la encapsidación del ARN genómico, se asocia con la P-L polimerasa durante la transcripción y la replicación, y es muy probable que interactúe con la proteína M durante el ensamblaje del virus.
Fosfoproteína (P)
Esta denominación la recibe por el alto nivel de fosforilación que presenta, esta es una proteína muy variable en su longitud dentro de los virus de la familia y está compuesta por dos dominios, el N-terminal y el C-terminal, separados por una región hipervariable. La proteína P desempeña un papel importante en la síntesis de ARN, pues junto con la proteína L forman la polimerasa viral (P-L) y junto a la NP forman un complejo que se supone active la encapsidación del ARN.
Proteína L
Esta proteína tiene una longitud aproximada de 2200 aa. De todas las proteínas estructurales es la menos abundante lo que se debe a su tamaño, longitud y localización activa en la transcripción viral; se sugiere que podría ser la polimerasa viral. El complejo formado por la proteína L y la proteína P es requerido para la actividad polimerasa con la NP y la cadena molde de ARN.
Proteína Matrix (M)
Esta es la proteína más abundante en el virión, posee de 341 a 375 aa. Es una proteína básica y algo hidrofóbica. La asociación entre ellas y su contacto con la nucleocápside ayuda en la formación de la partícula viral.
Glicoproteínas de la envoltura
Los paramixovirus poseen dos proteínas integrales de membrana, una de ellas está involucrada en la unión del virus a la célula y la otra media la fusión de la envoltura viral con la membrana celular. La proteína de superficie en los parainfluenzavirus y los rubulavirus se denomina HN, constituyendo el mayor determinante antigénico y una proteína multifuncional. Es la responsable de la absorción del virus al ácido siálico contenido en la membrana celular. Tiene actividad hemaglutinanate y neuroaminidasa. La HN contiene de 565 a 582 aa y es una proteína integral de membrana de tipo dos. Esta proteína contiene un dominio hidrofóbico localizado en el N-terminal que actúa como señal de anclaje a la membrana. La proteína de unión a los Morbilivirus (H) tiene actividad hemaglutinante y carece de actividad neuroaminidasa, es también una proteína integral de membrana tipo dos.
Proteína de fusión (F)
Esta proteína es un factor crítico en la infección y la patogenia de la familia Paramixoviridae. Induce la fusión de la envoltura viral con la membrana plasmática de la célula huésped, también se encarga de la fusión entre células lo que permite la propagación del virus, induciendo la formación de grandes sincitios. Se caracteriza como una proteína integral de membrana tipo dos que se sintetiza como un precursor inactivo de Fo. El precursor debe escindirse por acción de una proteasa para adquirir actividad biológica y generar dos subunidades, las que permanecen unidas por un puente disulfuro.
Proteínas no estructurales de los Pneumovirus (NS1) y (NS2)
Los Pneumovirus contienen dos genes NS1 y NS2 que codifican proteínas de 139 y 124 aa respectivamente y se expresan de forma abundante en las células infectadas. No se tienen muchos conocimientos acerca de la actuación de estas proteínas durante el ciclo viral.
Eventos genéticos
Replicación
La replicación en esta familia se lleva a cabo en el citoplasma durantes tres etapas:
- Adhesión.
- Penetración.
- Pérdida de la cubierta del virus.
Los Paramixovirinae se adhieren a la célula huésped a través de la proteína HN o H. En los paramixovirus y rubulavirus los receptores celulares son moléculas de ácido siálico. Para los morbilivirus el receptor es una proteína denominada CD46. En los pneumovirus se desconoce este receptor y la proteína G es la proteína que interviene en la unión del virus a la célula, después la envoltura del virión se fusiona con la membrana celular gracias a la acción de F1. La fusión tiene lugar a pH neutro lo que permite la liberación de la nucleocápside viral directamente en el interior de la célula.
Transcripción, traducción y replicación del ARN
Esta familia contiene un genoma de ARN de sentido negativo no segmentado. Complejos como el P-L polimerasa elaboran múltiples transcriptos de ARN mensajero en el citoplasma de la célula. No se requieren iniciadores exógenos y por tanto no depende de funciones del núcleo celular. El inicio y la terminación del proceso de transcripción son señalados por la secuencia reguladora de la transcripción el los límites del gen. El gen NP es transcripto de una forma más abundante que el L. Las proteínas virales son sintetizadas en el citoplasma y las glicoproteínas virales se sintetizan y glicosilan en las vías secretoras. El complejo anterior (P-L) también es el encargado de la replicación del genoma viral. Para lograr la síntesis de una cadena positiva antigenoma este complejo debe ignorar las señales de terminación interpuestas en los límites del gen, a partir del antigenoma se copian genomas progenia de longitud completa.
Maduración
El virus madura mediante un proceso de gemación que ocurre en la superficie celular, las nucleocápsides hijas que se forman en el citoplasma migran a las superficie celular. Son atraídas a sitios sobre la membrana que se encuentran tachonados con espículas de glicoproteínas virales. La proteína M es esencial para la formación de las partículas. Durante la gemación la mayor parte de las proteínas del huésped son excluidas de la membrana. La proteína F activada produce la fusión de las membranas celulares adyacentes y como resultado se forma un sincitio extenso. La formación de sincitios es una respuesta común a la infección por paramixovirus.
Paramixovirus del ojo azul
La enfermedad del ojo azul es calificada como una infección viral que solo afecta a los porcinos y cuyo agente etiológico pertenece a la familia paramixoviridae. Este trastorno se caracteriza por encefalitis, falla reproductiva y opacidad de la córnea. Su agente causal, el paramixovirus del ojo azul (POA), es sensible al éter y al cloroformo; sin embargo es resistente a la actinomicina D. Posee capacidades hemaglutinantes con eritrocitos de todas las especies domésticas y del ser humano. Este virus se encuentra ampliamente distribuido en países como México. Aunque los brotes de esta enfermedad suceden en los meses de marzo a julio, puede decirse que está presente todo el año[7].
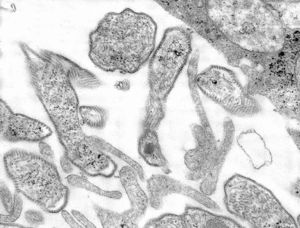
Virus parainfluenza (VPI)
Conjunto de paramixovirus descritos por primera vez en el año 1956, cuyo virión posee aproximadamente 150-250 nanómetros de tamaño[8], con un diámetro de nucleocápside de 18 nm, en su envoltura están presentes dos glicoproteínas: la HN con actividad de hemaglutinina y neuraminidasa y la F, con actividad hemolítica y de fusión celular[9]. El genoma de los VPI es lineal, no segmentado, en sentido negativo y contiene alrededor de 15 000 nucleótidos: 15 463 los PIV3, 15 285 los Sendai, 15 156 en el causante de la enfermedad de Newcastle. Consisten de cinco o seis genes que engloban ocho o nueve proteínas, algunas de las cuales no son detectadas en el virión pero participan en el ciclo de replicación del virus en la célula. Su ARN genómico nunca es encontrado sin envoltura, siempre está fuertemente envuelto en NP[10]. Debido a recientes descubrimientos los VPI han sido divididos en dos géneros: Respirovirus (VPI tipo 1 y tipo 3) y Rubulavirus (VPI tipo 2 y tipo 4)[11]. Se han encontrado cuatro serotipos de virus parainfluenza, que se relacionan de forma antigénica entre sí, con el virus causante de la parotiditis y con otros miembros de la familia Paramixoviridae:
- Virus parainfluenza tipo 1 (VPI-I): Se relaciona con el paramixovirus Sendai, causante de infecciones en ratones y cerdos. En niños es la principal causa de laringotraqueobronquitis o croup[12].
- Virus parainfluenza tipo 2 (VPI-II): Se relaciona con el virus SV-5 y SV-41, y virus de la parotiditis. Produce infecciones en monos. Al igual que el tipo 1 es agente causal del croup[12]. Posee un compuesto denominado proteína V que inhibe los anticuerpos de tipo interferón del huésped favoreciendo el crecimiento del virus[13].
- Virus parainfluenza tipo 3 (VPI-III): Se relaciona con el virus SF-4. Es el causante de infecciones en bóvidos. En humanos, es comúnmente asociado con bronquiolitis y neumonía[12].
- Virus parainfluenza tipo 4 (VPI-IV): Contiene dos serotipos denominados 4A y 4B. No constituye una causa frecuente de enfermedades graves y es poco detectado en humanos[12]. Constituye el único tipo de los VPI que no es capaz de escapar a la acción del interferón del organismo huésped, aunque es capaz de formar un complejo con sus moléculas no logra disminuir sus niveles de concentración intracelular[3].
Poseen también otras espículas responsables de la acción hemolítica y de fusión (proteína F), lo cual los hace capaces de fusionar células y hemolizar ciertos tipos de eritrocitos, esto los diferencia de los virus influenza. Estos virus se reconocen por la acción citopática en las células infectadas o por las reacciones de hemabsorción con glóbulos rojos de cobayo en monocapas de células infectadas. Estos virus causan infecciones respiratorias frecuentes y de gravedad variable, que dependen del tipo de virus y sobre todo de la edad del huésped, en relación directa con la producción de primoinfecciones o reinfecciones. Los tipos 1, 2 y 3 se reconocen como los principales agentes causales del croup, aunque también pueden causar neumonías y bronquiolitis. Los virus parainfluenza, especialmente los tipos 1 y 2 son responsables de más de 50% de los casos de croup o laringitis obstructiva. Las bronquiolitis asociadas al tipo 3, pueden presentarse a partir del primer mes de vida, ocurren durante todo el año y aparecen en brotes epidémicos. Los virus parainfluenza tienen una distribución geográfica mundial. En general, la enfermedad que causan es leve, los síntomas varían dependiendo del tipo de infección y es común que se presenten síntomas similares al resfriado, como rinorrea y tos leve. Los síntomas respiratorios potencialmente mortales se pueden observar en bebés más pequeños que tienen bronquiolitis y en aquéllos con sistemas inmunitarios debilitados[14].
Los cuatro tipos son capaces de causar infecciones respiratorias habiéndose demostrado reinfecciones en adultos y niños, particularmente causadas por el serotipo 3. Estos agentes generalmente infectan a individuos de corta edad. Los tipos 1 y 2 causan epidemias en otoño. El tipo 3 causa enfermedad todo el año. En un estudio serológico se indica que 60% de los niños se infecta por parainfluenza 3 en el transcurso de los 2 primeros años de vida y aproximadamente 80% se infecta antes de los 4 años, la mayoría en forma asintomática. La alta tasa de infección sugiere una diseminación rápida. Puede causar enfermedad grave en lactantes como lo hace el VSR, pero esa gravedad disminuye a partir de los 3 años. Es poco frecuente una enfermedad tan grave que requiera internación hospitalaria. Por lo general la excreción de virus es de corta duración, por lo cual estos virus deben aislarse de aspirados traqueales o nasofaríngeos tomados tempranamente. La muestra clínica se inocula en diferentes líneas celulares, especialmente líneas primarias de riñón de mono (aunque también pueden usarse líneas establecidas LLC-MK2 o MDCK), manteniendo las células en medio libre de suero. Algunas veces pueden presentar efecto citopático y en otras es necesario reconocer la presencia viral en los cultivos con pruebas de hemadsorción (Had), con eritrocitos de cobayo a 4° C. La identificación del virus puede realizarse por IF, inhibición de la hemadsorción o neutralización con antisueros específicos[15]. El virión de este género es inestable en el medioambiente por lo que logra sobrevivir solo unas pocas horas en superficies expuestas y se inactiva fácilmente con jabón y agua, de ahí la importancia del lavado de manos en su prevención[16].
Virus sincitial respiratorio (VSRH)
El VSR fue descrito en 1956[17]por J.A. Morris en Estados Unidos de Norteamérica, posee como material genético al ARN. Las partículas virales son pleomórficas, miden entre 90 y 130 nm y característicamente inducen la formación de sincitios (agrupación de células) en tejidos celulares. Han sido descritos dos grupos de VRS: A y B, dentro de los cuáles existen subgrupos, pertenece al género pneumovirus y a la familia paramixoviridae[18], es un virus no segmentado, con una cadena simple de ARN en sentido negativo; contiene 10 genes que encodan 11 proteínas, sobresaliendo las proteínas G y F. Ambas son de importancia fisiopatológica, la proteína G[19]se adhiere al epitelio respiratorio y la proteína F facilita la penetración del virus, la inserción del ARN dentro de la célula del huésped y la formación de sincicios, además estas proteínas constituyen los mayores determinantes antigénicos virales que inducen la formación de anticuerpos neutralizantes. Las variantes antigénicas de la proteína G y de las proteínas F, N y P, son las que determinan los dos tipos distintos de VSR: A y B. Por otra part e, en el año 2001 se aisló por primera vez un agente viral llamado metaneumovirus humano (MNVH), aunque existe un reporte original que data de 1958, en que fue aislado de muestras serológicas de niños. Este virus comparte características muy importantes con el VSR, ya que también es un virus ARN, que pertenece al mismo género y familia, el índice de incidencia de infecciones provocadas por el MNVH es menor que las ocasionadas por el VSR[20].
Morfología
El VSR mide entre 100 y 300 nm y posee un manto - bicapa lipídica que deriva de la membrana citoplasmática de la célula huésped- que recubre una cápsula de simetría helicoidal. Esta contiene al genoma viral constituido por una hebra de ARN lineal de polaridad negativa de 15,2 kb de longitud, que codifica para 10 proteínas. Entre ellas se encuentran las glicoproteínas (gp) F y G que forman las espículas que sobresalen del manto; la proteína hidrofóbica pequeña no glicosilada -SH- de función desconocida; las proteínas no glicosiladas M (28 kDa) y M2 (22 kDa) que constituyen la capa proteica entre la cápsula y el manto, denominada matriz viral; la nucleoproteína N, la fosfoproteína P y la polimerasa L que conforman la cápsula del virus y se asocian al ARN genómico, y dos proteínas no estructurales - NS1 (15 kDa) y NS2 (14 kDa), capaces de inhibir la acción del interferón, presentes en muy pequeña cantidad en los viriones, pero que se acumulan en las células infectadas.
La proteína de fusión F es muy conservada entre las distintas cepas de VRS, siendo fundamental para el ingreso del virus a la célula y su diseminación entre ellas al fusionar las membranas, determinando los característicos sincitios (células gigantes multinucleadas) de esta infección. La proteína G participa en la unión al receptor celular y varía entre los VRS, especialmente en su porción extracelular. Existe sólo un serotipo de VRS, aunque a nivel antigénico y genético se diferencian dos grupos virales, A y B(1,2), principalmente en base a los cambios en la proteína G. Asimismo, dentro de cada grupo existen variantes virales identificadas por distintos métodos, como la digestión enzimática de los genes N y G, obteniéndose patrones de restricción (NP1-11), y por los análisis filogenéticos de la secuencia nucleotídica del gen de la gpG, estableciéndose genotipos virales. Se han definido 8 genotipos (GA1-GA5) entre los VRS del grupo A y 10 genotipos (GB1-GB4, URU1, URU2, BA) entre los B. Su importancia clínica reside en que la coinfección con el VSR, produce cuadros clínicos más severos. Esto tiene trascendencia clínica y epidemiológica pues estudios serológicos revelan que la mayoría de los niños a los 5 años de edad ya se han expuesto al MNVH10[21].
Patogenia
Afecta al 50-65% de niños durante el primer año de vida y a los tres años de edad se estima que el 100% han tenido contacto con el VRS en algún momento. Entre 25-40% de niños infectados por VRS desarrollan infección del tracto respiratorio inferior. Aunque las tasas de mortalidad son bajas (<1%) en ciertas poblaciones de riesgo llegan hasta un 3%[22]. Se considera que VSR es el causante del 50 a 90% de las bronquiolitis en el lactante, y del 5 al 40% el desarrollo de la técnica de PCR múltiple, en un mismo proceso puede realizarse la amplificación simultánea de varios virus, lo que disminuye el costo de la prueba. Es conveniente señalar que la detección de antígenos y cultivos utilizados hasta ahora para identificar VSR, y virus de la influenza y parainfluenza no son suficientemente rápidos o sensibles para el diagnóstico de muestras que contienen mínimo material celular. Además, la detección de antígenos puede no ser capaz de identificar nuevas variantes de virus emergentes que tengan alteraciones en la secuencia de aminoácidos, proteínas de la cubierta o cápside externa.
Actualmente existen dos opciones de inmunoprofilaxis para el VSR en pacientes pediátricos de alto riesgo. La primera es el uso de la inmunoglobulina intravenosa contra VSR (VSR-IGIV). Esta fue autorizada por la Administración de Alimentación y Drogas (FDA) por sus siglas en Inglés, en enero de 1996 para la prevención de infecciones severas por VSR en niños menores de 24 meses de edad con enfermedad pulmonar crónica, o en prematuros de menos de 35 semanas de gestación. La VSR-IGIV se obtiene de plasma de donadores con títulos elevados de anticuerpos neutralizantes para VSR, y se administra mensualmente cuidadosos ensayos clínicos en hospitales de nuestro medio[23]. En individuos adultos solo produce síntomas similares a los de la gripe común: congestión nasal, dolor en la garganta, dolor de cabeza, tos, fiebre y malestar general[24].
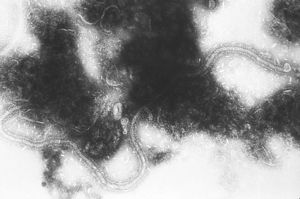
Virus del sarampión
El virus del sarampión (VS) pertenece al género de los Morbillivirus, que agrupa a los virus del moquillo canino, virus de la peste bovina, virus de los pequeños rumiantes, morbillivirus de los fócidos, y al morbillivirus de los delfines. El genoma de los virus salvajes del sarampión es una molécula de RNA de 15984 nucleótidos, codifica por las proteínas estructurales: N (nucleocápsida), P (fosfoproteína), L (polimerasa), M (matriz), H (hemaglutinina) y F (de fusión) que se incorporan a las partículas víricas, y otras no estructurales V y C que se encuentran solamente en las células infectadas[25]. Tiene dos glicoproteínas: la hemoaglutinina (H) y la aglutinina fusión (F) que son muy importantes para la respuesta de protección inmune.
Dicha respuesta incluye en los niños infectados anticuerpos a la glicoproteína H y la fusión de las células nucleadas con formación de células gigantes multinucleadas (F). Las proteínas H y F son las proteínas responsables de la fusión del virus con la célula huésped y la inclusión dentro de éste mientras que los receptores de la célula humana son el CD46 y CD150. La vacuna aplicada para esta enfermedad produce en el individuo anticuerpos dirigidos contra las proteínas de la superficie del virus, en particular, contra la proteína H. Han sido reportados 23 genotipos o variantes genéticas por parte de la OMS, agrupados en ocho serotipos (A-H) y la tasa de mutación de los genomas es comparativamente baja. Es responsable de más del 10 % del total de defunciones de menores de 5 años que se producen en el mundo anualmente, de las cuales la mitad corresponde a menores de 1 año. El virus del sarampión puede ocasionar diversas complicaciones asociadas con neumonía, diarrea y desnutrición. También puede producir, especialmente en los países en desarrollo, discapacidades permanentes como lesiones cerebrales, ceguera y sordera[26].
Mixovirus parotiditis
El Mixovirus parotiditis, es un virus con ARN como material genético que pertenece al género Rubulavirus, subfamilia Paramyxovirinae y a la familia Paramyxoviridae. El virión tiene una configuración redondeada con un contorno irregular y mide aproximadamente 150 nm recubierto de una cápside lipídica. Se ha descrito un solo un serotipo con diferentes subtipos en todo el mundo del cual el hombre es el único reservorio. Causada por este virus, descrita por Hipócrates en el siglo V antes de Cristo y conocida tradicionalmente como paperas, la parotiditis es una enfermedad contagiosa aguda caracterizada por aumento de volumen sin supuración de una o ambas glándulas parótidas. Pueden ocurrir afectaciones en otros órganos como son los testículos, ovarios y el Sistema Nervioso Central (SNC).
Para que se produzca el contagio de esta enfermedad es necesario un contacto directo con la persona afectada. La infección natural se inicia por aerosoles de secreciones respiratorias de una persona infectada a una susceptible, iniciándose la replicación del virus a nivel del epitelio de la mucosa del aparato respiratorio superior. Posteriormente el virus pasa a los ganglios regionales con la subsecuente diseminación a la sangre; produciéndose, de esta forma, una viremia primaria y la aparición de la inflamación de las glándulas salivales. Luego de esta etapa se inicia una viremia secundaria que permita la infección de otros órganos y tejidos del cuerpo. Esta enfermedad puede ser prevenida mediante vacunación y su aplicación se realiza comúnmente en combinación con la del sarampión y la rubéola mediante la vacuna triple viral o MMR[27].
Enlaces externos
- Imágenes de virus en: Virus Images. Foundations of Virology (sitio en Inglés).
- ViralZone (sitio en Inglés).
- Base de datos de taxonomía animal (sitio en Inglés).
- Base de datos de enfermedades. Información sobre la Parainfluenza (sitio en Inglés).
- Centro Nacional para la inmunización y las enfermedades respiratorias. Parainfluenza (sitio en Inglés).
- Recapitulaciones sobre Virología Clínica. Parainfluenza (sitio en Inglés).
Referencias
- ↑ Daniel Kolakofsky, Thierry Pelet, Dominique Garcin, Stéphane Hausmann, Joseph Curran, y Laurent Roux. Revista de Virología. Paramyxovirus RNA Synthesis and the Requirement for Hexamer Genome Length: the Rule of Six Revisited (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- ↑ M.V. Marialys Navarro Bravo. Enfermedad de Newcastle (en línea). Consultado: 18 de mayo de 2012. Disponible en: monografias.umcc.cu
- ↑ 3,0 3,1 Machiko Nishio, Masato Tsurudome, Morihiro Ito, and Yasuhiko Ito. Revista de Virología. Human Parainfluenza Virus Type 4 Is Incapable of Evading the Interferon-Induced Antiviral Effect (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- ↑ Rubulavirus. Molecular biology. ViralZone (en línea). Consultado: 19 de mayo de 2012. Disponible en: viralzone.expasy.org
- ↑ Morbillivirus. Molecular biology. ViralZone (en línea). Consultado: 18 de mayo de 2012. Disponible en: viralzone.expasy.org
- ↑ Andrew J. Easton, Joseph B. Domachowske, y Helene F. Rosenberg. Ensayos en Microbiología Clínica. Pneumovirus en animales: Genética molecular y patogenia (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- ↑ Edith Arellanes, Martha C. Fuentes,Rosalba Carreón, Humberto Ramírez. Inoculación experimental del Paramixovirusdel ojo azul en el gato doméstico (Felis catus) (en línea). Consultado: 13 de mayo de 2012. Disponible en: www.medigraphic.com
- ↑ Kelly J. Henrickson. Clinical Microbiology Reviews. Parainfluenza Viruses (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- ↑ Luis E. Vega-Briceño, Dahiana Pulgar B., Marcela Potin S., Marcela Ferres G. e Ignacio Sánchez D. Revista chilena de infectología (versión impresa ISSN 0716-1018). Características clínicas y epidemiológicas de la infección por virus parainfluenza en niños hospitalizados (en línea). Consultado: 13 de mayo de 2012. Disponible en: www.scielo.cl
- ↑ Raija Vainionpaa, Timo Hyypia. Biología de los Virus Parainfluenza (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- ↑ Public Health Agency of Canada. Human Parainfluenza Virus (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.phac-aspc.gc.ca
- ↑ 12,0 12,1 12,2 12,3 Human Parainfluenza Viruses. Clinical Features of human parainfluenza viruses (HPIVs) (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.cdc.gov
- ↑ Machiko Nishio, Junpei Ohtsuka, Masato Tsurudome, Tetsuya Nosaka, y Daniel Kolakofsky. Revista de Virología. Human Parainfluenza Virus Type 2 V Protein Inhibits Genome Replication by Binding to the L Protein: Possible Role in Promoting Viral Fitness (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- ↑ Parainfluenza. MedlinePlus (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.nlm.nih.gov
- ↑ Mercedes C. Weissenbacher, Dra. María M. Ávila. Los virus como causa de IRA alta y baja en niños: características generales y diagnóstico (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.paho.org.
- ↑ Definition of Human parainfluenza virus. MedicineNet (en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: www.medterms.com
- ↑ Dra. Clara Savón Valdés. Virus respiratorio sincitial humano (en línea). Consultado: 13 de mayo de 2012. Disponible en: www.paho.org
- ↑ Dr. Marte Hernández Porras, Dra. Patricia Saltigeral Simental. Revista de Enfermedades Infecciosas en Pediatría Vol. XXI Núm. 84. La importancia del virus sincicial respiratorio (en línea). Consultado: 13 de mayo de 2012. Disponible en: www.medigraphic.com
- ↑ Kalina T. Zlateva, Philippe Lemey, Elien Moës, Anne-Mieke Vandamme, y Marc Van Ranst. Revista de Virología (2012). Variabilidad genética y evolución molecular del Virus sincitial respiratorio humano, subgrupo B. Proteína G. (en línea). Consultado: 18 de mayo de 2012. Disponible en: jvi.asm.orgck
- ↑ Respiratory Syncytial Virus (RSV) and Human Metapneumovirus Infections. The Merck Manual (en Inglés)(en línea). Consultado: 19 de mayo de 2012. Disponible en: www.merckmanuals.com
- ↑ Dra. Vivian Luchsinger PhD. Conociendo al VRS (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.neumologia-pediatrica.cl
- ↑ O. RAMILO. Southwestern Medical Center. Dallas. EE.UU. Virus respiratorio sincitial: antiguos retos y nuevas estrategias (en línea). Consultado: 13 de mayo de 2012. Disponible en: www.sccalp.org
- ↑ Manuel Alberto Cano-Rangel, Gerardo Álvarez-Hernández, Roberto Dorame-Castillo, Jesús Contreras-Soto. Infecciones por Virus Sincicial Respiratorio en Pediatría (en línea), 2007. Consultado: 13 de mayo de 2012. Disponible en: www.medigraphic.com
- ↑ Acerca del virus respiratorio sincitial. FamilyDoctor (en línea). Consultado: 19 de mayo de 2012. Disponible en: kidshealth.org
- ↑ Rafael Fernández-Muñoz, Juan Carabaña, Montserrat Caballero, Paloma B. Liton, Beatriz M Duque, Dolores García-Villalón y María Luisa Celma. Revista Española de Salud Pública (versión impresa ISSN 1135-5727). Epidemiología molecular del virus del sarampión (en línea). Consultado: 18 de mayo de 2012. Disponible en: scielo.isciii.es
- ↑ Lic. María Teresa Carballo López, Lic. Milady García Torres y Dr. Miguel Ángel Galindo Sardiña. Revista Cubana de Higiene y Epidemiología (versión On-line ISSN 1561-3003). El sarampión: una realidad y un desafío (en línea). Consultado: 19 de mayo de 2012. Disponible en: scielo.sld.cu
- ↑ Paperas. MedlinePlus (en línea). Consultado: 19 de mayo de 2012. Disponible en: www.nlm.nih.gov
Fuentes
- Alina Llop Hernández, Margarita Valdés-Dapena Vivanco, Jorge Luis Zuazo Silva. Microbiología y Parasitología Médicas II. Editorial Ecimed, La Habana, 2001. ISBN 959-7132-54-0
- Diccionario Terminológico de Ciencias Médicas, undécima edición. Editorial Científico-Técnica. La Habana, 1984.
- Xia-qing Li, Zhen F. Fu1, Rene Alvarez, Christine Henderson, y Ralph A. Tripp. Revista de Virología (2012). Respiratory Syncytial Virus (RSV) Infects Neuronal Cells and Processes That Innervate the Lung by a Process Involving RSV G Protein (en línea). Consultado: 18 de mayo de 2012. Disponible en: jvi.asm.org
- Lic. Duilia Tovar. Síndrome Respiratorio Agudo Severo. Aspectos virológicos y diagnóstico viral (en línea). Consultado: 13 de mayo de 2012. Disponible en: caibco.ucv.ve
- ViralZone. Paramyxoviridae, biología molecular (sitio en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: viralzone.expasy.org
- Virus sincitial respiratorio, genoma completo (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- Virus Pathogen Resource (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.viprbrc.org
- Philippa J. M. Jack, David B. Boyle, Bryan T. Eaton, y Lin-Fa Wang1. Revista de Virología (agosto de 2005). The Complete Genome Sequence of J Virus Reveals a Unique Genome Structure in the Family Paramyxoviridae (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- Phillip Spencer Gould, Andrew John Easton. Coupled translation of the second open reading frame of M2 mRNA is sequence dependent and differs significantly within the subfamily Pneumovirinae (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- Ah-Tye C, Schwartz S, Huberman K, Carlin E, Moscona A. Virus-receptor interactions of human parainfluenza viruses types 1, 2 and 3 (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- World Health Organization (WHO). Initiative for Vaccine Research (IVR), Acute Respiratory Infections (Update September 2009). Respiratory syncytial virus and parainfluenza viruses (en Inglés) (en línea). Consultado: 18 de mayo de 2012. Disponible en: www.who.int
- Paramyxoviridae. Registro taxonómico (sitio en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- Lodish H, Berk A, Zipursk. Molecular Cell Biology. Viruses: Structure, Function, and Uses (en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: www.ncbi.nlm.nih.gov
- Eugene V Koonin, Tatiana G Senkevich y Valerian V Dolja. The ancient Virus World and evolution of cells (en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: www.biology-direct.com
- A.M. Galazka, S.E. Robertson, y A. Kraigher. Mumps and mumps vaccine: a global review ( en Inglés) (en línea). Consultado: 19 de mayo de 2012. Disponible en: whqlibdoc.who.int