Neumonía neumocócica
| ||||
Neumonía neumocócica. Causada por Streptococcus pneumoniae. Es la causa identificable más frecuente de neumonía bacteriana y causa dos terceras partes de las neumonías bacteriémicas extrahospitalarias. La neumonía neumocócica suele ser esporádica, se produce sobre todo en invierno y afecta con más frecuencia a pacientes de edades extremas.
Los estudios sobre la flora faríngea demuestran que del 5 al 25% de las personas sanas son portadoras de neumococos, obteniendo las cifras más elevadas en invierno en los niños y en los padres con niños pequeños. Existen >80 serotipos (en función de los polisacáridos de la cápsula característicos antigénicamente).
Sumario
Anatomía patológica y patogenia
Los neumococos suelen llegar al pulmón mediante inhalación o aspiración. Se alojan en los bronquiolos, donde proliferan e inician un proceso inflamatorio que empieza en los espacios alveolares con la extravasación de un líquido rico en proteínas. Este líquido se comporta como un medio de cultivo para las bacterias y les permite extenderse hacia los alvéolos adyacentes, produciendo una neumonía lobar típica. La congestión es el estadio más precoz de la neumonía lobar y se caracteriza por un exudado seroso extenso, con ingurgitación vascular y proliferación bacteriana rápida.
El siguiente estadio se denomina hepatización roja, término que refleja el parecido del pulmón consolidado con el hígado. Los espacios aéreos se rellenan de polimorfonucleares, se observa congestión vascular y la extravasación eritrocitaria hace que el pulmón tenga un aspecto macroscópico rojizo. El siguiente estadio es el de hepatización gris, en el que la acumulación de fibrina se asocia con inflamación por polinucleares y presencia de hematíes en distintos estadios de desintegración y los espacios alveolares están llenos de un exudado inflamatorio. El estadio final es la resolución, que se caracteriza por la reabsorción del exudado.
Síntomas y signos
La neumonía neumocócica suele venir precedida por una infección respiratoria alta. Su comienzo suele ser abrupto, con un único escalofrío; la presencia de escalofríos persistentes debe sugerir otro diagnóstico. Después de este escalofrío se suele presentar fiebre, dolor al respirar en el lado afectado (pleuritis), tos, disnea y producción de esputo. El dolor puede ser referido y, cuando se afectan los lóbulos inferiores, puede sugerir una sepsis intraabdominal, como la apendicitis. La temperatura sube con rapidez de 38 a 40,5 °C, el pulso suele alcanzar 100 a 140 latidos/min y las respiraciones se aceleran hasta 20 a 45 respiraciones/min. Otros hallazgos frecuentes son náuseas, vómitos, malestar y mialgias. La tos puede ser seca en estadios iniciales, pero suele hacerse productiva y purulenta, con un esputo con estrías de sangre o herrumbroso. En muchos pacientes, sobre todo los de edades extremas, los síntomas pueden ser más insidiosos.
Los hallazgos de la exploración física varían en función del carácter del proceso y del estadio en el que se evalúa al paciente. Se pueden observar signos típicos de consolidación lobar o derrame pleural. En la bronconeumonía el hallazgo más habitual son estertores.
Complicaciones
Entre las complicaciones graves y potencialmente mortales destacan la neumonía progresiva, en ocasiones asociada con un síndrome de distrés respiratorio del adulto y/o shock séptico. Algunos pacientes desarrollan infecciones en zonas contiguas (empiema o pericarditis purulenta). Se produce derrame pleural en un 25% de los pacientes a nivel radiológico, pero <1% tienen empiema. La bacteriemia puede producir infecciones extrapulmonares, como artritis séptica, endocarditis, meningitis y peritonitis (en los pacientes con ascitis). Algunos pacientes desarrollan sobreinfecciones pulmonares, caracterizadas porque tras una mejoría temporal con el tratamiento reaparece la fiebre y empeoran los infiltrados pulmonares.
Diagnóstico
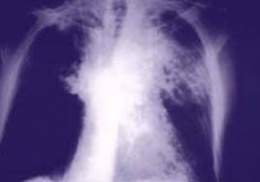
Se debe sospechar una neumonía neumocócica en cualquier paciente con una enfermedad febril asociada con dolor torácico, disnea y tos. El diagnóstico de presunción se basa en la historia, la radiografía de tórax, el cultivo y el Gram de las muestras apropiadas o la reacción de impregnación. El diagnóstico definitivo pasa por la demostración de S. pneumoniae en el derrame pleural, la sangre, el tejido pulmonar o en aspirados transtraqueales. Al menos la mitad de los cultivos de esputo obtienen resultados falsos negativos. Las pruebas hematológicas suelen mostrar leucocitosis con desviación izquierda. Los hemocultivos positivos son una evidencia definitiva de infección neumocócica. Se puede producir una hipoxemia por la mala aireación del pulmón y alcalosis respiratoria por hiperventilación. La tinción de Gram del esputo demuestra diplococos en forma de lanceta típicos en cadenas cortas. Se puede confirmar de forma definitiva que estos estreptococos corresponden a S. pneumoniae mediante la reacción de impregnación, en la que se produce edema de la cápsula del germen cuando se expone a la aplicación de antisuero neumocócico polivalente; esta prueba consigue información de inmediato, pero debe ser interpretada por una persona experimentada y no suele realizarse. Como alternativa, algunos laboratorios emplean la contrainmunoelectroforesis para determinar los serotipos de las cadenas aisladas o para detectar casos empleando muestras de esputo, orina u otros líquidos corporales. Una radiografía de tórax muestra de forma invariable presencia de infiltrados pulmonares, aunque dichas alteraciones pueden ser mínimas o no ser detectables durante las primeras horas. Los hallazgos de bronconeumonía son los más frecuentes, pero se puede reconocer una condensación densa en un solo lóbulo (neumonía lobar) con broncograma aéreo, más característica de la infección por S. pneumoniae.
Pronóstico
Aunque la morbilidad y la mortalidad por neumonía neumocócica han disminuido de forma sustancial con la introducción de la penicilina, el neumococo justifica un 85% de todos los casos mortales de neumonía extrahospitalaria en los que se conoce el agente causal. La mortalidad global es del 10% y el tratamiento produce un efecto mínimo sobre la misma durante los primeros 5 d de la enfermedad. Los factores que permiten suponer un mal pronóstico incluyen las edades extremas, sobre todo <1 año o >60 años, los hemocultivos positivos, la afectación de más de un lóbulo, una leucocitosis inferior a 5.000, la presencia de enfermedades asociadas (cirrosis, insuficiencia cardíaca, inmunosupresión, agammaglobulinemia, asplenia funcional o anatómica y uremia), la afectación por determinados serotipos (sobre todo 3 y 8) y el desarrollo de complicaciones extrapulmonares (endocarditis y meningitis). En los pacientes con enfermedad leve que se tratan de forma precoz suele desaparecer la fiebre en 24 a 48 h; sin embargo, en los pacientes graves, sobre todo cuando presentan alguna de las características descritas antes, la fiebre tarda al menos 4 días en desaparecer. No se debe modificar el tratamiento si se produce una mejoría clínica gradual y se confirma la etiología. Cuando los pacientes no mejoran, se deben valorar los siguientes factores: diagnóstico etiológico erróneo; reacción farmacológica adversa; enfermedad más evolucionada (el más frecuente); sobreinfección; defensas inadecuadas del huésped por enfermedades asociadas; falta de cumplimiento del tratamiento en enfermos ambulatorios; resistencia a antibióticos de la cepa de S. pneumoniae, y complicaciones como empiema, que precisan drenaje o focos metastásicos de infección que exigen una dosis mayor de penicilina (meningitis, endocarditis o artritis séptica).
Profilaxis
Se dispone de una vacuna que contiene 23 antígenos polisacáridos específicos de los tipos de neumococos que causan un 85 a 90% de las infecciones neumocócicas graves. La mayor parte de los niños >2 años y los adultos responden en 2 a 3 sem a la vacunación; sin embargo, no está indicado determinar los títulos de anticuerpos porque se desconocen los niveles protectores exactos. Un 50% de los pacientes vacunados desarrollan eritema y/o dolor en el sitio de la inyección, un 1% presentan fiebre, mialgias o una reacción local grave y 5 de cada millón desarrollan una reacción anafilactoide u otras reacciones graves. Se recomienda la vacunación de niños >2 años y adultos con riesgo elevado de enfermedad neumocócica o sus complicaciones, como los pacientes con enfermedades crónicas (sobre todo cardiovasculares y pulmonares), disfunción esplénica, asplenia anatómica, enfermedad de Hodgkin, mieloma múltiple, diabetes mellitus, infección por VIH, cirrosis, alcoholismo, insuficiencia renal, trasplante de órganos u otras enfermedades que producen inmunosupresión, los niños con nefrosis, los adultos mayores, sobre todo los mayores de 65 años en apariencia sanos, y los pacientes con fuga de LCR. La respuesta de anticuerpos está reducida en los pacientes inmunosuprimidos. Los niños con anemia drepanocítica u otras causas de asplenia deben recibir penicilina profiláctica y ser vacunados frente al neumococo. Las infecciones respiratorias altas en los niños (incluidas las otitis medias y las sinusitis) no se consideran criterio para vacunar. Se desconoce cuánto dura la protección, aunque parece que el período es prolongado. En los pacientes de alto riesgo algunos autores aconsejan la revacunación a los 5 a 10 años. Los pacientes revacunados antes de los 5 años tienen una reacción local más intensa.
Tratamiento
En el caso de las cepas de S. pneumoniae sensibles de la penicilina, se prefiere la penicilina G; los pacientes que no estén graves pueden ser tratados con penicilina G o V 250 a 500 mg v.o. cada 6 h. El régimen recomendado para el tratamiento parenteral de la neumonía neumocócica no complicada es la penicilina G acuosa de 500.000 a 2.000.000 de U i.v. cada 4 a 6 h. Un 25% de las cepas de S. pneumoniae son resistentes a la penicilina. La prevalencia de resistencia relativa o de alto grado a la penicilina en las cepas aisladas en clínica van desde el 15 al 30% en Estados Unidos, aunque son más elevadas en otras partes del mundo, sobre todo España, Japón, Israel, Suráfrica y este de Europa. Muchas cepas resistentes a la penicilina lo son también a otros antibióticos. El disco de 1 g de oxacilina se considera un método apropiado para detectar cepas resistentes. Las muestras con zonas 19 mm deben valorarse con una dilución de cultivo. En el caso de cepas muy resistentes, el tratamiento se debe basar en las pruebas de sensibilidad in vitro. La mayor parte de las cepas resistentes responden a dosis altas de penicilina, cefotaxima o ceftriaxona. Las quinolonas más recientes (levofloxacino, sparfloxacino, grepafloxacino y trovafloxacino) son el tratamiento preferido para las cepas resistentes a penicilina y se considera como una alternativa a la penicilina en las sensibles. La vancomicina, el único fármaco con actividad constante, es activa contra todas las cepas de S. pneumoniae y se puede elegir en pacientes muy graves en zonas con grandes tasas de resistencia. Los fármacos alternativos con eficacia demostrada incluyen las cefalosporinas, la eritromicina y la clindamicina. Como la actividad de las tetraciclinas frente a S. pneumoniae resulta menos predecible, no se deben emplear en los pacientes graves. Los regímenes de tratamiento orales incluyen eritromicina o clindamicina, 300 mg cada 6 h. Los regímenes parenterales incluyen cefotaxima 1 a 2 g i.v. cada 6 h, ceftriaxona 1 a 2 g i.v. cada 12 h, cefazolina 500 mg i.v. cada 8 h, eritromicina 500 mg a 1 g i.v. cada 6 h o clindamicina 300 a 600 mg a 1 g i.v. cada 6 a 8 h. La mayoría de las cefalosporinas de tercera generación distintas a la cefotaxima y la ceftizoxima son relativamente inactivas contra S. pneumoniae. Cuando se sospecha una meningitis, el paciente debe recibir 2 g de cefotaxima i.v. cada 4 a 6 h o ceftriaxona 1 a 2 g i.v. cada 12 h asociado o no con 600 mg/d de rifampicina v.o. hasta que se conozcan los resultados de las pruebas de sensibilidad. En los pacientes con empiema, el tratamiento debe incluir el drenaje adecuado y la antibioterapia parenteral. Las medidas de sostén incluyen el reposo en cama, los líquidos y los analgésicos para el dolor pleurítico. Se administra O2 a los pacientes con cianosis, hipoxemia significativa, disnea grave, alteraciones circulatorias o delirio. En los pacientes con broncopatía crónica, se debe administrar O2 con cuidado con control frecuente de la gasometría arterial. La radiología de control se suele aconsejar en pacientes >35 años, pero la resolución del infiltrado radiológico puede tardar varias semanas, sobre todo cuando la enfermedad es grave, existe bacteriemia o una neumopatía crónica previa. La infiltración que persiste 6 sem después del tratamiento debe sugerir un posible tumor broncogénico asociado o TBC.